자유방사성 노화론
Free-radical theory of aging노화의 자유 급진 이론은 세포가 시간이 지남에 따라 자유로운 급진적 피해를 축적하기 때문에 유기체가 노화한다고 말한다.[1]프리 래디컬은 외부 껍질 안에 하나의 전자가 손상되지 않은 어떤 원자나 분자를 말한다.[2]멜라닌과 같은 몇몇 활성산소는 화학적으로 반응하지 않지만, 대부분의 생물학적으로 관련된 활성산소는 반응성이 매우 높다.[3]대부분의 생물학적 구조물의 경우, 자유 급진적 손상은 산화적 손상과 밀접하게 관련되어 있다.산화방지제는 활성산소로부터 활성산소로부터 항산화하여 생물학적 구조물에 대한 산화 손상을 제한하고 있다.[4]
엄밀히 말하면 자유급성 이론은 과산화수소(O2− )와 같은 활성산소만을 염두에 두고 있을 뿐, 이후 과산화수소(HO22)나 과산화수소(OOON−)와 같은 다른 활성산소종(ROS)으로부터의 산화적 피해를 포괄하는 것으로 확대되었다.[4]
덴햄 하만은 1950년대에 처음으로 자유 급진적인 노화 이론을 제안했고,[5] 1970년대에 이 아이디어를 ROS의 미토콘드리아 생산을 포함하도록 확대했다.[6]
효모나 드로소필라와 같은 일부 모형 유기체에서는 산화 손상을 줄이면 수명을 연장할 수 있다는 증거가 있다.[7]그러나 생쥐의 경우 항산화 방어를 막는 유전자 변형(SOD-1 삭제) 18건 중 1건만 수명을 단축했다.[8]마찬가지로 회충(세뇨르하브디트리스 선충)에서도 자연적으로 발생하는 산화방지제의 생산을 막는 것이 최근 수명을 늘리는 것으로 나타났다.[9]산화성 손상을 정상 수준 이하로 줄이는 것이 수명을 연장하기에 충분한지 여부는 여전히 열려 있고 논란의 여지가 있는 문제로 남아 있다.
배경
자유 급진주의 노화 이론은 1950년대에 덴햄 하먼에 의해 구상되었는데, 이때 자유 급진주의 이론은 생물계에 존재하기에는 너무 불안정하다는 과학적 의견이 지배적이었다.[10]이것은 또한 퇴행성 질환의 원인으로 활성산소를 유발하기 전의 일이었다.[11]두 소식통 Harman:다음 산소 소비량에 비례한 것은 신진대사적 비율의 1)그 수명을 살아 있는 이론의 비율은 반비례 함수, 그리고 2)Rebbeca Gershman의 관찰은 고압 산소 독성과 방사선 독성은 같은 내부 현상:산소 유리기로 설명될 수 있도록 고무시켰다.[10][12]하만은 방사선이 '혼란, 암, 노화'를 일으킨다는 점에 주목하며 정상 호흡 중에 생성되는 산소 활성산소가 누적된 손상을 일으켜 결국 유기체의 기능성을 상실하고 결국 사망에 이르게 될 것이라고 주장했다.[10][12]
후년에 자유 급진 이론이 확장되어 연령별 노화뿐만 아니라 연령별 질병도 포함되었다.[11]세포 내의 자유로운 급진적 손상은 암, 관절염, 아테롬성 동맥경화증, 알츠하이머병, 당뇨병을 포함한 다양한 질병과 연관되어 있다.[13]활성산소와 일부 반응성 질소 종들이 세포사멸 메커니즘을 유발하고 증가시킨다고 암시하는 몇몇 증거가 있다. 사멸과 극단적인 경우 괴사.[14]
1972년 하만은 자신의 원래 이론을 수정했다.[11]현재 형태에서 이 이론은 미토콘드리아에서 생성되는 활성산소종(ROS)이 지질, 단백질, 그리고 가장 중요한 미토콘드리아 DNA를 포함한 특정 고분자에 손상을 입힌다는 것을 제안한다.[15]이러한 손상은 돌연변이를 일으켜 ROS 생산량을 증가시키고 세포 내 활성산소의 축적을 크게 강화시킨다.[15]이 미토콘드리아 이론은 노화 과정에 기여하는 데 큰 역할을 할 수 있다는 것이 더 널리 받아들여졌다.[16]
하만이 처음으로 자유 급진적 노화론을 제안한 이래, 그의 원래 이론에 대한 수정과 연장이 계속되어 왔다.[16]
과정
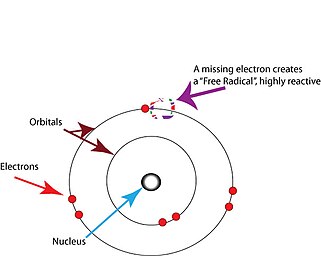
활성산소(free acticas)[2]는 손상되지 않은 전자를 포함하는 원자나 분자를 말한다전자는 보통 원자나 분자의 특정 궤도에 짝을 지어 존재한다.[17]어떤 궤도에도 하나의 전자만 들어 있는 활성산소는 보통 여분의 전자를 잃거나 집는 쪽으로 불안정하기 때문에 원자나 분자의 모든 전자가 쌍을 이루게 된다.[17]
손상된 전자는 전하를 의미하지 않는다; 활성산소는 양전하, 음전하 또는 중성일 수 있다.
손상은 프리 래디컬이 다른 분자와 마주쳤을 때 발생하며, 자신의 손상되지 않은 전자를 결합할 다른 전자를 찾으려 할 때 발생한다.프리 래디컬은 종종 이웃한 분자로부터 전자를 끌어내어 영향을 받은 분자가 프리 래디컬 그 자체가 되게 한다.이 새로운 프리 래디컬은 다음 분자에서 전자를 끌어낼 수 있고, 급진적인 생산의 화학 연쇄 반응이 일어난다.[18]그러한 반응에서 생성되는 활성산소는 특히 생물학에서 변화하거나 그것 없이는 기능할 수 없는 분자에서 전자를 제거함으로써 종종 종료된다.그러한 사건은 분자에 손상을 입히고, 따라서 그것을 포함하는 세포에 손상을 입힌다(분자가 기능장애가 되는 경우가 많기 때문이다).
활성산소에 의한 연쇄반응은 원자구조의 교차연결을 초래할 수 있다.자유 급진적 유도에 의한 연쇄반응이 DNA 한 가닥에 있는 염기쌍 분자를 포함하는 경우, DNA는 교차연결이 될 수 있다.[19]
DNA 교차 연결은 노화의 다양한 영향, 특히 암으로 이어질 수 있다.[20]지방 분자와 단백질 분자 사이에 다른 교차 결합이 일어나 주름이 생길 수 있다.[21]활성산소는 LDL을 산화시킬 수 있으며, 이는 동맥 내 플라그 형성에 있어 핵심적인 사건으로 심장병과 뇌졸중을 일으킨다.[22]많은 만성질환의 기원을 깔끔하게 '설명'하기 위해 노화의 자유방사선 이론이 어떻게 이용되어 왔는지를 보여주는 사례들이다.[23]
노화 과정에 관여한다고 생각되는 활성산소에는 과산화질소와 질소산화물이 있다.[24]특히, 과산화질소의 증가는 노화에 영향을 미치는 반면, 질소산화물 형성의 감소, 즉 그 생물학적 이용가능성은 이와 같다.[24]
항산화제는 다른 것을 형성하지 않고 급진적인 것을 중화시키는 전자를 기증할 수 있는 능력 때문에 자유로운 급진적 반응으로 인한 피해를 줄이고 예방하는데 도움이 된다.예를 들어 아스코르브산은 전자를 자유 래디컬에 빼앗기고 그 불안정한 전자를 항산화 분자 주위로 돌림으로써 그 자체를 안정되게 유지할 수 있다.[25]
이것은 많은 양의 산화 방지제가 [26]활성산소의 수를 감소시킬 수 있는 능력과 함께 만성 질환을 유발하는 근본적인 피해와 심지어 노화의 원인이 되는 근본적인 피해까지 줄일 수 있다는 가설을 낳았다.
증거
수많은 연구들이 노화 과정에서 활성산소의 역할을 입증해 왔으며, 따라서 노화의 자유 급진 이론을 잠정적으로 뒷받침하고 있다.연구 결과 노화된 쥐에서 과산화지질소(SOR) 형성 및 지질 과산화지질이 크게 증가한 것으로 나타났다.[27]정 회장 등은 나이가 들수록 ROS 생산량이 증가한다고 제안하고 XDH를 XOD로 전환하는 것이 중요한 기여 요인이 될 수 있다고 지적했다.[28]이는 크산틴 산화효소에 의한 과산화수소 생성과 중수동맥 내 NO 신타아제가 어린 쥐보다 나이가 많은 쥐에서 더 높게 나타났다는 연구결과가 뒷받침했다.[29]
해밀턴 외 연구진은 고혈압과 인간의 노화에서 손상된 내피기능의 유사점을 조사했고 두 가지 모두에서 과산화수소의 유의미한 과잉생산을 발견했다.[30]이 발견은 건강한 남성의 노화와 함께 내피적 산화 스트레스가 발달하고 내피에 의존하는 확장의 감소와 관련이 있다는 2007년 연구에 의해 뒷받침되었다.[31]게다가 배양된 부드러운 근육세포를 이용한 연구는 나이든 쥐에서 추출한 세포에서 증가된 ROS를 보여주었다.[32]이러한 발견은 어린 쥐와 늙은 쥐의 고환에서 분리된 레이디그 세포를 이용한 두 번째 연구에 의해 뒷받침되었다.[33]
Choksi 등.아메스 왜소(DW) 생쥐를 대상으로 실험한 결과 DW 생쥐의 내생성 ROS 생산량이 낮은 것이 산화 스트레스와 장수명에 대한 저항성의 요인이 될 수 있다는 것을 알 수 있다.[34]레너 외 연구진은 녹스4 활동이 과산화수소 과잉생산을 통해 인간 탯줄 정맥 내피세포의 산화적 손상을 증가시킬 것을 제안한다.[35]게다가 로드리게스-마나스 등은 인간 혈관에서 내피 기능 장애를 발견한 것은 혈관 염증과 산화 스트레스의 집합적 효과 때문이다.[36]
사사키 외 연구진은 과산화수소 의존 화학 발광이 생쥐, 위스타 쥐, 비둘기의 최대 수명에 반비례했다고 보고했다.[37]그들은 ROS 신호 전달이 노화 과정의 결정 요인이 될 수 있다고 제안한다.[37]인간에서 멘도자 누네즈 등은 60세 이상의 나이가 산화 스트레스 증가와 연관될 수 있다고 제안한다.[38]미야자와 교수는 미토콘드리아 과산화 음이온 생산은 미토콘드리아 매개 세포사멸을 통해 장기 위축과 기능 장애를 초래할 수 있다는 것을 발견했다.[39]게다가, 그들은 미토콘드리아 과산화 음이온이 노화에 필수적인 역할을 한다고 제안한다.[40]룬드 외 연구진은 생쥐를 이용한 노화 과정 중 내피기능 장애로부터 내피기능 장애로부터 보호하는 내생성 세포외 과산화 디퓨타제의 역할을 입증했다.[41]
이론의 수정
자유 급진적 노화 이론에 대한 주요 비판 중 하나는 활성산소가 생체 분자의 손상에 책임이 있으므로 세포 노화와 유기체 노화의 주요 원인이 된다는 제안에 대한 것이다.[42]: 81 현재의 연구를 전체 이론에 통합하기 위해 몇 가지 수정안이 제안되었다.
노화 미토콘드리아 이론

노화에 대한 미토콘드리아 이론은 1978년에 처음 제안되었고,[43][44] 2년 후에는 노화에 대한 미토콘드리아 자유방사성 이론이 도입되었다.[45]이 이론은 미토콘드리아가 ROS를 생산할 수 있는 알려진 화학적 메커니즘이 있고, mtDNA와 같은 미토콘드리아 성분이 핵 DNA만큼 잘 보호되지 않으며, 핵 및 mtDNA에 대해 더 높은 수준의 급진적 피해를 증명하는 핵 및 mtDNA에 대한 손상 비교 연구에 의해 미토콘드리아를 급진적 손상의 주요 대상으로 하고 있다.미토콘드리아 [46]분자전자는 전자전달체인과 같은 미토콘드리아의 대사 과정에서 빠져나올 수 있으며, 이들 전자는 물과 차례로 반응하여 과산화물 과산화물 과격과 같은 ROS를 형성하거나, 히드록실 과격파와 같은 간접 경로를 통해 수산화물을 형성할 수 있다.그러면 이러한 급진주의자들은 미토콘드리아의 DNA와 단백질을 손상시키고, 이러한 손상 요소들은 차례로 ROS 부산물을 생산하기 더 쉽다.따라서 산화 스트레스의 양성 피드백 루프는 시간이 지남에 따라 세포와 후기 장기 및 전신의 악화로 이어질 수 있다는 것이 확립된다.[42]
이 이론은 널리 논의되어[47] 왔고 여전히 ROS가 mtDNA 돌연변이를 유발한 방법은 불분명하다.[42]콘테 외 연구진은 철분 대체 아연 손가락이 DNA에 근접하여 유리기를 생성하여 DNA 손상을 초래할 수 있다고 제안한다.[48]
Afanas'ev는 CuZn의 과산화지질소 분해 활성을 제안한다.SOD는 수명과 활성산소 사이의 중요한 연관성을 보여준다.[49]CuZn 간의 연결페레즈 외 연구진은 쥐의 수명이 CuZn을 암호화하는 Sod1 유전자의 삭제에 의해 영향을 받는다는 것을 시사했다.SOD.[50]
일반적으로 관찰된 미토콘드리아 ROS(mtochondrial ROS)와 장수의 감소 사이의 연관성과는 반대로, Yee 등은 최근 세포사멸 경로에서 mtROS 신호에 의해 매개되는 장수의 증가를 관찰했다.이는 ROS 손상과 노화 사이의 관찰된 상관관계가 노화 과정에 ROS의 인과관계를 반드시 나타내는 것은 아니지만 노화 과정에 대한 세포 반응의 일부인 변조 신호 전달 경로로 인해 더 가능성이 높다는 가능성을 뒷받침하는 역할을 한다.[51]
후생유전자 산화 리독스 시프트(EORS) 이론
Brewer는 노화의 자유로운 급진적 이론과 노화의 인슐린 신호 전달 효과를 통합하는 이론을 제안했다.[52]Brewer의 이론은 "연령과 관련된 연속적인 행동은 산화된 리독스 이동과 손상된 미토콘드리아 기능을 유발한다"[52]고 제안한다.이 미토콘드리아 손상은 더 많은 좌식적 행동과 노화를 가속화시킨다.[52]
노화의 대사안정론
노화의 대사 안정성 이론은 수명의 주요 결정 요인인 ROS의 안정적인 농도를 유지하는 것이 세포 능력임을 시사한다.[53]이 이론은 ROS가 정상적인 세포 기능을 유지하는 데 필요한 특정한 신호 전달 분자라는 것을 무시하기 때문에 자유 급진 이론을 비판한다.[53]
미토호르메시스
산화성 스트레스는 처음에 증가된 ROS의 레벨에 2차 반응을 유도함으로써 선충의 기대수명을 촉진할 수 있다.[54]포유류에서 반응성 산소종이 노화에 미치는 순효과의 문제는 더욱 명확하지 않다.[55][56][57]최근의 역학 조사 결과는 인간의 미토호메시스 과정을 지지하고 있으며, 심지어 외생 항산화제의 섭취가 인간의 질병 유행을 증가시킬 수 있다는 것(이론에 따르면, 항산화제를 중화시킬 뿐만 아니라 o를 제공하는 산화제 화합물에 대한 유기체의 자연적인 반응의 자극을 예방하기 때문에)까지 시사하고 있다.그들의 이익도 또한 그렇다.[58]
칼로리 제한의 영향
칼로리 제한이 산화스트레스의 증가를 동반함에도 불구하고 유기체의 수명에 긍정적인 영향을 미친다는 연구결과가 나왔다.[49]많은 연구들은 이것이 항산화 작용,[49] 산화 스트레스 억제 [59]또는 칼로리 제한에서 발생하는 산화 스트레스 저항 때문일[60] 수 있다고 제안한다.Fontana 등은 칼로리 제한이 인슐린 유사 성장 인자 I(IGF-1)의 감소를 통해 수많은 신호 경로에 영향을 미쳤다고 제안한다.[61]또한 그들은 항산화 SOD와 카탈라아제가 이 영양소 신호 전달 경로의 억제에 관련되어 있음을 시사한다.[61]
O2 섭취의 감소나 심지어 증가가 없을 때 발생할 수 있는 일부 칼로리 제한 연구 동안에 관측된 기대수명의 증가는 종종 미토콘드리아 자유노화론(mitochondrial free rcient 이론)에 반대한다고 추론된다.[49][62]G. Barja의 연구에 따르면, 식단 제한, 유산소 운동, 만성 운동, 갑상선 항진증 동안 (소비된2 O의 단위당) 미토콘드리아 산소 급진적 생산량이 현저하게 감소한다고 한다.[62]또한 미토콘드리아 산소 급진세력은 체구와 신진대사율이 비슷한 단명 포유류보다 장수 조류에서 더 낮다.따라서 미토콘드리아 ROS 생산은 다양한 종, 조직, 생리학적 상태에서 O 소비와는2 독립적으로 규제되어야 한다.[62]
이론에 대한 도전
벌거벗은 두더지-랫
벌거벗은 몰쥐는 장수(32년) 설치류다.루이스 외 연구진([63]2013년)이 검토한 바와 같이, 알몸의 몰 쥐에서 ROS 생산 수준은 다른 설치류인 상대적으로 수명이 짧은 생쥐(4년)와 비슷하다.그들은 이러한 설치류에서 건강-경간과 수명을 조절하는 것은 산화 스트레스가 아니라, 동물들이 높은 수준의 산화 손상과 스트레스를 처리할 수 있도록 하는 다른 세포 보호 메커니즘이라고 결론지었다.[63]벌거벗은 몰-랫드에서, 수명을 보장할 수 있는 중요한 세포 보호 메커니즘은 몇 가지 주요 DNA 수리 경로에 관여하는 DNA 수리 유전자의 표현 증가다.[64](노화의 DNA 손상 이론을 참조하라.)마우스와 비교했을 때, 벌거벗은 두더지 쥐는 DNA 불일치 수리, 비호몰로지 엔드 결합 및 베이스 절개 수리의 DNA 수리 경로에 필수적인 유전자 발현 수준이 상당히 높았다.[64]
새들
새 중에서 앵무새는 메추라기보다 5배 정도 더 오래 산다.심장, 골격근, 간, 온전한 적혈구에서의 ROS 생산은 앵무새와 메추라기 등에서 유사한 것으로 조사되었으며 장수 차이와는 아무런 관련이 없는 것으로 나타났다.[65]이러한 연구결과는 노화의 산화스트레스 이론의 강건성에 의문을 제기하는 것으로 결론지어졌다.[65]
참고 항목
참조
- ^ 헤키미 S, 라포인트 J, 원 Y. 노화 과정에서 활성산소를 "좋은" 눈으로 살펴본다.세포 생물학의 동향.2011;21(10) 569-76.
- ^ a b 에르바스 M, 세케르시 H. "자유산소의 수입 및 식품 가공 중 발생"세르베스트 라드칼레른 오네무 베 기다 sle슬렘 시라신다 올루수무 2011: 36 (6) 349–56.
- ^ Herrling T, Jung K, Fuchs J (2008). "The role of melanin as protector against free radicals in skin and its role as free radical indicator in hair". Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 69 (5): 1429–35. Bibcode:2008AcSpA..69.1429H. doi:10.1016/j.saa.2007.09.030. PMID 17988942.
- ^ a b Halliwell B (2012). "Free radicals and antioxidants: updating a personal view". Nutrition Reviews. 70 (5): 257–65. doi:10.1111/j.1753-4887.2012.00476.x. PMID 22537212.
- ^ Harman, D (1956). "Aging: a theory based on free radical and radiation chemistry". Journal of Gerontology. 11 (3): 298–300. doi:10.1093/geronj/11.3.298. PMID 13332224.
- ^ Harman, D (1972). "A biologic clock: the mitochondria?". Journal of the American Geriatrics Society. 20 (4): 145–147. doi:10.1111/j.1532-5415.1972.tb00787.x. PMID 5016631. S2CID 396830.
- ^ Fontana, Luigi; Partridge, Linda; Longo, Valter D. (16 April 2010). "Extending Healthy Life Span—From Yeast to Humans". Science. 328 (5976): 321–326. Bibcode:2010Sci...328..321F. doi:10.1126/science.1172539. PMC 3607354. PMID 20395504.
- ^ Pérez VI, Bokov A, Remmen HV, Mele J, Ran Q, Ikeno Y, et al. (2009). "Is the oxidative stress theory of aging dead?". Biochimica et Biophysica Acta (BBA) - General Subjects. 1790 (10): 1005–14. doi:10.1016/j.bbagen.2009.06.003. PMC 2789432. PMID 19524016.
- ^ Van Rammsdonk, Jeremy M.; Hekimi, Siegfried (2009). Kim, Stuart K. (ed.). "Deletion of the Mitochondrial Superoxide Dismutase sod-2 Extends Lifespan in Caenorhabditis elegans". PLOS Genetics. 5 (2): e1000361. doi:10.1371/journal.pgen.1000361. PMC 2628729. PMID 19197346.
- ^ a b c Harman D (Jul 1956). "Aging: a theory based on free radical and radiation chemistry". J Gerontol. 11 (3): 298–300. doi:10.1093/geronj/11.3.298. PMID 13332224.
- ^ a b c Harman D (2009). "Origin and evolution of the free radical theory of aging: a brief personal history, 1954–2009". Biogerontology. 10 (6): 773–81. doi:10.1007/s10522-009-9234-2. PMID 19466577. S2CID 13512659.
- ^ a b Speakman JR, Selman C (2011). "The free-radical damage theory: Accumulating evidence against a simple link of oxidative stress to ageing and lifespan". BioEssays. 33 (4): 255–9. doi:10.1002/bies.201000132. PMID 21290398. S2CID 13720843.
- ^ Clancy D, Birdsall J. Flys, 지렁이, 그리고 자유 급진적 노화 이론.노화 연구 검토(0).
- ^ Chatterjee S, Lardinois O, Bhattacharjee S, Tucker J, Corbett J, Deterding L, et al. (2011). "Oxidative stress induces protein and DNA radical formation in follicular dendritic cells of the germinal center and modulates its cell death patterns in late sepsis". Free Radical Biology and Medicine. 50 (8): 988–99. doi:10.1016/j.freeradbiomed.2010.12.037. PMC 3051032. PMID 21215311.
- ^ a b Jang YC, Remmen HV (2009). "The mitochondrial theory of aging: Insight from transgenic and knockout mouse models". Experimental Gerontology. 44 (4): 256–60. doi:10.1016/j.exger.2008.12.006. PMID 19171187. S2CID 19815246.
- ^ a b Gruber J, Schaffer S, Halliwell B (2008). "The mitochondrial free radical theory of ageing--where do we stand?". Frontiers in Bioscience. 13 (13): 6554–79. doi:10.2741/3174. PMID 18508680.
- ^ a b Orchin M, Macomber RS, Pinhas A, Wilson RM, 편집자.유기 화학의 어휘와 개념. 2 ed: John Wiley & Sons; 2005.
- ^ Cui Hang; Kong Yahui; Zhang Hong (2011). "Oxidative Stress, Mitochondrial Dysfunction, and Aging". Journal of Signal Transduction. 2012: 646354. doi:10.1155/2012/646354. PMC 3184498. PMID 21977319.
- ^ Crean C, Geacintov NE, Shafirovich V (2008). "Intrastrand G-U cross-links generated by the oxidation of guanine in 5′-d(GCU) and 5′-r(GCU)". Free Radical Biology and Medicine. 45 (8): 1125–34. doi:10.1016/j.freeradbiomed.2008.07.008. PMC 2577587. PMID 18692567.
- ^ 디즈다로글루 M, 자루가 P.DNA에 대한 자유로운 급진적 피해의 메커니즘.프리 래디컬 리서치.[기사]2012;46(4) 382-419.
- ^ 페이지온 H, 아스셀리나우 D.콜라겐 글리제화에 의한 피부의 연대기적 노화에 대한 체외 접근법:글리제이션이 복원된 피부 모델에 미치는 생물학적 영향 2005; 1043(1) 529-32.
- ^ 뱀 VV, 츠막호비치 VA, 샤클라이 N.헤모글로빈-헤미크롬에 의한 저밀도 지단백질의 산화.국제 생화학 및 세포 생물학 저널.2003;35(3) 349-58.
- ^ C. Richter, JW Park, BN Ames "미토콘드리아 및 핵 DNA에 대한 정상적인 산화적 손상은 광범위함" "PNAS", 1988년.
- ^ a b Afanas'ev IB (2005). "Free radical mechanisms of aging processes under physiological conditions". Biogerontology. 6 (4): 283–90. doi:10.1007/s10522-005-2626-z. PMID 16333762. S2CID 7661778.
- ^ Bagchi D. 외 "비타민 C와 E의 산소가 없는 과격한 청소 능력과 포도씨 프란토시아니딘 추출물" "분자 병리학과 약리학의 연구 커뮤니케이션" 1997.
- ^ 비살스키 H.노화에 대한 자유로운 급진적 이론.현재 임상 영양 및 대사 관리에 대한 의견. 2002년 1월;5(1) 5-10.
- ^ Sawada M, Carlson JC (1987). "Changes in superoxide radical and lipid peroxide formation in the brain, heart and liver during the lifetime of the rat". Mechanisms of Ageing and Development. 41 (1–2): 125–37. doi:10.1016/0047-6374(87)90057-1. PMID 2828774. S2CID 22356132.
- ^ Chung HY, Song SH, Kim HJ, Ikeno Y, Yu BP (1999). "Modulation of renal xanthine oxidoreductase in aging: gene expression and reactive oxygen species generation". The Journal of Nutrition, Health & Aging. 3 (1): 19–23. PMID 10888479.
- ^ Jacobson A, Yan C, Gao Q, Rincon-Skinner T, Rivera A, Edwards J, et al. (2007). "Aging enhances pressure-induced arterial superoxide formation". American Journal of Physiology. Heart and Circulatory Physiology. 293 (3): H1344–H50. doi:10.1152/ajpheart.00413.2007. PMC 4536921. PMID 17557915.
- ^ Hamilton CA, Brosnan MJ, McIntyre M, Graham D, Dominiczak AF (2001). "Superoxide excess in hypertension and aging: a common cause of endothelial dysfunction". Hypertension. 37 (2 Pt 2): 529–34. doi:10.1161/01.hyp.37.2.529. PMID 11230330.
- ^ Donato AJ, Eskurza I, Silver AE, Levy AS, Pierce GL, Gates PE, et al. (2007). "Direct evidence of endothelial oxidative stress with aging in humans: relation to impaired endothelium-dependent dilation and upregulation of nuclear factor-kappaB". Circulation Research. 100 (11): 1659–66. doi:10.1161/01.res.0000269183.13937.e8. PMID 17478731.
- ^ Moon SK, Thompson LJ, Madamanchi N, Ballinger S, Papaconstantinou J, Horaist C, et al. (2001). "Aging, oxidative responses, and proliferative capacity in cultured mouse aortic smooth muscle cells". American Journal of Physiology. Heart and Circulatory Physiology. 280 (6): H779–H88. doi:10.1152/ajpheart.2001.280.6.h2779. PMID 11356636.
- ^ Chen H, Cangello D, Benson S, Folmer J, Zhu H, Trush MA, et al. (2001). "Age-related increase in mitochondrial superoxide generation in the testosterone-producing cells of Brown Norway rat testes: relationship to reduced steroidogenic function?". Experimental Gerontology. 36 (8): 1361–73. doi:10.1016/s0531-5565(01)00118-8. PMID 11602210. S2CID 6034351.
- ^ Choksi KB, Roberts LJ, DeFord JH, Rabek JP, Papaconstantinou J (2007). "Lower levels of F2-isoprostanes in serum and livers of long-lived Ames dwarf mice". Biochemical and Biophysical Research Communications. 364 (4): 761–4. doi:10.1016/j.bbrc.2007.10.100. PMC 2238179. PMID 17964285.
- ^ Lener B, Kozieł R, Pircher H, Hütter E, Greussing R, Herndler-Brandstetter D, et al. (2009). "The NADPH oxidase Nox4 restricts the replicative lifespan of human endothelial cells". The Biochemical Journal. 423 (3): 363–74. doi:10.1042/bj20090666. PMC 2762686. PMID 19681754.
- ^ Rodríguez-Mañas L, El-Assar M, Vallejo S, López-Dóriga P, Solís J, Petidier R, et al. (2009). "Endothelial dysfunction in aged humans is related with oxidative stress and vascular inflammation". Aging Cell. 8 (3): 226–38. doi:10.1111/j.1474-9726.2009.00466.x. PMID 19245678. S2CID 24420773.
- ^ a b Sasaki T, Unno K, Tahara S, Shimada A, Chiba Y, Hoshino M, et al. (2008). "Age-related increase of superoxide generation in the brains of mammals and birds". Aging Cell. 7 (4): 459–69. doi:10.1111/j.1474-9726.2008.00394.x. PMID 18419797. S2CID 12093820.
- ^ 멘도사 누녜스 VM, 루이즈 라모스 M, 산체스 로드리게스 MA, 레타나우갈데 R, 무뇨스 산체스 JL.건강한 인간의 노화와 관련된 산화 스트레스.도호쿠 실험 의학 저널.2007;213(3) 261-8.
- ^ Miyazawa M, Ishii T, Yasuda K, Noda S, Onouchi H, Hartman PS, et al. (2009). "The role of mitochondrial superoxide anion (O2(-)) on physiological aging in C57BL/6J mice". Journal of Radiation Research. 50 (1): 73–83. Bibcode:2009JRadR..50...73M. doi:10.1269/jrr.08097. PMID 19218782.
- ^ 미야자와 M, 이시이 T, 야스다 K, 노다 S, 오노우치 H, 하트만 PS 등.
- ^ Lund DD, Chu Y, Miller JD, Heistad DD (2009). "Protective effect of extracellular superoxide dismutase on endothelial function during aging". American Journal of Physiology. Heart and Circulatory Physiology. 296 (6): H1920–H5. doi:10.1152/ajpheart.01342.2008. PMC 2716111. PMID 19376805.
- ^ a b c Afanas'ev I (2010). "Signaling and Damaging Functions of Free Radicals in Aging-Free Radical Theory, Hormesis, and TOR". Aging and Disease. 1 (2): 75–88. PMC 3295029. PMID 22396858.
- ^ 로바초프 A.N.Role of mitochondrial processes in the development and aging of organism. Aging and cancer (PDF), Chemical abstracts. 1979 v. 91 N 25 91:208561v.Deposited Doc., VINITI 2172-78, 1978, p. 48
- ^ 로바초프 A.N.Biogenesis of mitochondria during cell differentiation and aging (PDF), Deposited Doc. VINITI 19.09.85, №6756-В85, 1985, p. 28
- ^ Miquel J, Economos AC, Fleming J, 등.Mitochondrial role in cell aging, Exp Gerontol, 15, 1980, pp. 575–591
- ^ Weindruch, Richard (January 1996). "Calorie Restriction and Aging". Scientific American: 49–52.
- ^ Poovathingal SK, Gruber J, Halliwell B, Gunawan R (2009). "Stochastic drift in mitochondrial DNA point mutations: a novel perspective ex silico". PLOS Computational Biology. 5 (11): e1000572. Bibcode:2009PLSCB...5E0572P. doi:10.1371/journal.pcbi.1000572. PMC 2771766. PMID 19936024.
- ^ Conte D, Narindrasorasak S, Sarkar B (1996). "In vivo and in vitro iron-replaced zinc finger generates free radicals and causes DNA damage". The Journal of Biological Chemistry. 271 (9): 5125–30. doi:10.1074/jbc.271.9.5125. PMID 8617792.
- ^ a b c d Afanas'ev I. 노화방지급론, 호르메시스, TOR에서 활성산소의 신호 및 손상 기능노화와 질병.2010;1(2) 75-88.
- ^ Pérez VI, Bokov A, Van Remmen H, Mele J, Ran Q, Ikeno Y, et al. (2009). "Is the oxidative stress theory of aging dead?". Biochimica et Biophysica Acta (BBA) - General Subjects. 1790 (10): 1005–14. doi:10.1016/j.bbagen.2009.06.003. PMC 2789432. PMID 19524016.
- ^ Yee C, Yang W, Hekimi S (2014). "The Intrinsic Apoptosis Pathway Mediates the Pro-Longevity Response to Mitochondrial ROS in C. elegans". Cell. 157 (4): 897–909. doi:10.1016/j.cell.2014.02.055. PMC 4454526. PMID 24813612.
- ^ a b c Brewer GJ (2010). "Epigenetic oxidative redox shift (EORS) theory of aging unifies the free radical and insulin signaling theories". Experimental Gerontology. 45 (3): 173–9. doi:10.1016/j.exger.2009.11.007. PMC 2826600. PMID 19945522.
- ^ a b Brink TC, Demetrius L, Lehrach H, Adjaye J (2009). "Age-related transcriptional changes in gene expression in different organs of mice support the metabolic stability theory of aging". Biogerontology. 10 (5): 549–64. doi:10.1007/s10522-008-9197-8. PMC 2730443. PMID 19031007.
- ^ Schulz TJ, Zarse K, Voigt A, Urban N, Birringer M, Ristow M (2007). "Glucose restriction extends Caenorhabditis elegans life span by inducing mitochondrial respiration and increasing oxidative stress". Cell Metabolism. 6 (4): 280–93. doi:10.1016/j.cmet.2007.08.011. PMID 17908557.
- ^ Sohal R, Mockett R, Orr W (2002). "Mechanisms of aging: an appraisal of the oxidative stress hypothesis". Free Radic Biol Med. 33 (5): 575–86. doi:10.1016/S0891-5849(02)00886-9. PMID 12208343.
- ^ Sohal R (2002). "Role of oxidative stress and protein oxidation in the aging process". Free Radic Biol Med. 33 (1): 37–44. doi:10.1016/S0891-5849(02)00856-0. PMID 12086680.
- ^ Rattan S (2006). "Theories of biological aging: genes, proteins, and free radicals". Free Radic Res. 40 (12): 1230–8. doi:10.1080/10715760600911303. PMID 17090411. S2CID 11125090.
- ^ Bjelakovic G, Nikolova D, Gluud LL, Simonetti RG, Gluud C(2007년)."항산화 보충제의 예방하기 위해 임의적인 재판에서 사망율은 매년 체계적인 논평과 메타 분석".그 미국 의학 협회 저널.297(8):842–57. doi:10.1001/jama.297.8.842. PMID 17327526..또한 편지를 미국 의학 협회 저널 필립 테일러와 샌포드 Dawsey에 의해 최초 논문의 저자들의 답장을 2008-07-24은 승객을 머신에 Archived을 참조하십시오.
- ^ Castello L; Froio T; Cavallini G; Biasi F; Sapino A; Leonarduzzi G; et al. (2005). "Calorie restriction protects against age-related rat aorta sclerosis". FASEB Journal. 19 (13): 1863–5. doi:10.1096/fj.04-2864fje. PMID 16150801. S2CID 41825838.
- ^ 웅바리 Z, 파라도-페르난데스 C, 치사르 A, 드 카보 R.칼로리 제한과 수명 조절의 기초가 되는 메커니즘: 혈관 노화에 대한 영향" Circulation Research 2008;102(5) 519-28.
- ^ a b 폰타나 L, 파트리지 L, 롱고 VD.효모에서 사람으로 건강한 수명을 연장한다.과학 (뉴욕, 뉴욕). 2010;328 (5976) 321-6.
- ^ a b c 바라자 G.미토콘드리아 산소 소비량과 반응성 산소종 생산은 독립적으로 변조된다. 즉, 노화 연구에 대한 함의다.회춘 연구. 2007;10(2) 215-24.
- ^ a b Lewis KN, Andziak B, Yang T, Buffenstein R (2013). "The naked mole-rat response to oxidative stress: just deal with it". Antioxid. Redox Signal. 19 (12): 1388–99. doi:10.1089/ars.2012.4911. PMC 3791056. PMID 23025341.
- ^ a b MacRae SL, Croken MM, Calder RB, Aliper A, Milholland B, White RR, Zhavoronkov A, Gladyshev VN, Seluanov A, Gorbunova V, Zhang ZD, Vijg J (2015). "DNA repair in species with extreme lifespan differences". Aging. 7 (12): 1171–84. doi:10.18632/aging.100866. PMC 4712340. PMID 26729707.
- ^ a b Montgomery MK, Hulbert AJ, Buttemer WA (2012). "Does the oxidative stress theory of aging explain longevity differences in birds? I. Mitochondrial ROS production". Exp. Gerontol. 47 (3): 203–10. doi:10.1016/j.exger.2011.11.006. PMID 22123429. S2CID 984298.


