프로그램된 세포사망
Programmed cell death프로그래밍된 세포사망(PCD, 때로는[1] 세포자살이라고도 함)은 세포자살이나 [2][3]자가파지와 같은 세포 내부의 사건의 결과로 세포가 죽는 것이다.PCD는 생물학적 과정으로 수행되며, 이는 보통 유기체의 수명 주기 동안 이점을 제공합니다.예를 들어, 발달 중인 인간 배아에서 손가락과 발가락의 분화는 손가락 사이의 세포가 분리되기 때문에 일어난다; 그 결과 손가락이 분리된다.PCD는 식물과 동물의 조직이 발달하는 동안 기본적인 기능을 합니다.
아포토시스와 자가파지는 둘 다 프로그램된 세포사의 [4]한 형태이다.괴사는 외상이나 감염과 같은 외부 요인에 의해 일어나는 세포의 사멸로 여러 가지 다른 형태로 발생한다.괴사는 오랫동안 감염이나 [4]부상의 결과로 발생하는 비생리학적인 과정으로 여겨졌지만, 2000년대에는 프로그램화된 [5]괴사증이라고 불리는 프로그램화된 형태의 괴사가 프로그램된 세포사의 대안으로 인식되었다.괴사증은 바이러스나 돌연변이와 같은 내인성 또는 외인성 요인에 의해 아포토시스 신호가 차단될 때 세포사망 백업 역할을 할 수 있다는 가설이다.가장 최근에, 다른 유형의 조절 괴사들도 [6]발견되었는데, 이것은 괴사증 및 아포토시스와 몇 가지 신호 이벤트를 공유한다.
역사
"프로그램된 세포사망"의 개념은 "아포토시스"가 만들어지기 약 8년 전인 1964년에 Lockshin & Williams에[7] 의해 곤충 조직의 발달과 관련하여 사용되었습니다.그러나 PCD라는 용어는 혼동의 원인이 되어 Durand와[8] Ramsey는 기계적이고 진화적인 정의를 제공함으로써 개념을 개발했습니다.PCD는 유전적인 요소를 가진 모든 다른 종류의 세포사를 가리키는 일반적인 용어가 되었다.
이 메커니즘에 대한 첫 번째 통찰은 종종 모낭 림프종에서 발견되는 염색체 전위에 의해 활성화된 추정 종양 유전자의 산물인 BCL2를 연구한 것에서 비롯되었다.BCL2는 세포 증식을 촉진해 암을 촉진하는 다른 암 유전자와 달리 림프종 세포가 스스로 [9]목숨을 끊는 것을 막아 암을 촉진했다.
PCD는 점점 더 많은 관심과 연구의 대상이 되어 왔습니다.이러한 경향은 2002년 노벨 생리의학상을 시드니 브레너(영국), H. 로버트 호비츠(미국), 존 E.에게 수여하면서 두드러졌다. Sulston([10]영국).
종류들

아포토시스
아포토시스는 다세포 [12]유기체에서 발생할 수 있는 프로그램된 세포사(PCD)의 과정이다.생화학적 사건은 특징적인 세포 변화와 죽음을 초래한다.이러한 변화에는 블리징, 세포 수축, 핵 조각, 염색질 응축, 염색체 DNA 조각 등이 포함됩니다.이제 발달적 맥락에서 세포는 항상성 맥락에서 자살하도록 유도된다; 특정 생존 인자의 부재는 자살의 동기를 제공할 수 있다.이러한 자살 경로의 형태학 및 실제로 생화학에는 약간의 변화가 있는 것으로 보입니다; 어떤 것들은 "아포토시스"의 길을 걷고 있고, 다른 것들은 더 일반화된 결실 경로를 따르지만, 대개 유전적이고 합성적으로 동기를 부여받습니다.엔도핵산가수분해효소 활성화와 같은 "아포토시스"의 특정 증상이 유전적 캐스케이드 없이 충동적으로 유도될 수 있다는 증거가 있지만, 아마도 진정한 아포토시스 및 프로그램된 세포사멸은 유전적으로 매개되어야 한다.또한 유사분열과 아포토시스는 어떤 방식으로든 전환되거나 연결되며, 달성된 균형은 적절한 성장 또는 생존 [13]요인으로부터 수신된 신호에 따라 결정된다는 것이 명확해지고 있다.
오토파지
종종 오토파지로 언급되는 매크로 오토파지는 부피 세포질 함량, 비정상적인 단백질 집합체, 그리고 과다하거나 손상된 소기관들의 오토파고믹-리소좀 분해를 초래하는 이화 과정이다.
자가파지는 일반적으로 영양소 결핍 상태에 의해 활성화되지만 생리적 과정뿐만 아니라 발달, 분화, 신경변성 질환, 스트레스, 감염 및 암과 같은 병리학적 과정과도 관련이 있다.
메커니즘
자가파지 유도의 중요한 조절자는 키나제 mTOR이며, 활성화되면 자가파지를 억제하고 활성화되지 않으면 촉진한다.효모 Atg1과 유사한 역할을 하는 세린/트레오닌 키나아제 UNC-51-like kinase -1, -2, -3(ULK1, ULK2, UKL3)은 mTOR 복합체 하류에 작용한다.ULK1 및 ULK2는 자가파지 관련(Atg) 유전자 생성물(mAtg13) 및 발판단백질 FIP200의 포유동물 호몰로지와 함께 큰 복합체를 형성한다.자가파지의 유도를 위해서는 hVps34, Beclin-1, p150 및 Atg14 유사 단백질 또는 자외선 조사 내성 관련 유전자(UVRAG)를 포함하는 Class III PI3K 복합체가 필요하다.
ATG 유전자는 ATG12-ATG5 및 LC3-II(ATG8-II) 복합체를 통해 오토파고좀 형성을 조절한다.ATG12는 ATG7 및 ATG10을 필요로 하는 유비퀴틴 양반응으로 ATG5와 결합된다.그런 다음 Atg12-Atg5 결합체는 ATG16과 비공유적으로 상호작용하여 큰 복합체를 형성한다.LC3/ATG8은 ATG4 단백질분해효소에 의해 C 말단에서 분해되어 세포질 LC3-I를 생성하며, LC3-I는 Atg7 및 Atg3를 필요로 하는 유비퀴틴 양반응에서도 포스파티딜레탄올라민(PE)과 결합된다.LC3-II로 알려진 LC3의 지방화된 형태는 자동고체 막에 부착됩니다.
오토파지와 아포토시스는 양적으로도 음적으로도 연결되어 있으며, 이 둘 사이에는 광범위한 크로스톡이 존재한다.영양소 결핍 시 자가파지는 생존을 위한 메커니즘으로 기능하지만, 과도한 자가파지는 세포사멸로 이어질 수 있다. 세포사멸은 형태학적으로 아포토시스와는 다르다.TNF, TRAIL 및 FADD와 같은 몇 가지 예방적 신호도 자동 파지를 유도합니다.또한 Bcl-2는 Beclin-1의존성 오토파지를 억제하여 생존방지 및 항자극조절제로서 기능한다.
기타 타입
위의 두 가지 유형의 PCD 외에도 다른 경로가 발견되었습니다.[14]"비 아포토시스 프로그램 세포사망" (또는 "카스피아제 독립 프로그램 세포사망" 또는 "괴사병")이라고 불리는 이러한 대체 사망 경로는 아포토시스만큼 효율적이며 백업 메커니즘 또는 PCD의 주요 유형으로 기능할 수 있습니다.
다른 형태의 프로그램된 세포사멸은 유도되는 것 외에는 아포토시스와 거의 동일한 형태인 아노이키스, 눈에 독점적인 세포사멸의 형태인 옥수수화, 흥분독성, 철의존성[15] 세포사멸과 월레리아 변성을 포함한다.
괴사증은 프로그램화된 형태의 괴사, 즉 염증성 세포사이다.통상적으로 괴사는 세포 손상 또는 병원균에 의한 침투에 기인하는 프로그램되지 않은 세포사망과 관련되며, 아포토시스를 통한 질서정연한 프로그램된 세포사망과는 대조적이다.네모시스는 [16]섬유아세포에서 일어나는 또 다른 형태의 괴사이다.
아포네시스는 아포토시스와 괴사의 잡종으로 [18]괴사에 의해 완성되는 불완전한 아포토시스 과정을 말한다.
NETosis는 NET에 [19]의해 생성된 세포 사멸의 과정이다.
부갑상선증은 IGF-1의 활성화를 통해 MAPK에 의해 매개되는 또 다른 유형의 비아포토시스 세포사이다.세포 내 액포 형성과 미토콘드리아의 [20]부종이 특징입니다.
세포사멸의 염증형인 파이로프토시스는 특정 미생물에 [20]의한 감염에 반응하여 아포토시스에 관여하지 않는 효소인 카스파아제 1에 의해 특이하게 매개된다.
식물 세포는 자가마법 세포 사멸과 유사한 특정 PCD 과정을 거친다.그러나 PCD의 몇 가지 공통적인 특징은 식물과 메타조아 모두에서 매우 잘 보존되어 있다.
위축인자
위축인자는 세포를 죽게 만드는 힘이다.세포에 가해지는 자연력만이 위축 인자로 간주되는 반면, 예를 들어, 세포의 기계적 또는 화학적 남용이나 용해의 작용제는 위축 [by whom?]인자가 아닌 것으로 간주된다.일반적인 위축 요인은 다음과 같습니다.[21]
- 워크로드 감소
- 신경계의 상실
- 혈액 공급 감소
- 영양 부족
- 내분비 자극 상실
- 노망
- 압축
신경계 발달에 대한 역할
발달하는 신경계의 초기 팽창은 뉴런의 제거와 그 [22]과정으로 상쇄된다.신경계가 발달하는 동안 발달하는 뉴런의 거의 50%는 프로그램된 세포사망(PCD)[23]에 의해 자연적으로 제거된다.신경계의 PCD는 1896년 존 [24]비어드에 의해 처음 인식되었다.그 이후로 신경 [25]발달 동안 그것의 생물학적 중요성을 이해하기 위해 몇 가지 이론이 제안되었다.
신경 발달에서의 역할
발달 중인 신경계의 PCD는 유사 분열 후 [22]세포뿐만 아니라 증식에서도 관찰되었다.한 이론은 PCD가 전구 세포의 수를 조절하는 적응 메커니즘이라는 것을 암시한다.인간의 경우, 전구 세포의 PCD는 임신 7주차부터 시작하여 임신 [26]3개월 초반까지 남아 있습니다.세포사멸의 이 과정은 대뇌피질, 소뇌, 시상, 뇌간,[25] 척수의 생식부위에서 확인되었습니다.임신 19-23주에 PCD는 유사 후 [27]세포에서 관찰된다.이 관찰을 설명하는 지배적인 이론은 신경영양학 이론으로, PCD는 뉴런과 그들의 구심성 입력 및 효율적인 [25]표적 사이의 연결을 최적화하기 위해 필요하다.또 다른 이론은 신경계의 발달성 PCD가 외부로 이동하거나 잘못된 표적을 자극하거나 경로를 [28]찾는 동안 빗나간 축삭을 가진 뉴런의 오류를 교정하기 위해 발생한다고 제안합니다.신경계가 발달하는 동안 PCD는 발달 단계, 세포 유형, 그리고 심지어 [25]종에 의해 결정되는 다양한 기능을 할 수 있다.
신경영양 이론
신경영양 이론은 발달하는 [29]신경계에서 프로그램된 세포사의 역할을 설명하기 위해 사용되는 주요 가설이다.그것은 목표물의 최적의 신경화를 보장하기 위해, 제한된 양의 보호 신경영양 인자를 놓고 경쟁하는 여분의 뉴런이 먼저 생성되고, 프로그램된 [26]세포사망으로 인해 일부만 살아남는다고 가정한다.게다가, 이 이론은 미리 결정된 요인들이 생존하는 뉴런의 양과 신경변화를 일으키는 신경세포 집단의 크기를 조절하는 것이 그들의 목표 [30]영역의 영향과 직접적으로 관련이 있다.
표적 세포가 매력적이거나 유도적인 요소를 분비하고 그들의 성장 원뿔이 화학적인 민감성을 가지고 있다는 근본적인 생각은 1892년 [31]산티아고 라몬 이 카할에 의해 처음 제시되었습니다.카잘은 이 아이디어를 "지능적" 축삭이 목표물을 찾을 때 취하는 것으로 보이는 것에 대한 설명으로 제시했지만, 경험적 [31]자료가 없다는 것을 인정했다.이 이론은 축삭 표적을 실험적으로 조작한 결과 모든 신경세포가 사망했을 때 더 많은 매력을 얻었다.이것은 신경영양 [32][33]이론의 주요 교리가 되는 표적 유도 조절의 개념을 발전시켰다.이 이론을 더욱 뒷받침하는 실험은 첫 번째 신경영양인자, 신경성장인자(NGF)[34]의 확인으로 이어졌다.
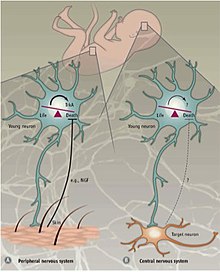
말초신경계 대 중추신경계
다른 메커니즘이 말초신경계(PNS)와 중추신경계(CNS)의 PCD를 조절합니다.PNS에서 타깃의 신경화는 타깃 방출 신경영양인자 NGF 및 NT3의 [35][36]양에 비례한다.신경트로핀 수용체 TrkA와 TrkC의 발현은 리간드가 [23]없는 경우 아포토시스를 유도하기에 충분하다.따라서 PNS의 PCD는 신경영양인자의 방출에 의존하며, 따라서 신경영양론의 개념을 따르는 것으로 추측된다.
CNS의 프로그래밍된 세포사멸은 외부 성장 인자에 의존하지 않고 대신 본질적으로 파생된 신호에 의존합니다.신피질에서는 [36]환경으로부터 독립된 것으로 보이는 아포토시스 기구에 의해 흥분성 대 억제성 인터요론의 비율이 4:1로 유지됩니다.뒷받침되는 증거는 쥐의 신피질에 세포간 [37]전구체를 이식하거나 체외 배양한 실험에서 나왔다.이식된 세포는 내인성 인터요론이 아포토시스(apoptosis)를 겪는 나이와 같은 나이인 2주일에 죽었다.이식 규모에 관계없이 아포토시스가 진행되는 세포의 비율은 일정하게 유지되었다.또한 뇌유래 신경영양인자(Bdnf) 수용체인 TrkB의 교란은 세포사멸에 영향을 미치지 않았다.또한 프로아포토시스 인자 백스(Bcl-2 관련 X 단백질)가 null인 생쥐에서 야생형 [37]생쥐에 비해 더 많은 비율의 인터뉴론이 생존한 것으로 나타났다.이러한 연구결과는 CNS의 프로그래밍된 세포사멸이 부분적으로 Bax-mediated 시그널링을 이용하며 BDNF 및 환경과는 무관함을 나타냅니다.CNS에서의 아포토시스 메커니즘은 아직 잘 알려져 있지 않지만, 인터유론의 아포토시스는 자기자율적인 과정이라고 생각된다.
부재의 신경계 발달
프로그램된 세포사멸은 프로아포토시스 유전자의 표적 결실 또는 항아포토시스 유전자의 과발현에 의해 발달하는 신경계에서 감소 또는 제거될 수 있다.PCD의 부재 또는 감소는 심각한 해부학적 기형을 일으킬 수 있지만 대상 유전자, 신경 집단 및 [25]발달 단계에 따라 최소한의 결과를 초래할 수도 있습니다.뇌의 [38][39]총 이상을 일으키는 과도한 전구 세포 증식은 종종 치명적이다. 이는 전뇌에서 외두증이 발병하는 카스파아제-3 또는 카스파아제-9 녹아웃 생쥐에서 볼 수 있다.그러나 이들 생쥐의 뇌간, 척수, 말초신경절은 정상적으로 발달하며, 발달 중 PCD에서의 캐스파아제 관여는 뇌 영역과 세포 [40]유형에 따라 다르다는 것을 시사한다.아포토시스 단백질분해효소 활성화인자 1(APAF1)의 녹아웃 또는 억제도 기형을 초래하고 배아 치사율을 [41][42][43]증가시킨다.아포토시스 조절 단백질 Bcl-2와 Bax(Bcl-2의 과잉 발현 또는 Bax의 결실)의 조작은 망막, 삼차핵, 소뇌, [44][45][46][47][48][49][50]척수와 같은 신경계의 특정 영역에서 뉴런의 수를 증가시킨다.그러나 Bax 결실이나 Bcl-2 과발현으로 인한 뉴런의 PCD는 생쥐에서 현저한 형태학적 또는 행동적 이상을 일으키지 않는다.예를 들어, Bcl-2를 과도하게 발현하는 쥐는 일반적으로 정상적인 운동 기술과 시력을 가지고 있으며 학습과 [51][52][53]불안과 같은 복잡한 행동에서만 장애를 보인다.이러한 생쥐의 정상적인 행동 표현형은 과잉 [25]뉴런을 보상하기 위해 적응 메커니즘이 포함될 수 있다는 것을 암시합니다.
무척추동물 및 척추동물
다양한 종에서 PCD에 대해 배우는 것은 신경계의 발달에서 아포토시스의 진화적 기반과 이유를 이해하는 데 필수적이다.무척추동물의 신경계가 발달하는 동안, PCD는 다른 [54]종에서 다른 역할을 한다.선충과 거머리의 비대칭 세포사 메커니즘의 유사성은 PCD가 신경계 [55]발달에 진화적 의미를 가질 수 있음을 나타낸다.선충에서 PCD는 발생 첫 시간에 발생하며, 신경 [56]계통을 포함한 비선충 세포의 12%를 제거한다.절지동물의 세포사멸은 외배엽세포가 분화해 한쪽 딸세포가 신경아세포가 되고 다른 한쪽이 아포토시스(apoptosis)[57]를 겪을 때 신경계에서 먼저 발생한다.게다가 성표적 세포사망으로 인해 남성과 [58]여성의 특정 장기가 서로 다른 신경질적으로 신경질화된다.Drosophila에서 PCD는 개발 중 분할 및 사양에 필수적입니다.
무척추동물과 달리 프로그램된 세포사 메커니즘은 척추동물에서 더 보존되는 것으로 밝혀졌다.다양한 척추동물에 대해 수행된 광범위한 연구는 발달하는 동안 신경계의 대부분 부분에서 신경세포와 글리아의 PCD가 발생한다는 것을 보여준다.그것은 말초 신경계뿐만 아니라 중추 신경계의 [25]시냅토제네시스 전과 도중에 관찰되었다.그러나 척추동물 종들 사이에는 몇 가지 차이점이 있다.예를 들어, 포유류는 광범위한 수목화를 보이는 반면, 새들은 그렇지 [59]않은 반면 망막에서 PCD가 뒤따른다.척추동물계의 시냅스 미세화는 주로 PCD에 의존하지만, 다른 진화 메커니즘도 [25]한 역할을 한다.
식물 조직 내
식물에서 프로그램된 세포사멸은 동물의 세포자살과 많은 분자적 유사성을 가지고 있지만, 그것은 또한 차이점을 가지고 있다. 가장 분명한 것은 세포벽의 존재와 죽은 세포의 조각들을 제거하는 면역체계의 부재이다.면역반응 대신 죽어가는 세포는 물질을 합성해 스스로 분해한 뒤 세포가 [60]죽으면서 파열되는 액포에 넣어둔다.
"APL은 Arabidopsis의 혈관 조직 정체성을 조절한다"[61]에서 마틴 본케와 그의 동료들은 혈관 식물의 두 가지 장거리 수송 시스템 중 하나인 목질(목질)이 여러 세포 유형으로 구성되어 있으며, "분화는 정교한 세포벽 증식과 프로그램된 세포 사멸을 포함한다"고 말했다.저자들은 플랜트 PCD의 제품이 중요한 구조적 역할을 한다고 강조한다.
PCD의 기본적인 형태학적, 생화학적 특성은 식물과 동물 [62]왕국 모두에서 보존되어 왔다.특정 유형의 식물 세포는 독특한 세포사멸 프로그램을 수행한다.이것들은 동물의 아포토시스(예를 들어 핵 DNA 분해)와 공통적인 특징을 가지고 있지만,[63] 그들은 또한 목질의 기관 요소에서 액포의 붕괴로 촉발된 핵 분해와 같은 그들만의 특징을 가지고 있다.
옥스퍼드 대학 식물과학부의 Janneke Balk와 Christopher J. Leaver는 해바라기 세포의 미토콘드리아 게놈 돌연변이에 대한 연구를 수행했다.이 연구 결과는 미토콘드리아가 다른 [64]진핵세포와 마찬가지로 혈관식물 PCD에서도 중요한 역할을 한다는 것을 시사한다.
꽃가루의 PCD는 근친 교배를 막는다
수분 중에 식물은 자가 불임(SI)을 방지하기 위한 중요한 수단으로 강제합니다.옥수수 양귀비에 대한 연구는 꽃가루가 착지하는 암술의 단백질이 꽃가루와 상호작용하고 양립할 수 없는 꽃가루에서 PCD를 유발한다는 것을 밝혀냈습니다.연구자들, 스티븐 G.토마스와 버노니카 E. Franklin-Tong은 또한 그 반응이 꽃가루 튜브의 성장을 빠르게 억제하고, 그 다음에 PCD가 [65]뒤따른다는 것을 발견했다.
슬라임 곰팡이 속
사회적 슬라임 곰팡이인 딕티오스텔리움 디스코이디움은 단세포 형태의 포식성 아메바 같은 행동을 취하거나 다음 [66]세대를 낳을 포자를 분산시킬 때 이동성 민달팽이 같은 형태로 결합하는 특징이 있다.
이 줄기는 세포 내부에 형성되는 거대한 액포, 염색질 응축 정도, 그러나 DNA [67]조각은 없는 등, 자기 마법 세포 사멸의 많은 특징을 공유하는 일종의 PCD를 거친 죽은 세포들로 구성되어 있습니다.죽은 세포가 남긴 잔류물의 구조적 역할은 식물 조직에서 PCD의 생성물을 연상시킨다.
D. discoideum은 슬라임 곰팡이로, 현재로부터 약 10억년 전에 진핵생물 조상으로부터 생겨났을 수도 있는 가지의 일부입니다.녹색 식물의 조상과 곰팡이와 동물의 조상이 분화된 후에 생겨난 것으로 보인다.그러나 진화적인 나무에서 PCD가 차지하는 위치 외에도, 작고 단순한 6염색체 D. 디스코이디움에서 PCD가 관찰된다는 사실은 추가적인 의미를 가집니다.그것은 아포토시스의 [68]특징인 카스파아제(caspase)에 의존하지 않는 발달적 PCD 경로의 연구를 가능하게 한다.
미토콘드리아 아포토시스의 진화적 기원
프로그램화된 세포 사멸의 발생은 시위자들에게서 [69][70]가능하지만, 여전히 논란이 되고 있다.어떤 사람들은 그 유기체들의 죽음을 조절되지 않은 아포토시스 같은 [71][72]세포사망으로 분류한다.
생물학자들은 오랫동안 미토콘드리아가 더 큰 진핵세포의 내분비온트(내부에 함께 사는 것)로 통합된 박테리아에서 유래했다고 의심해왔다.1967년부터 이 이론을 옹호한 사람은 린 마굴리스였고, 그 이후 [73]널리 받아들여지고 있다.이 이론의 가장 설득력 있는 증거는 미토콘드리아가 그들만의 DNA를 가지고 있고 유전자와 복제 장치를 갖추고 있다는 사실이다.
이 진화 과정은 에너지를 생산하는 박테리아를 집어삼키기 시작한 원시 진핵세포에게 위험했을 뿐만 아니라 그들의 원시핵 숙주에 침입하기 시작한 미토콘드리아의 조상들에게도 위험한 단계였을 것이다.이 과정은 오늘날에도 여전히 인간의 백혈구와 박테리아 사이에서 뚜렷하다.대부분의 경우, 침입한 박테리아는 백혈구에 의해 파괴된다; 하지만, 원핵생물이 벌이는 화학전이 성공하는 것은 드문 일이 아니며, 그 결과로 인한 손상으로 인한 감염으로 알려져 있다.
현재로부터 약 20억 년 전에, 이러한 희귀한 진화적 사건들 중 하나는 특정 진핵 생물과 에너지를 생산하는 원핵 생물들이 공존하고 그들의 [74]공생으로부터 상호 이익을 얻는 것을 가능하게 했다.
미토콘드리아 진핵세포는 생사의 갈림길에 서 있다.왜냐하면 미토콘드리아는 세포 [75]자살을 촉발할 수 있는 분자의 레퍼토리를 아직 유지하고 있기 때문이다.왜 아포토시스 기구가 현존하는 단세포 유기체에서 유지되는지는 명확하지 않다.이 프로세스는 [76]이제 프로그래밍된 경우에만 발생하도록 진화되었습니다.미토콘드리아는 세포(예: 이웃으로부터의 피드백, 스트레스 또는 DNA 손상)에 세포사를 유도하는 생화학적 캐스케이드(caspase activator)를 방출한다.따라서 세포 자살 메커니즘은 이제 우리 모두의 삶에 매우 중요하다.
유기체 전체의 프로그램된 죽음
임상적 의의
ABL
BCR-ABL 종양 유전자는 인간의 [77]암 발생에 관여하는 것으로 밝혀졌다.
c-마이크
c-Myc는 Bcl-2 유전자를 다운 조절하는 역할을 통해 아포토시스 조절에 관여한다.그것은 [77]조직의 무질서한 성장을 하는 역할을 한다.
전이
전이세포의 분자특징은 몇 가지 아포토시스 [77]유전자의 변화된 발현이다.
「 」를 참조해 주세요.
주 및 참고 자료
- Srivastava, 분자 메커니즘 연구(Humana Press, 2007).
- Kierszenbaum, A. L. & Tres, L. L.(Ed Madelene Hyde) (ELSEVIER Saunders, Philadelphia, 2012).
- ^ Raff, M (12 November 1998). "Cell suicide for beginners". Nature. 396 (6707): 119–22. Bibcode:1998Natur.396..119R. doi:10.1038/24055. ISSN 0028-0836. PMID 9823889. S2CID 4341684.
- ^ Engelberg-Kulka H, Amitai S, Kolodkin-Gal I, Hazan R (2006). "Bacterial Programmed Cell Death and Multicellular Behavior in Bacteria". PLOS Genetics. 2 (10): e135. doi:10.1371/journal.pgen.0020135. PMC 1626106. PMID 17069462.
- ^ Green, Douglas (2011). Means To An End. New York: Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-887-4.
- ^ a b Kierszenbaum, Abraham (2012). Histology and Cell Biology - An Introduction to Pathology. Philadelphia: ELSEVIER SAUNDERS.
- ^ Degterev, Alexei; Huang, Zhihong; Boyce, Michael; Li, Yaqiao; Jagtap, Prakash; Mizushima, Noboru; Cuny, Gregory D.; Mitchison, Timothy J.; Moskowitz, Michael A. (2005-07-01). "Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury". Nature Chemical Biology. 1 (2): 112–119. doi:10.1038/nchembio711. ISSN 1552-4450. PMID 16408008. S2CID 866321.
- ^ Vanden Berghe T, Linkermann A, Jouan-Lanhouet S, Walczak H, Vandenabeele P (2014). "Regulated necrosis: the expanding network of non-apoptotic cell death pathways". Nat Rev Mol Cell Biol. 15 (2): 135–147. doi:10.1038/nrm3737. PMID 24452471. S2CID 13919892.
- ^ Lockshin RA, Williams CM (1964). "Programmed cell death—II. Endocrine potentiation of the breakdown of the intersegmental muscles of silkmoths". Journal of Insect Physiology. 10 (4): 643–649. doi:10.1016/0022-1910(64)90034-4.
- ^ Durand and Ramsey, Pierre M. and Grant (2019). "The nature of programmed cell death" (PDF). Biological Theory. 14: 30–41. doi:10.1007/s13752-018-0311-0. S2CID 91622808.
- ^ Vaux DL, Cory S, Adams JM (September 1988). "Bcl-2 gene promotes haemopoietic cell survival and cooperates with c-myc to immortalize pre-B cells". Nature. 335 (6189): 440–2. Bibcode:1988Natur.335..440V. doi:10.1038/335440a0. PMID 3262202. S2CID 23593952.
- ^ "The Nobel Prize in Physiology or Medicine 2002". The Nobel Foundation. 2002. Retrieved 2009-06-21.
- ^ 슈워츠 루크 스미스 SW, 존스 ME, 오스본 영국(1993년)."모든 프로그램 세포 죽음 세포를 통해 발생하나요?".PNAS.90(3):980–4.Bibcode:1993PNAS...90..980S. doi:10.1073/pnas.90.3.980.PMC 45794.PMID 8430112.고, 더 최근의 견해를, Bursch다 W, Ellinger A, Gerner C, Fröhwein U, Schulte-Hermann R(2000년)를 참조하십시오."Programmed 세포 죽음(PCD).세포 사멸은, 자가 소화 작용의. PCD거나 혹은 다른 사람들?"라고.뉴욕 과학 학교의 연보926년(1):1–12.Bibcode:2000NYASA.926....1B.doi:10.1111/j.1749-6632.2000.tb05594.x. PMID 11193023.S2CID 27315958.
- ^ Green, Douglas (2011). Means To An End. New York: Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-888-1.
- ^ D. Bowen, Ivor (1993). "Cell Biology International 17". Cell Biology International. 17 (4): 365–380. doi:10.1006/cbir.1993.1075. PMID 8318948. S2CID 31016389. Archived from the original on 2014-03-12. Retrieved 2012-10-03.
- ^ Kroemer G, Martin SJ (2005). "Caspase-independent cell death". Nature Medicine. 11 (7): 725–30. doi:10.1038/nm1263. PMID 16015365. S2CID 8264709.
- ^ Dixon Scott J.; Lemberg Kathryn M.; Lamprecht Michael R.; Skouta Rachid; Zaitsev Eleina M.; Gleason Caroline E.; Patel Darpan N.; Bauer Andras J.; Cantley Alexandra M.; et al. (2012). "Ferroptosis: An Iron-Dependent Form of Nonapoptotic Cell Death". Cell. 149 (5): 1060–1072. doi:10.1016/j.cell.2012.03.042. PMC 3367386. PMID 22632970.
- ^ Jozef Bizik; Esko Kankuri; Ari Ristimäki; Alain Taieb; Heikki Vapaatalo; Werner Lubitz; Antti Vaheri (2004). "Cell-cell contacts trigger programmed necrosis and induce cyclooxygenase-2 expression". Cell Death and Differentiation. 11 (2): 183–195. doi:10.1038/sj.cdd.4401317. PMID 14555963.
- ^ Lang, F; Lang, KS; Lang, PA; Huber, SM; Wieder, T (2006). "Mechanisms and significance of eryptosis". Antioxidants & Redox Signaling. 8 (7–8): 1183–92. doi:10.1089/ars.2006.8.1183. PMID 16910766.
- ^ Formigli, L; et al. (2000). "aponecrosis: morphological and biochemical exploration of a syncretic process of cell death sharing apoptosis and necrosis". Journal of Cellular Physiology. 182 (1): 41–49. doi:10.1002/(sici)1097-4652(200001)182:1<41::aid-jcp5>3.0.co;2-7. PMID 10567915. S2CID 20064300.
- ^ Fadini, GP; Menegazzo, L; Scattolini, V; Gintoli, M; Albiero, M; Avogaro, A (25 November 2015). "A perspective on NETosis in diabetes and cardiometabolic disorders". Nutrition, Metabolism, and Cardiovascular Diseases. 26 (1): 1–8. doi:10.1016/j.numecd.2015.11.008. PMID 26719220.
- ^ a b Ross, Michael (2016). Histology: A Text and Atlas (7th ed.). p. 94. ISBN 978-1451187427.
- ^ 10장: 한 스테이지에 있는 모든 플레이어는 PsychEducation.org에서 2013-05-28년 웨이백 머신에 아카이브되었습니다.
- ^ a b Tau, GZ (2009). "Normal development of brain circuits". Neuropsychopharmacology. 35 (1): 147–168. doi:10.1038/npp.2009.115. PMC 3055433. PMID 19794405.
- ^ a b Dekkers, MP (2013). "Death of developing neurons: new insights and implications for connectivity". Journal of Cell Biology. 203 (3): 385–393. doi:10.1083/jcb.201306136. PMC 3824005. PMID 24217616.
- ^ Oppenheim, RW (1981). Neuronal cell death and some related regressive phenomena during neurogenesis: a selective historical review and progress report. In Studies in Developmental Neurobiology: Essays in Honor of Viktor Hamburger: Oxford University Press. pp. 74–133.
- ^ a b c d e f g h Buss, RR (2006). "Adaptive roles of programmed cell death during nervous system development". Annual Review of Neuroscience. 29: 1–35. doi:10.1146/annurev.neuro.29.051605.112800. PMID 16776578.
- ^ a b De la Rosa, EJ; De Pablo, F (October 23, 2000). "Cell death in early neural development: beyond the neurotrophic theory". Trends in Neurosciences. 23 (10): 454–458. doi:10.1016/s0166-2236(00)01628-3. PMID 11006461. S2CID 10493404.
- ^ Lossi, L; Merighi, A (April 2003). "In vivo cellular and molecular mechanisms of neuronal apoptosis in the mammalian CNS". Progress in Neurobiology. 69 (5): 287–312. doi:10.1016/s0301-0082(03)00051-0. PMID 12787572. S2CID 27052883.
- ^ Finlay, BL (1989). "Control of cell number in the developing mammalian visual system". Progress in Neurobiology. 32 (3): 207–234. doi:10.1016/0301-0082(89)90017-8. PMID 2652194. S2CID 2788103.
- ^ Yamaguchi, Yoshifumi; Miura, Masayuki (2015-02-23). "Programmed Cell Death in Neurodevelopment". Developmental Cell. 32 (4): 478–490. doi:10.1016/j.devcel.2015.01.019. ISSN 1534-5807. PMID 25710534.
- ^ Rubenstein, John; Pasko Rakic (2013). "Regulation of Neuronal Survival by Neurotrophins in the Developing Peripheral Nervous System". Patterning and Cell Type Specification in the Developing CNS and PNS: Comprehensive Developmental Neuroscience. Academic Press. ISBN 978-0-12-397348-1.
- ^ a b Constantino, Sotelo (2002). The chemotactic hypothesis of Cajal: a century behind. Progress in Brain Research. Vol. 136. pp. 11–20. doi:10.1016/s0079-6123(02)36004-7. ISBN 9780444508157. PMID 12143376.
- ^ Oppenheim, Ronald (1989). "The neurotrophic theory and naturally occurring motorneuron death". Trends in Neurosciences. 12 (7): 252–255. doi:10.1016/0166-2236(89)90021-0. PMID 2475935. S2CID 3957751.
- ^ Dekkers, MP; Nikoletopoulou, V; Barde, YA (November 11, 2013). "Cell biology in neuroscience: Death of developing neurons: new insights and implications for connectivity". J Cell Biol. 203 (3): 385–393. doi:10.1083/jcb.201306136. PMC 3824005. PMID 24217616.
- ^ Cowan, WN (2001). "Viktor Hamburger and Rita Levi-Montalcini: the path to the discovery of nerve growth factor". Annual Review of Neuroscience. 24: 551–600. doi:10.1146/annurev.neuro.24.1.551. PMID 11283321. S2CID 6747529.
- ^ Weltman, JK (February 8, 1987). "The 1986 Nobel Prize for Physiology or Medicine awarded for discovery of growth factors: Rita Levi-Montalcini, M.D., and Stanley Cohen, Ph.D.". New England Regional Allergy Proceedings. 8 (1): 47–8. doi:10.2500/108854187779045385. PMID 3302667.
- ^ a b Dekkers, M (April 5, 2013). "Programmed Cell Death in Neuronal Development". Science. 340 (6128): 39–41. Bibcode:2013Sci...340...39D. doi:10.1126/science.1236152. PMID 23559240. S2CID 206548254.
- ^ a b Southwell, D.G. (November 2012). "Intrinsically determined cell death of developing cortical interneurons". Nature. 491 (7422): 109–115. Bibcode:2012Natur.491..109S. doi:10.1038/nature11523. PMC 3726009. PMID 23041929.
- ^ Kuida, K (1998). "Reduced apoptosis and cytochrome c-mediated caspase activation in mice lacking caspase 9". Cell. 94 (3): 325–337. doi:10.1016/s0092-8674(00)81476-2. PMID 9708735. S2CID 8417446.
- ^ Kuida, K (1996). "Decreased apoptosis in the brain and premature lethality in CPP32-deficient mice". Nature. 384 (6607): 368–372. Bibcode:1996Natur.384..368K. doi:10.1038/384368a0. PMID 8934524. S2CID 4353931.
- ^ Oppenheim, RW (2001). "Programmed cell death of developing mammalian neurons after genetic deletion of caspases". Journal of Neuroscience. 21 (13): 4752–4760. doi:10.1523/JNEUROSCI.21-13-04752.2001. PMC 6762357. PMID 11425902.
- ^ Cecconi, F (1998). "Apaf1 (CED-4 homolog) regulates programmed cell death in mammalian development". Cell. 94 (6): 727–737. doi:10.1016/s0092-8674(00)81732-8. PMID 9753320.
- ^ Hao, Z (2005). "Specific ablation of the apoptotic functions of cytochrome c reveals a differential requirement for cytochrome c and Apaf-1 in apoptosis". Cell. 121 (4): 579–591. doi:10.1016/j.cell.2005.03.016. PMID 15907471. S2CID 4921039.
- ^ Yoshida, H (1998). "Apaf1 is required for mitochondrial pathways of apoptosis and brain development". Cell. 94 (6): 739–750. doi:10.1016/s0092-8674(00)81733-x. PMID 9753321. S2CID 1096066.
- ^ Bonfanti, L (1996). "Protection of retinal ganglion cells from natural and axotomy-induced cell death in neonatal transgenic mice overexpressing bcl-2". Journal of Neuroscience. 16 (13): 4186–4194. doi:10.1523/JNEUROSCI.16-13-04186.1996. PMC 6578989. PMID 8753880.
- ^ Martinou, JC (1994). "Overexpression of BCL-2 in transgenic mice protects neurons from naturally occurring cell death and experimental ischemia". Neuron. 13 (4): 1017–1030. doi:10.1016/0896-6273(94)90266-6. PMID 7946326. S2CID 25546670.
- ^ Zanjani, HS (1996). "Increased cerebellar Purkinje cell numbers in mice overexpressing a human bcl-2 transgene". Journal of Computational Neurology. 374 (3): 332–341. doi:10.1002/(sici)1096-9861(19961021)374:3<332::aid-cne2>3.0.co;2-2. PMID 8906502. S2CID 32460867.
- ^ Zup, SL (2003). "Overexpression of bcl-2 reduces sex differences in neuron number in the brain and spinal cord". Journal of Neuroscience. 23 (6): 2357–2362. doi:10.1523/JNEUROSCI.23-06-02357.2003. PMC 6742046. PMID 12657695.
- ^ Fan, H (2001). "Elimination of Bax expression in mice increases cerebellar Purkinje cell numbers but not the number of granule cells". Journal of Computational Neurology. 436 (1): 82–91. doi:10.1002/cne.1055.abs. PMID 11413548.
- ^ Mosinger, Ogilvie (1998). "Suppression of developmental retinal cell death but not of photoreceptor degeneration in Bax-deficient mice". Investigative Ophthalmology & Visual Science. 39: 1713–1720.
- ^ White, FA (1998). "Widespread elimination of naturally occurring neuronal death in Bax-deficient mice". Journal of Neuroscience. 18 (4): 1428–1439. doi:10.1523/JNEUROSCI.18-04-01428.1998. PMC 6792725. PMID 9454852.
- ^ Gianfranceschi, L (1999). "Behavioral visual acuity of wild type and bcl2 transgenic mouse". Vision Research. 39 (3): 569–574. doi:10.1016/s0042-6989(98)00169-2. PMID 10341985. S2CID 5544203.
- ^ Rondi-Reig, L (2002). "To die or not to die, does it change the function? Behavior of transgenic mice reveals a role for developmental cell death". Brain Research Bulletin. 57 (1): 85–91. doi:10.1016/s0361-9230(01)00639-6. PMID 11827740. S2CID 35145189.
- ^ Rondi-Reig, L (2001). "Transgenic mice with neuronal overexpression of bcl-2 gene present navigation disabilities in a water task". Neuroscience. 104 (1): 207–215. doi:10.1016/s0306-4522(01)00050-1. PMID 11311543. S2CID 30817916.
- ^ Buss, Robert R.; Sun, Woong; Oppenheim, Ronald W. (2006-07-21). "Adaptive Roles of Programmed Cell Death During Nervous System Development". Annual Review of Neuroscience. 29 (1): 1–35. doi:10.1146/annurev.neuro.29.051605.112800. ISSN 0147-006X. PMID 16776578.
- ^ Sulston, JE (1980). "The Caenorhabditis elegans male: postembryonic development of nongonadal structures". Developmental Biology. 78 (2): 542–576. doi:10.1016/0012-1606(80)90352-8. PMID 7409314.
- ^ Sulston2, JE (1983). "The embryonic cell lineage of the nematode Caenorhabditis elegans". Developmental Biology. 100 (1): 64–119. doi:10.1016/0012-1606(83)90201-4. PMID 6684600.
- ^ Doe, Cq (1985). "Development and segmental differences in the pattern of neuronal precursor cells". Journal of Developmental Biology. 111 (1): 193–205. doi:10.1016/0012-1606(85)90445-2. PMID 4029506.
- ^ Giebultowicz, JM (1984). "Sexual differentiation in the terminal ganglion of the moth Manduca sexta: role of sex-specific neuronal death". Journal of Comparative Neurology. 226 (1): 87–95. doi:10.1002/cne.902260107. PMID 6736297. S2CID 41793799.
- ^ Cook, B (1998). "Developmental neuronal death is not a universal phenomenon among cell types in the chick embryo retina". Journal of Comparative Neurology. 396 (1): 12–19. doi:10.1002/(sici)1096-9861(19980622)396:1<12::aid-cne2>3.0.co;2-l. PMID 9623884. S2CID 25569721.
- ^ Collazo C, Chacón O, Borrás O (2006). "Programmed cell death in plants resembles apoptosis of animals" (PDF). Biotecnología Aplicada. 23: 1–10. Archived from the original (PDF) on 2012-03-14.
- ^ Bonke M, Thitamadee S, Mähönen AP, Hauser MT, Helariutta Y (2003). "APL regulates vascular tissue identity in Arabidopsis". Nature. 426 (6963): 181–6. Bibcode:2003Natur.426..181B. doi:10.1038/nature02100. PMID 14614507. S2CID 12672242.
- ^ Solomon M, Belenghi B, Delledonne M, Menachem E, Levine A (1999). "The involvement of cysteine proteases and protease inhibitor genes in the regulation of programmed cell death in plants". The Plant Cell. 11 (3): 431–44. doi:10.2307/3870871. JSTOR 3870871. PMC 144188. PMID 10072402. The Plant Cell Online 관련 기사도 참조하십시오.
- ^ Ito J, Fukuda H (2002). "ZEN1 Is a Key Enzyme in the Degradation of Nuclear DNA during Programmed Cell Death of Tracheary Elements". The Plant Cell. 14 (12): 3201–11. doi:10.1105/tpc.006411. PMC 151212. PMID 12468737.
- ^ Balk J, Leaver CJ (2001). "The PET1-CMS Mitochondrial Mutation in Sunflower Is Associated with Premature Programmed Cell Death and Cytochrome c Release". The Plant Cell. 13 (8): 1803–18. doi:10.1105/tpc.13.8.1803. PMC 139137. PMID 11487694.
- ^ Thomas SG, Franklin-Tong VE (2004). "Self-incompatibility triggers programmed cell death in Papaver pollen". Nature. 429 (6989): 305–9. Bibcode:2004Natur.429..305T. doi:10.1038/nature02540. PMID 15152254. S2CID 4376774.
- ^ Crespi B, Springer S (2003). "Ecology. Social slime molds meet their match". Science. 299 (5603): 56–7. doi:10.1126/science.1080776. PMID 12511635. S2CID 83917994.
- ^ Levraud JP, Adam M, Luciani MF, de Chastellier C, Blanton RL, Golstein P (2003). "Dictyostelium cell death: early emergence and demise of highly polarized paddle cells". Journal of Cell Biology. 160 (7): 1105–14. doi:10.1083/jcb.200212104. PMC 2172757. PMID 12654899.
- ^ Roisin-Bouffay C, Luciani MF, Klein G, Levraud JP, Adam M, Golstein P (2004). "Developmental cell death in dictyostelium does not require paracaspase". Journal of Biological Chemistry. 279 (12): 11489–94. doi:10.1074/jbc.M312741200. PMID 14681218.
- ^ Deponte, M (2008). "Programmed cell death in protists". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1783 (7): 1396–1405. doi:10.1016/j.bbamcr.2008.01.018. PMID 18291111.
- ^ 카차노프스키 S, 사지드 M 및 리체 SE 2011 단세포 원생동물 기생충 벡터 4 44에서의 아포토시스 유사 프로그램 세포사 진화
- ^ Proto, W. R.; Coombs, G. H.; Mottram, J. C. (2012). "Cell death in parasitic protozoa: regulated or incidental?" (PDF). Nature Reviews Microbiology. 11 (1): 58–66. doi:10.1038/nrmicro2929. PMID 23202528. S2CID 1633550. Archived from the original (PDF) on 2016-03-03. Retrieved 2014-11-14.
- ^ Szymon Kaczanowski; Mohammed Sajid; Sarah E Reece (2011). "Evolution of apoptosis-like programmed cell death in unicellular protozoan parasites". Parasites & Vectors. 4: 44. doi:10.1186/1756-3305-4-44. PMC 3077326. PMID 21439063.
- ^ de Duve C (1996). "The birth of complex cells". Scientific American. 274 (4): 50–7. Bibcode:1996SciAm.274d..50D. doi:10.1038/scientificamerican0496-50. PMID 8907651.
- ^ Dyall SD, Brown MT, Johnson PJ (2004). "Ancient invasions: from endosymbionts to organelles". Science. 304 (5668): 253–7. Bibcode:2004Sci...304..253D. doi:10.1126/science.1094884. PMID 15073369. S2CID 19424594.
- ^ Chiarugi A, Moskowitz MA (2002). "Cell biology. PARP-1--a perpetrator of apoptotic cell death?". Science. 297 (5579): 200–1. doi:10.1126/science.1074592. PMID 12114611. S2CID 82828773.
- ^ 카차노스키, S. 아포토시스: 그 기원, 역사, 유지 및 암과 노화에 대한 의학적 영향.Phys Biol 13, http://iopscience.iop.org/article/10.1088/1478-3975/13/3/031001
- ^ a b c Srivastava, Rakesh (2007). Apoptosis, Cell Signaling, and Human Diseases. Humana Press.