루마테페론
Lumateperone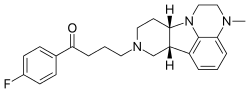 | |
| 임상 데이터 | |
|---|---|
| 발음 | /lu'm't'p'r'n/ roo-m--TE-p--론 |
| 상호 | 카플리타 |
| 기타 이름 | ITI-007, ITI-722 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a620014 |
| 라이선스 데이터 | |
| 루트 행정부. | 입으로 |
| 약물 클래스 | 비정형 항정신병 약물 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 4.4%[1] |
| 단백질 결합 | 97.4%[1] |
| 대사 | 다중 UGT, CYP450 및 AKR 효소[1] |
| 배설물 | 1% 미만으로 소변에[1] 변함이 없음 |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 화학 및 물리 데이터 | |
| 공식 | C24H28FN3O |
| 몰 질량 | 393.506 g/g−1/g |
| 3D 모델(JSmol) | |
| |
카플리타(Caplyta)라는 상표명으로 판매되는 루마테페론은 정신분열증 및 양극성 우울증 치료에 대해 승인된 항정신병 약물이며, 단발성 치료 또는 보조적 치료(리튬 또는 발프로산염 [1]사용)로 알려져 있다.Bristol-Myers Squibb에서 [2]허가된 세포내 치료법에 의해 개발된 부티로페논 비정형 항정신병 약물입니다.루마테페론은 2019년 12월 미국에서 초기 [3][4]정신분열증 징후와 함께 의료용으로 승인되었으며 2020년 [1]2월에 사용할 수 있게 되었다.이후 양극성 우울증에 대한 효능을 입증했으며 2021년 12월 FDA 승인도 받았다.
의료 용도
정신분열증
2019년 12월 20일 미국 식품의약국(FDA)은 성인 [3][4][5]정신분열증 치료를 위해 루마테페론을 승인했다.
양극성 우울증
2021년 12월, FDA는 성인의 양극성 우울증 치료를 위한 루마테페론을 리튬 또는 [1][6]발프로산염을 사용한 보조 치료법으로 승인했다.매일 42mg의 용량으로 양극성 우울증을 치료(NNT)하는 데 필요한 환자 수는 7명이다.
약리학
| 리셉터 | Ki(nM) | |
|---|---|---|
| 5-HT2A | 0 | .54 |
| 도파민수용체D1 | 41 | |
| 세로토닌 트랜스포터 | 33 | |
| 도파민수용체D2 | 32 | |
| 도파민수용체D4 | 100 미만 | |
| 알파-1A아드레날린수용체 | 100 미만 | |
| 알파-1B아드레날린수용체 | 100 미만 | |
작용 메커니즘
루마테페론은 5-HT2A 수용체의 길항제 역할을 하며 친화력이 낮은 여러 도파민 수용체(D1, D2, D4)와 길항한다.항우울제 특성을 뒷받침하는 중간 정도의 세로토닌 운반체 재흡수 억제를 가지고 있다.그것은 눈에 띄는 항무스카린 또는 항히스타민제 특성이 없는 알파-1 수용체에 추가적인 표적외 길항작용을 가지며, 다른 비정형 항정신병 [1]약물들과 관련된 부작용을 제한한다.
약동학
약물을 경구 복용한 후 루마테페론은 1~2시간 이내에 최대 혈장 농도에 도달하며 말기 제거 반감기는 18시간이다.[1]루마테페론은 다양한 글루쿠로노실전달효소(UGT1A1, 1A4, 2B15), 알도케토환원효소(AKR1C1, 1B10, 1C450), 시크롬(Cycycy450)을 포함한 수많은 대사효소의 기질이다.
루마테페론은 일반적인 CYP450 효소의 현저한 억제를 유발하지 않는다.그것은 p-글리코프로틴 [1]기질이 아니다.
역사
FDA는 성인 참가자 818명을 정신분열증에 [3]등록한 세 가지 임상시험(Trial 1/NCT0149956, Trial 2/NCT02282761, Trial 3/NCT02469155)의 증거를 토대로 루마테페론을 승인했다.이 실험은 미국의 [3]33개 사이트에서 실시되었다.시험 1과 2는 루마테페론의 유익성과 부작용에 대한 데이터를 제공했고, 시험 3은 부작용에 대한 데이터만 [3]제공하였다.
세 번의 시험에서 [3]루마테페론의 승인을 위한 데이터가 제공되었습니다.각 임상시험에서 정신분열증이 있는 입원 참가자들은 무작위로 루마테페론 또는 비교치료(플라세보 또는 활성 대조군)를 4주 또는 6주 동안 매일 한 번씩 받도록 배정되었다.[3]실험 참가자와 의료 제공자 모두 시험이 [3]완료될 때까지 어떤 치료가 제공되는지 알지 못했다.
시험 1과 2는 4주간의 [3]치료를 통해 유익성과 부작용의 평가를 위한 데이터를 제공했다.유익성은 정신분열증 [3]증상의 전반적인 개선을 측정하여 평가하였다.시험 3은 [3]치료 6주 동안만 부작용 평가에 대한 데이터를 제공했다.
양극성 우울증의 치료를 위해 2개의 단계 III 루마테페론 단일요법 연구가 수행되고 완료되었으며, 그 중 Study 401과 Study 404를 [7]시험 중이다.세 번째 시험인 Study 402는 리튬 또는 [8][9]발프로산염과 더불어 루마테페론을 테스트하는 것을 목표로 하고 있으며, 이 시험과 [10][9]관련된 데이터는 2020년에 발표될 예정이다.
Study 401은 미국에서만 수행되었고 Study 404는 글로벌 연구였으며 [citation needed]미국 환자를 포함했다.전체 연구 404명(381명 환자) 중 3분의 2가 러시아와 콜롬비아 출신이었다.두 가지 단발성 요법의 완료 시, 연구 404만이 1차 종말점과 2차 [11][12]종말점 중 하나를 충족했다.Study 404에서 환자들은 매일 한 번 42mg의 루마테페론을 투여받거나 6주 동안 위약을 투여받았다.연구 404 환자는 MADRS 총점 4.[13]6의 변화로 입증된 위약에 비해 우울증 증상이 개선되었다.
레퍼런스
- ^ a b c d e f g h i j k l m "Caplyta- lumateperone capsule". DailyMed. Intra-Cellular Therapies, Inc. 27 December 2019. Retrieved 3 July 2020.
- ^ Celanire S, Poli S, eds. (13 October 2014). Small Molecule Therapeutics for Schizophrenia. Springer. pp. 31–. ISBN 978-3-319-11502-3.
- ^ a b c d e f g h i j k "Drug Trials Snapshots: Caplyta". U.S. Food and Drug Administration (FDA). 20 December 2019. Retrieved 2 July 2020.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ a b "Drug Approval Package: Caplyta". U.S. Food and Drug Administration (FDA). 21 January 2020. Retrieved 1 July 2020.
- ^ "FDA Approves Intra-Cellular Therapies' Novel Antipsychotic, Caplyta (lumateperone) for the Treatment of Schizophrenia in Adults" (Press release). Intra-Cellular Therapies Inc. 23 December 2019. Retrieved 1 July 2020 – via GlobeNewswire.
- ^ "Intra-Cellular Therapies Announces U.S. FDA Approval of CAPLYTA® (Lumateperone) for the Treatment of Bipolar Depression in Adults Intra-Cellular Therapies Inc".
- ^ "Intra-Cellular Therapies Announces Positive Top-line Results from a Phase 3 Trial of Lumateperone in Patients with Bipolar Depression" (Press release). Intra-Cellular Therapies Inc. 8 July 2019. Retrieved 6 November 2019 – via GlobeNewswire.
- ^ "Intra-Cellular Therapies Announces Positive Top-line Results from a Phase 3 Trial of Lumateperone in Patients with Bipolar Depression" (Press release). Intra-Cellular Therapies Inc. 8 July 2019. Retrieved 6 November 2019 – via GlobeNewswire.
- ^ a b "Why Intra-Cellular Therapies Is Tanking Today". Yahoo! Finance. Retrieved 6 November 2019.
- ^ "One out of two is not enough for Intra-Cellular". Evaluate. 8 July 2019. Retrieved 6 November 2019.
- ^ "One out of two is not enough for Intra-Cellular". Evaluate. 8 July 2019. Retrieved 6 November 2019.
- ^ DeArment A (8 July 2019). "Intra-Cellular Therapies hits one, misses another in Phase III bipolar disorder program". MedCity News. Retrieved 6 November 2019.
- ^ "Phase 3 data supports lumateperone for bipolar depression". Healio. 8 July 2019. Retrieved 6 November 2019.
외부 링크
- "Lumateperone". Drug Information Portal. U.S. National Library of Medicine.


