미엘린단백질영로
Myelin protein zero| 엠피즈 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 별칭 | MPZ, CHM, CMT1, CMT1B, CMT2I, CMT2J, CMT4E, CMTDI3, CMTDID, DSS, HMSNIB, MPP, P0, 골인단백질 제로, CHN2 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 159440 MGI: 103177 호몰로진: 445 GeneCard: MPZ | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 위치(UCSC) | Chr 1: 161.3 – 161.31Mb | Chr 1: 170.98 – 170.99Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
미엘린 단백질 제로(P0, MPZ)는 인간에서 MPZ 유전자에 의해 인코딩되는 단일 막 당단백질이다[5].P0는 말초신경계(PNS) 내 골격의 주요 구조물이다.[6]미엘린 단백질 0은 슈완 세포에 의해 발현되며 말초신경계에 있는 모든 단백질의 50% 이상을 차지하여 PNS에서 발현되는 가장 흔한 단백질이다.[6]myelin 단백질 0의 돌연변이는 myelin 결핍을 유발할 수 있으며 Charcot-Marie-와 같은 신경병증과 관련이 있다.치병, 데제린-소타스병.[7]
구조
| 미엘린-PO_C | |||||||||
|---|---|---|---|---|---|---|---|---|---|
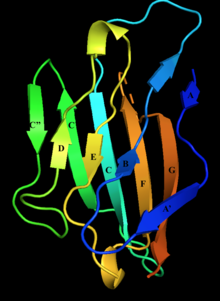 베타 가닥이 라벨로 표시된 미엘린 단백질 제로의 세포외 영역의 구조.Strand D, E, B, A는 하나의 베타 시트를 구성하고 Strand A', G, F, C'는 다른 베타 시트를 구성한다. | |||||||||
| 식별자 | |||||||||
| 기호 | 미엘린-PO_C | ||||||||
| Pfam | PF10570 | ||||||||
| 인터프로 | IPR019566 | ||||||||
| OPM 슈퍼 패밀리 | 193 | ||||||||
| OPM단백질 | 삼오아이 | ||||||||
| 멤브라노메 | 213 | ||||||||
| |||||||||
인간에서 미엘린 단백질 0을 암호화하는 유전자는 더피 로커스 또는 더피 항원/케모킨 수용체 근처의 1번 염색체에 위치한다.이 유전자는 약 7천 염기이며 6개의 엑손으로 나뉜다.미엘린 단백질 제로는 총 219개의 아미노산이 있으며[6], 기본 아미노산 잔류물이 많다.[8]
미엘린 단백질 0은 세포외 N-단자 영역(아미노산 1-124), 단일 투과체 영역(125-150), 더 작은 양의 세포 내 영역(151-219)으로 구성된다.[6][9][10]그것의 세포질 영역은 매우 긍정적으로 충전되어 있지만 아마도 구상 구조로 접히지 않을 것이다.[11]세포외 영역은 구조적으로 면역글로불린 영역과[8] 유사하므로 단백질은 면역글로불린 슈퍼[12] 패밀리에 속하는 것으로 간주된다.
미엘린 단백질 제로(zero)는 모노머로 존재하는 것 외에도 척추동물에서 다른 미엘린 단백질 제로 분자와 함께 디머와 테트라머를 형성하는 것으로 알려져 있다.[13]
함수
미엘린 피복은 신경계 특유의 다층막으로 축방향 임펄스 전도 속도를 크게 높이는 절연체 역할을 한다.중추신경계에 없는 미엘린 단백질 0은 말초신경 내 미엘린 피복의 주요 성분이다.[14]myelin 단백질 0의 기능을 방해하는 돌연변이는 myelin의 발현을 줄이고 말초신경계에서 myelin 피복의 퇴화로 이어질 수 있다.[15]현재 미엘린 단백질 영점 표현은 액손의 신호에 의해 생성되는 것으로 가정하고 있다.그러나 미엘린 단백질 제로의 규제에 대한 자세한 내용은 알려지지 않았다.[6]
미엘린 단백질 0이 말초신경 미엘린의 형성과 안정화에 있어 구조적인 요소라고 가정한다.[9]미엘린 단백질 0도 세포 접착 분자로 작용하여 여러 층의 미엘린을 함께 보유한다는 가설을 세우고 있다.[10]골수성 세포가 액손에 여러 번 막을 감아 여러 층의 골수성 미엘린을 생성하면 미엘린 단백질 제로는 이 시트들을 촘촘하게 유지시켜주는 '글루' 역할을 한다.[11]그것은 그것의 특징적인 코일 구조를 반대편 빌레이어의 세포질 표면에 있는 산성 지질들과 그것의 양전하 세포내 영역의 정전기적 상호작용과[8] 인접한 세포외 영역의 소수성 구상체 '머리' 사이의 상호작용에 의해 함께 고정시킴으로써 그렇게 한다.[14][14]
미엘린 단백질 제로의 기능은 폴리임무노글로빈, T4 단백질과 같은 면역글로빈 영역을 가진 다른 단백질의 기능과 유사하다.이 단백질들은 결합과 접착 분자로 기능하며 두 개의 유사한 단백질을 포함하는 동형 상호작용, 즉 상호작용을 한다.[9]미엘린 단백질 제로는 다른 미엘린 단백질 제로 단백질과의 호모티피 상호작용에 참여함으로써 미엘린 피복을 결합시킨다.미엘린 단백질 제로의 세포외 영역은 다른 미엘린 단백질 제로 세포외 영역과의 호모형 상호작용과 세포외 트립토판 잔류물을 이용하여 미엘린 스피골리피드 막에 결합하고 미엘린 층을 결합한다.[7][8]
미엘린 단백질 0은 또한 주변 미엘린 단백질 22와 같은 다른 단백질과 상호작용하는 것으로 증명되었다.[16]그러나 이 시점에서 이러한 상호작용의 목적은 아직 결정되지 않았다.[16]
신경증과의 연관성
미엘린 단백질 0의 돌연변이는 미엘린 퇴화와 신경증을 유발하는 것으로 알려져 있다.[7]미엘린 단백질 제로의 접착 기능이나 다른 미엘린 단백질 제로 단백질과의 홈타입 상호작용에 참여하는 능력을 저하시키는 돌연변이가 신경증을 일으키는 것으로 생각된다.[17]미엘린 단백질 0에 대한 돌연변이는 초기 미엘린의 발달이나 후기 미엘린 퇴화에 대한 문제로 이어질 수 있다.[12]어떤 돌연변이는 데르제린소타스병처럼 유아기에 신경증을 유발할 수 있는 반면, 다른 돌연변이는 샤르코마리토스병처럼 생애 첫 20년 안에 신경증을 유발할 수 있다.[7]충전된 아미노산을 첨가하거나 세포외막에서 시스테인 잔여물을 바꾸는 것은 신경장애를 조기에 유발할 수 있다.세포질 영역을 잘라내거나 미엘린 단백질 0의 3차 구조를 바꾸는 것도 세포질 영역이 동질상 상호작용에 필요한 것으로 입증되었기 때문에 신경증을[7] 유발할 수 있다.[12]
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000158887 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000056569 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Magnaghi V, Cavarretta I, Galbiati M, Martini L, Melcangi RC (November 2001). "Neuroactive steroids and peripheral myelin proteins". Brain Research. Brain Research Reviews. 37 (1–3): 360–71. doi:10.1016/s0165-0173(01)00140-0. PMID 11744100. S2CID 8004545.
- ^ a b c d e Shy ME (March 2006). "Peripheral neuropathies caused by mutations in the myelin protein zero". Journal of the Neurological Sciences. 242 (1–2): 55–66. doi:10.1016/j.jns.2005.11.015. PMID 16414078. S2CID 32802793.
- ^ a b c d e Shy ME, Jáni A, Krajewski K, Grandis M, Lewis RA, Li J, Shy RR, Balsamo J, Lilien J, Garbern JY, Kamholz J (February 2004). "Phenotypic clustering in MPZ mutations". Brain. 127 (Pt 2): 371–84. doi:10.1093/brain/awh048. PMID 14711881.
- ^ a b c d Shapiro L, Doyle JP, Hensley P, Colman DR, Hendrickson WA (September 1996). "Crystal structure of the extracellular domain from P0, the major structural protein of peripheral nerve myelin". Neuron. 17 (3): 435–49. doi:10.1016/s0896-6273(00)80176-2. PMID 8816707. S2CID 1719833.
- ^ a b c Lemke G, Axel R (March 1985). "Isolation and sequence of a cDNA encoding the major structural protein of peripheral myelin". Cell. 40 (3): 501–8. doi:10.1016/0092-8674(85)90198-9. PMID 2578885. S2CID 1230708.
- ^ a b Lemke G, Lamar E, Patterson J (March 1988). "Isolation and analysis of the gene encoding peripheral myelin protein zero". Neuron. 1 (1): 73–83. doi:10.1016/0896-6273(88)90211-5. PMID 2483091. S2CID 51695021.
- ^ a b Han H, Myllykoski M, Ruskamo S, Wang C, Kursula P (January 2013). "Myelin-specific proteins: a structurally diverse group of membrane-interacting molecules". BioFactors. 39 (3): 233–41. doi:10.1002/biof.1076. PMID 23780694. S2CID 21111930.
- ^ a b c Kamholz JA, Brucal M, Li J, Shy M (2007), "Myelin Protein Zero and CMT1B: A Tale of Two Phenotypes", Molecular Neurology, Elsevier, pp. 463–474, doi:10.1016/b978-012369509-3.50031-7, ISBN 9780123695093
- ^ Thompson AJ, Cronin MS, Kirschner DA (March 2002). "Myelin protein zero exists as dimers and tetramers in native membranes of Xenopus laevis peripheral nerve". Journal of Neuroscience Research. 67 (6): 766–71. doi:10.1002/jnr.10167. PMID 11891790. S2CID 36556147.
- ^ a b c Sakamoto Y, Kitamura K, Yoshimura K, Nishijima T, Uyemura K (March 1987). "Complete amino acid sequence of PO protein in bovine peripheral nerve myelin". The Journal of Biological Chemistry. 262 (9): 4208–14. doi:10.1016/S0021-9258(18)61334-1. PMID 2435734.
- ^ Kirschner DA, Inouye H, Saavedra RA (November 1996). "Membrane adhesion in peripheral myelin: good and bad wraps with protein P0". Structure. 4 (11): 1239–44. doi:10.1016/s0969-2126(96)00132-3. PMID 8939762.
- ^ a b D'Urso D, Ehrhardt P, Müller HW (May 1999). "Peripheral myelin protein 22 and protein zero: a novel association in peripheral nervous system myelin". The Journal of Neuroscience. 19 (9): 3396–403. doi:10.1523/JNEUROSCI.19-09-03396.1999. PMC 6782240. PMID 10212299.
- ^ Pareyson, Davide; Marchesi, Chiara; Salsano, Ettore (2013), "Dominant Charcot–Marie–Tooth syndrome and cognate disorders", Handbook of Clinical Neurology, Elsevier, 115: 817–845, doi:10.1016/b978-0-444-52902-2.00047-3, ISBN 9780444529022, PMID 23931817
추가 읽기
- Patel PI, Lupski JR (April 1994). "Charcot-Marie-Tooth disease: a new paradigm for the mechanism of inherited disease". Trends in Genetics. 10 (4): 128–33. doi:10.1016/0168-9525(94)90214-3. PMID 7518101.
- Roa BB, Lupski JR (1995). "Molecular genetics of Charcot-Marie-Tooth neuropathy". Advances in Human Genetics. Vol. 22. pp. 117–52. doi:10.1007/978-1-4757-9062-7_3. ISBN 978-1-4757-9064-1. PMID 7762451.
{{cite book}}:누락 또는 비어 있음title=(도움말) - Nelis E, Haites N, Van Broeckhoven C (1999). "Mutations in the peripheral myelin genes and associated genes in inherited peripheral neuropathies". Human Mutation. 13 (1): 11–28. doi:10.1002/(SICI)1098-1004(1999)13:1<11::AID-HUMU2>3.0.CO;2-A. PMID 9888385.
- Watanabe M, Yamamoto N, Ohkoshi N, Nagata H, Kohno Y, Hayashi A, Tamaoka A, Shoji S (September 2002). "Corticosteroid- responsive asymmetric neuropathy with a myelin protein zero gene mutation". Neurology. 59 (5): 767–9. doi:10.1212/wnl.59.5.767. PMID 12221176.
- Hattori N, Yamamoto M, Yoshihara T, Koike H, Nakagawa M, Yoshikawa H, Ohnishi A, Hayasaka K, Onodera O, Baba M, Yasuda H, Saito T, Nakashima K, Kira J, Kaji R, Oka N, Sobue G (January 2003). "Demyelinating and axonal features of Charcot-Marie-Tooth disease with mutations of myelin-related proteins (PMP22, MPZ and Cx32): a clinicopathological study of 205 Japanese patients". Brain. 126 (Pt 1): 134–51. doi:10.1093/brain/awg012. PMID 12477701.
- Shy ME (March 2006). "Peripheral neuropathies caused by mutations in the myelin protein zero". Journal of the Neurological Sciences. 242 (1–2): 55–66. doi:10.1016/j.jns.2005.11.015. PMID 16414078. S2CID 32802793.
- Hayasaka K, Nanao K, Tahara M, Sato W, Takada G, Miura M, Uyemura K (October 1991). "Isolation and sequence determination of cDNA encoding the major structural protein of human peripheral myelin". Biochemical and Biophysical Research Communications. 180 (2): 515–8. doi:10.1016/S0006-291X(05)81094-0. PMID 1719967.
- Ouvrier RA, McLeod JG, Conchin TE (February 1987). "The hypertrophic forms of hereditary motor and sensory neuropathy. A study of hypertrophic Charcot-Marie-Tooth disease (HMSN type I) and Dejerine-Sottas disease (HMSN type III) in childhood". Brain. 110 ( Pt 1) (1): 121–48. doi:10.1093/brain/110.1.121. PMID 3467805.
- Tachi N, Ishikawa Y, Minami R (1985). "Two cases of congenital hypomyelination neuropathy". Brain & Development. 6 (6): 560–5. doi:10.1016/s0387-7604(84)80101-1. PMID 6099985. S2CID 4767216.
- Hayasaka K, Himoro M, Wang Y, Takata M, Minoshima S, Shimizu N, Miura M, Uyemura K, Takada G (September 1993). "Structure and chromosomal localization of the gene encoding the human myelin protein zero (MPZ)". Genomics. 17 (3): 755–8. doi:10.1006/geno.1993.1400. PMID 7503936.
- Su Y, Brooks DG, Li L, Lepercq J, Trofatter JA, Ravetch JV, Lebo RV (November 1993). "Myelin protein zero gene mutated in Charcot-Marie-tooth type 1B patients". Proceedings of the National Academy of Sciences of the United States of America. 90 (22): 10856–60. Bibcode:1993PNAS...9010856S. doi:10.1073/pnas.90.22.10856. PMC 47877. PMID 7504284.
- Himoro M, Yoshikawa H, Matsui T, Mitsui Y, Takahashi M, Kaido M, Nishimura T, Sawaishi Y, Takada G, Hayasaka K (September 1993). "New mutation of the myelin P0 gene in a pedigree of Charcot-Marie-Tooth neuropathy 1". Biochemistry and Molecular Biology International. 31 (1): 169–73. PMID 7505151.
- Hayasaka K, Himoro M, Sawaishi Y, Nanao K, Takahashi T, Takada G, Nicholson GA, Ouvrier RA, Tachi N (November 1993). "De novo mutation of the myelin P0 gene in Dejerine-Sottas disease (hereditary motor and sensory neuropathy type III)". Nature Genetics. 5 (3): 266–8. doi:10.1038/ng1193-266. PMID 7506095. S2CID 2512684.
- Pham-Dinh D, Fourbil Y, Blanquet F, Mattéi MG, Roeckel N, Latour P, Chazot G, Vandenberghe A, Dautigny A (December 1993). "The major peripheral myelin protein zero gene: structure and localization in the cluster of Fc gamma receptor genes on human chromosome 1q21.3-q23". Human Molecular Genetics. 2 (12): 2051–4. doi:10.1093/hmg/2.12.2051. PMID 7509228.
- Thomas FP, Lebo RV, Rosoklija G, Ding XS, Lovelace RE, Latov N, Hays AP (1994). "Tomaculous neuropathy in chromosome 1 Charcot-Marie-Tooth syndrome". Acta Neuropathologica. 87 (1): 91–7. doi:10.1007/BF00386259. PMID 7511317. S2CID 19827120.
- Nelis E, Timmerman V, De Jonghe P, Vandenberghe A, Pham-Dinh D, Dautigny A, Martin JJ, Van Broeckhoven C (December 1994). "Rapid screening of myelin genes in CMT1 patients by SSCP analysis: identification of new mutations and polymorphisms in the P0 gene". Human Genetics. 94 (6): 653–7. doi:10.1007/bf00206959. PMID 7527371. S2CID 5750189.
- Hilmi S, Fournier M, Valeins H, Gandar JC, Bonnet J (February 1995). "Myelin P0 glycoprotein: identification of the site phosphorylated in vitro and in vivo by endogenous protein kinases". Journal of Neurochemistry. 64 (2): 902–7. doi:10.1046/j.1471-4159.1995.64020902.x. PMID 7530295. S2CID 32511382.
- Rautenstrauss B, Nelis E, Grehl H, Pfeiffer RA, Van Broeckhoven C (September 1994). "Identification of a de novo insertional mutation in P0 in a patient with a Déjérine-Sottas syndrome (DSS) phenotype". Human Molecular Genetics. 3 (9): 1701–2. doi:10.1093/hmg/3.9.1701. PMID 7530550.
- Latour P, Blanquet F, Nelis E, Bonnebouche C, Chapon F, Diraison P, Ollagnon E, Dautigny A, Pham-Dinh D, Chazot G (1995). "Mutations in the myelin protein zero gene associated with Charcot-Marie-Tooth disease type 1B". Human Mutation. 6 (1): 50–4. doi:10.1002/humu.1380060110. PMID 7550231. S2CID 20852048.
외부 링크
| 무료 사전인 위키트리노리에서 myelin 단백질 0을 찾아봐. |
- Charcot-Marie-Tooth 신경증 유형 1의 GeneReviews/NCBI/NIH/UW 항목
- Charcot-Marie-Tooth 신경증 유형 2의 GeneReviews/NCBI/NIH/UW 항목
- 미엘린+단백+제로 미국 국립 의학 도서관의 의학 과목 제목(MesH)
- PDBe-KB에서 UniProt: P25189(Myelin 단백질 P0)에 대해 PDB에서 사용할 수 있는 모든 구조 정보의 개요.