톨카폰
Tolcapone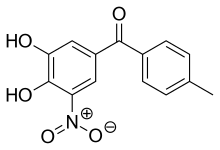 | |
 | |
| 임상 데이터 | |
|---|---|
| 상호 | 타스마르 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a698036 |
| 라이선스 데이터 | |
| 임신 카테고리 |
|
| 루트 행정부. | 입으로 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 65% |
| 단백질 결합 | 99.9% 이상 |
| 대사 | 간(주로 글루쿠론화) |
| 반감기 제거 | 2~3시간 |
| 배설물 | 소변(60%), 대변(40%) 대사되지 않은 형태의 불과 0.5퍼센트 |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 첸블 | |
| PDB배위자 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.222.604 |
| 화학 및 물리 데이터 | |
| 공식 | C14H11NO5 |
| 몰 질량 | 273.244 g/120−1 |
| 3D 모델(JSmol) | |
| 녹는점 | 143~146°C(289~295°F) |
| 물에 녹는 정도 | 녹지 않다 |
| |
| |
| (표준) | |
Tasmar라는 상표명으로 판매되는 Tolcapone은 파킨슨병을 치료하는데 사용되는 약이다.카테콜-O-메틸전달효소(COMT)[1]의 선택적이고 강력하며 가역적인 니트로산콜형 억제제이다.이는 상당한 간 독성을 보여 많은 국가에서 시판 허가를 중단시켰다.
또 다른 니트로카테콜 COMT 억제제인 엔타카폰과 비교하여 톨카폰은 반감기가 길고(0.8시간 대비 2.9시간) 중추신경계와 [2]말초에서 모두 작용하여 혈액-뇌 장벽을 더 잘 통과할 수 있다.하지만, 엔타카폰은 간에는 덜 독성이 있다.
의료 용도
톨카폰은 레보도파/카르비도파 또는 레보도파/벤세라지드 약물의 보조제로 파킨슨병 치료에 사용된다.레보도파는 파킨슨 증상을 감소시키는 도파민의 프로드러그이며, 카르비도파와 벤세라지드는 방향족 L-아미노산 탈탄산화효소(AADC) 억제제이다.[4]
톨카폰을 투여하지 않으면, 레보도파의 이로운 효과는 더 빨리 사라져 운동 [5]변동을 일으키는 경향이 있다.
금지 사항
톨카폰과 페넬진, 트라닐시프로민 등의 비선택적 모노아민 산화효소 억제제의 조합은 [6]금지된다.톨카폰은 또한 간 질환이나 증가된 간 [7]효소를 가진 사람들에게는 금지된다.
부작용
톨카폰은 약의 효용을 제한하는 유의한 간 독성(간 독성)[8]을 보여 왔다.엔타카폰은 다른 대안으로, 주로 더 유리한 독성 프로파일을 가지고 있기 때문이다.
간독성은 아미노산 전환효소 수치 상승과 관련이 있을 수 있지만, 연구 결과에 따르면 효소 수치가 모니터링될 때 간 상태가 존재하지 않는 사람들에 대한 위험은 최소인 것으로 나타났다.명확한 메커니즘은 없지만 산화적 인산화 [9]분리에 의한 미토콘드리아 호흡 이상과 관련이 있다는 가설이 있다.
다른 [7]부작용들은 소화기 증상을 포함한 도파민 작용의 증가와 관련이 있다.톨카폰으로 치료하면 운동장애를 유발하거나 연장시킬 위험이 있다; 이것은 레보도파 복용량을 줄임으로써 대항할 수 있다.이는 톨카폰의 투여가 생물학적 메틸 [9]공여체 S-아데노실-L-메티오닌(SAM)이 선조체에 축적되어 파킨슨 증상을 유발하기 때문에 발생한다.
소화기 증상으로는 메스꺼움과 설사를 포함하며, 추가적인 도파민 작동성 부작용으로는 기립성 저혈압, 입마름, 땀과 어지럼증이 포함됩니다.톨카폰은 엔타카폰보다 더 심한 설사를 유발한다;[6] 이것은 연구에서 치료를 중단하는 가장 흔한 이유였다.소변 변색은 소변에 배설되는 노란 톨카폰 대사물로부터 발생하며 [7][9]무해하다.
상호 작용
도파민 수치 증가는 바람직한 상호작용이지만, 톨카폰은 이론적으로 AADC 억제제인 카르비도파 및 벤제라지드뿐만 아니라 메틸도파, 도부타민, 아포모르핀, 아드레날린 및 이소프레날린과 같은 COMT에 의해 대사되는 다른 약물의 수치도 증가시킬 수 있다.연구에서 벤제라지드와 약간의 상호작용이 관찰되었지만, 카르비도파와는 그렇지 않았다.이 약물 그룹과의 다른 상호작용은 연구되지 않았다.모노아민 산화효소(MAO) 억제제 및 노르아드레날린 재흡수 억제제와 같이 카테콜아민 농도를 증가시키는 약물과 관련된 이론적 상호작용 유형은 실제로 약간의 효과만 보였다.비선택적 MAO 억제제와의 조합은 [6][7]위험할 수 있다.
간 효소 CYP2C9에 대한 친화력 때문에 이 효소에 의해 대사되는 약물과의 상호작용도 가능하지만 가능성은 낮다.연구에서 [7]2C9 기질인 톨부타미드와의 상호작용은 관찰되지 않았다.
약리학
작용 메커니즘
톨카폰은 레보도파를 [10]포함한 3가지 카테콜아민 중 어느 것보다도 높은 친화력으로 말초 및 중추신경계(CNS) 모두에서 COMT의 촉매 부위에 선택적으로 가역적으로[6] 결합한다.따라서 말초에서 COMT에 의한 레보도파의 3-O-메틸화를 방지하여 혈액-뇌 장벽을 통과하기 위해 레보도파와 경쟁하는 주요 대사물인 3-O-메틸도파를 생성한다.투여된 레보도파의 더 많은 양이 CNS에 도달한다.또한 이미 CNS에 도달한 레보도파는 도파민으로 전환된 후 톨카폰이 COMT 활성을 억제할 때처럼 빠르게 분해되지 않는다.따라서 톨카폰은 생체 가용성을 향상시키고 레보도파와 후속적으로 [11]중추신경계의 도파민 클리어런스를 감소시킨다.
억제 상수i K(2.5nM)로 대표되는 톨카폰의 결합 친화력의 강도는 효소 및 억제 복합 역학에 대한 해리 상수로 생각할 수 있다.최대 촉매 활성은 톨카폰의 유효성을 나타낸다(V = 58.4 pmol/minmax·mg).[12]
약동학
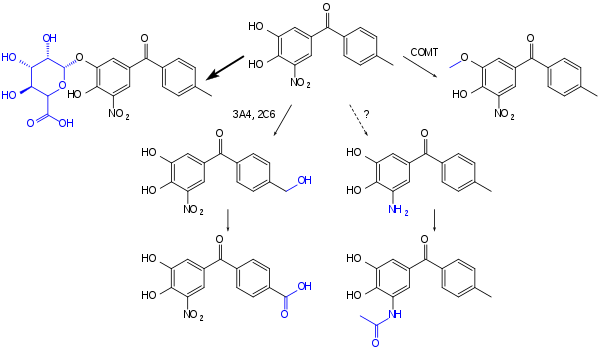
톨카폰은 장에서 약 85%까지 빠르게 흡수된다.절대 생체이용률은 65%이며, 식품과 함께 섭취할 경우 약간 감소합니다.그 물질은 약 2시간 후에 혈장 농도가 가장 높아진다.혈류에서, 그것은 거의 완전히 혈장 단백질, 주로 알부민에 결합된다.주요 불활성화 단계는 글루쿠론화이며, 다른 과정은 COMT에 의한 메틸화, CYP3A4 및 CYP2A6에 의한 히드록실화와 후속 아세틸화에 [6][7]의한 아민으로의 환원 경로일 수 있다.
톨카폰의 반감기는 2~3시간이며, 유통량(Vd)은 0.3L/kg(평균 70kg인 [5]경우 21L)이다.대사물의 60%는 소변을 통해, 40%는 대변을 통해 배설된다.약물의 0.5%만이 [6][7]소변을 통해 변하지 않은 형태로 배설된다.
톨카폰의 99%는 생리학적 pH가 7.4이기 때문에 체내에서 모노 음이온 형태이다.톨카폰은 R-치환물 [vague]때문에 친유성이 더 높기 때문에 다른 두 가지 니트로카폰과 엔타카폰보다 혈액-뇌 장벽을 훨씬 더 잘 관통한다.분할 계수는 혈액-뇌 장벽을 통과하는 분자의 능력을 정량화한다.톨카폰, 니테카폰 및 엔타코폰에 대해 각각 LogPIdce= 0.2, –1.4, –0.4.이 경우 분할 계수는 1,2-디클로로에탄/로 측정되었다.분자를2 이온화한 HO 용액.이러한 하전 분자가 혈액-뇌 [13]장벽에 어떻게 침투하는지에 대한 현재 설명은 없다.
화학
톨카폰은 273.25g/mol의 상대 분자량을 가진 강한 노란색, 무취, 쓴맛, 비흡습성, 결정성 화합물이다.143~146°C(289~295°F)에서 녹으며, 물과 산에는 거의 녹지 않지만 0.1M 수산화나트륨 수용액에는 녹는다.2개의a 페닐기에 대해 pK 값은 4.5와 10.6이며, 최대 흡수는 268 nm(0.1M 염산/에탄올)[6]이다.화학명은 3,4-디히드록시-4'-메틸-5-니트로벤조페논이다.
합성
2008년에 제안된 톨카폰의 합성은 벤즈알데히드 유도체와 p-톨릴 마그네슘 브롬화물 사이의 그리냐르 반응으로 시작된다.이렇게 생성된 알코올은 t-부톡사이드 나트륨을 사용하여 케톤으로 변환됩니다.벤질 보호기는 포름산암모늄의 존재 하에서 팔라듐 촉매 수소화에 의해 제거된다.벤질 에테르 절단 시 마스크되지 않은 수산기와 인접한 5위치에 니트로기를 도입한다.합성은 염화알루미늄을 사용하여 제품 [14]알코올을 생성하는 메톡시기를 분해하는 것으로 끝납니다.

역사
톨카폰은 1997년 8월에 유럽 시장에, 1998년 3월에 미국 시장에 도입되었습니다.간 독성은 톨카폰을 투여받은 4명에게 보고되었으며, 합병증으로 3명이 사망했다.이에 따라 톨카폰의 판매 허가는 1998년 12월부터 2004년 8월까지 중단됐다.1998년 11월 톨카폰을 제조한 회사는 자발적으로[15] 그 약을 시장에서 철수시켰다.그 후 [16]허가는 2009년 8월에 갱신되었다.
보고된 합병증의 결과로, 미국 식품의약국(FDA)은 1998년 [17]11월 파킨슨병에 대해 처방된 톨카폰의 모니터링을 규제하는 것을 목표로 한 톨카폰과 라벨 개정의 블랙박스를 발행했다.1999년 2월 호주, 1999년 4월 불가리아, 1998년 11월 아이슬란드, 1998년 [15]12월 리투아니아 등 많은 국가들이 톨카폰을 시장에서 철수했다.
조사.
이 약물이 활성이 있을 수 있다는 예비 데이터 때문에 미국 FDA는 가족성 트란스티레틴 아밀로이드증(ATTR) 치료를 목적으로 한 연구에서 톨카폰 "고르판 약물 상태"를 부여했다.그러나 톨카폰은 FDA에서 이 질병의 치료를 위해 승인하지 않았다.[18][19]
레퍼런스
- ^ Antonini A, Abbruzzese G, Barone P, Bonuccelli U, Lopiano L, Onofrj M, et al. (February 2008). "COMT inhibition with tolcapone in the treatment algorithm of patients with Parkinson's disease (PD): relevance for motor and non-motor features". Neuropsychiatric Disease and Treatment. 4 (1): 1–9. doi:10.2147/NDT.S2404. PMC 2515921. PMID 18728767.
- ^ Forsberg M, Lehtonen M, Heikkinen M, Savolainen J, Järvinen T, Männistö PT (February 2003). "Pharmacokinetics and pharmacodynamics of entacapone and tolcapone after acute and repeated administration: a comparative study in the rat". The Journal of Pharmacology and Experimental Therapeutics. 304 (2): 498–506. doi:10.1124/jpet.102.042846. PMID 12538800. S2CID 24863335.
- ^ Ellermann M, Lerner C, Burgy G, Ehler A, Bissantz C, Jakob-Roetne R, et al. (March 2012). "Catechol-O-methyltransferase in complex with substituted 3'-deoxyribose bisubstrate inhibitors". Acta Crystallographica. Section D, Biological Crystallography. 68 (Pt 3): 253–60. doi:10.1107/S0907444912001138. PMID 22349227.
- ^ Dingemanse J, Jorga K, Zürcher G, Schmitt M, Sedek G, Da Prada M, Van Brummelen P (September 1995). "Pharmacokinetic-pharmacodynamic interaction between the COMT inhibitor tolcapone and single-dose levodopa". British Journal of Clinical Pharmacology. 40 (3): 253–62. doi:10.1111/j.1365-2125.1995.tb05781.x. PMC 1365105. PMID 8527287.
- ^ a b Jorga KM, Fotteler B, Heizmann P, Zürcher G (July 1998). "Pharmacokinetics and pharmacodynamics after oral and intravenous administration of tolcapone, a novel adjunct to Parkinson's disease therapy". European Journal of Clinical Pharmacology. 54 (5): 443–7. doi:10.1007/s002280050490. PMID 9754991. S2CID 19203574.
- ^ a b c d e f g Dinnendahl V, Fricke U, eds. (1998). Arzneistoff-Profile (in German). Vol. 10 (13 ed.). Eschborn, Germany: Govi Pharmazeutischer Verlag. ISBN 978-3-7741-9846-3.
- ^ a b c d e f g h "Tasmar: EPAR – Product Information" (PDF). European Medicines Agency. 3 August 2016.
- ^ Olanow CW, Watkins PB (2007). "Tolcapone: an efficacy and safety review (2007)". Clinical Neuropharmacology. 30 (5): 287–94. doi:10.1097/wnf.0b013e318038d2b6. PMID 17909307. S2CID 19148461.
- ^ a b c Truong DD (2009). "Tolcapone: review of its pharmacology and use as adjunctive therapy in patients with Parkinson's disease". Clinical Interventions in Aging. 4: 109–13. doi:10.2147/CIA.S3787. PMC 2685232. PMID 19503773.
- ^ Deleu D, Northway MG, Hanssens Y (2002). "Clinical pharmacokinetic and pharmacodynamic properties of drugs used in the treatment of Parkinson's disease". Clinical Pharmacokinetics. 41 (4): 261–309. doi:10.2165/00003088-200241040-00003. PMID 11978145. S2CID 39359348.
- ^ Jorga K, Fotteler B, Heizmann P, Gasser R (October 1999). "Metabolism and excretion of tolcapone, a novel inhibitor of catechol-O-methyltransferase". British Journal of Clinical Pharmacology. 48 (4): 513–20. doi:10.1046/j.1365-2125.1999.00036.x. PMC 2014389. PMID 10583021.
- ^ Forsberg MM, Huotari M, Savolainen J, Männistö PT (April 2005). "The role of physicochemical properties of entacapone and tolcapone on their efficacy during local intrastriatal administration". European Journal of Pharmaceutical Sciences. 24 (5): 503–11. doi:10.1016/j.ejps.2005.01.005. PMID 15784340.
- ^ Novaroli L, Bouchard Doulakas G, Reist M, Rolando B, Fruttero R, Gasco A, Carrupt PA (2006). "The Lipophilicity Behavior of Three Catechol-O-methyltransferase (COMT) Inhibitors and Simple Analogues". Helvetica Chimica Acta. 89 (1): 144–152. doi:10.1002/hlca.200690007.
- ^ a b Manikumar G, Jin C, Rehder KS (2008). "Convenient Synthesis of Tolcapone, a Selective Catechol‐O‐methyltransferase Inhibitor". Synthetic Communications. 38 (5): 810–815. doi:10.1080/00397910701821077. S2CID 94242335.
- ^ a b "2001 Pharmaceuticals: Restrictions in Use and Availability". World Health Organization. Archived from the original on June 12, 2011. Retrieved 2012-10-31.
- ^ "Tasmar tolcapone EPAR summary for the public" (PDF). European Medicine Agency. Retrieved 2012-10-31.
- ^ Press Office, U.S. Department of Health and Human Services. "FDA Talk Paper". New Warnings for Parkinson's Drug, Tasmar. Food and Drug Administration.
- ^ 톨카폰 고아 약물 상태
- ^ Reig N, Ventura S, Salvadó M, Gámez J, Insa R (2015). "SOM0226, a repositioned compound for the treatment of TTR amyloidosis". Orphanet J Rare Dis. 10 (Suppl 1): P9. doi:10.1186/1750-1172-10-s1-p9. PMC 4642128.
외부 링크
- "Tolcapone". Drug Information Portal. U.S. National Library of Medicine.




