피마게딘
Pimagedine| | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 2-아미노구아니딘 | |||
기타 이름
| |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐벨 | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.001.076 | ||
| 케그 | |||
펍켐 CID | |||
| 유니 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| CH6N4 | |||
| 어금질량 | 74.085 g/190 | ||
| 밀도 | 1.72 g/ml | ||
| 비등점 | 261°C(502°F, 534K) | ||
| 로그 P | −1.475 | ||
| 관련 화합물 | |||
관련 화합물 | 구아니딘 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
피마게딘(Pimagedine)은 아미노구아니아니딘으로도 알려져 있으며, 당뇨병성 신혈증을 치료하기 위한 조사 약물로서, 더 이상 약물로 개발되고 있지 않다.[1] 피마게딘은 직경 산화효소와 질소 산화효소의 억제제 역할을 한다. 3데옥시글루코손, 글리옥살, 메틸글리옥살, 관련 디카르보닐과 상호작용을 통해 고급 글리제(AGE)의 수준을 낮추는 작용을 한다. 이 반응성 종들은 이 응축 반응에 의해 반응성이 낮은 이질세포로 전환된다.
역사
피마게딘은 1986년 설립된 제약회사 알테온(현 신비스타 테라피틱스)에 의해 신장질환 치료제로 개발 중이었다.[2] 1987년 앨튼은 록펠러 대학으로부터 AGE 억제와 관련된 지적 재산권을 취득했다.[3] 1989년 알테온과 마리온 메렐 다우 주식회사(MMD)는 피마게딘을 위한 공동 개발 프로그램에 들어갔다.[4] 1992년 앨튼은 AGE 형성을 억제하기 위해 피마겐의 사용과 관련된 록펠러 대학교의 특허를 허가했다.[3] 1995년 회흐스트 AG(현 사노피-아벤티스)가 MMD를 인수하고 이후 알테온과의 협약을 해지하면서 알테온이 임상시험을 중단하게 되면서 일부 논란이 일기도 했다.[4] 1997년 알테온과 제넨텍은 제넨텍이 피마게딘 개발에 자금을 지원하고, 승인되면 판매권을 갖는다는 협업을 발표했다.[5]
1998년 3월 알테온은 재판의 외부안전감시위원회에서 치료군에서 부작용 위험이 높아진 것을 발견한 후, 극명하게 신혈증을 앓고 있는 비인슐린 의존성(타입 II) 당뇨병 환자의 피마게딘 3단계 실험을 중단하라는 권고를 받았다고 발표했다.[6] 1998년 11월 알테온은 말기 신질환 치료제로서 피마게딘에 대한 3단계 임상시험이 효과를 입증하는 데 실패했다고 발표했고, 이로 인해 대표적인 생명공학 분석가인 칼 고든은 "피마게딘이 아마도 다 된 것 같다"[7]고 말했다. 1999년 2월 제넨텍은 알테온과의 피마게딘 개발을 위한 협업을 종료했다.[8] 1999년 4월 알테온은 말기 신장질환 치료제로서 피마딘의 개발을 중단하겠다고 발표했지만, 신장질환이 현저한 제1형 당뇨병 환자의 지속적인 개발을 고려할 수도 있다.[9] 알테온의 2000, 2001, 2002년 연례 보고서는 피마게딘에 대한 어떠한 임상실험도 하지 않고 공동 개발 파트너를 찾고 있다고 밝혔다.[10][11][12] 알테온의 2003년 이후 연차보고서는 알테온이 피마딘을 위한 파트너를 찾고 있다는 사실을 언급하지 않았다.[13] 알테온은 다른 기업과 투자자들에게 관심을 갖기 위한 노력이 실패했고, 이는 피마딘을 마약으로 개발하려는 상업적 노력이 실제로 끝났음을 의미한다.[citation needed]
화학
합성
산업합성은 수용액에서 시아나미드와 하이드라진 사이의 반응을 이용한다.[14]
이 화합물은 또한 아연에 아연을 첨가한 니트로과니딘의 감소로부터 얻을 수 있다.[15]
특성.
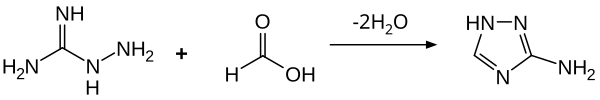
아미노구아니딘은 물과 에탄올에 용해되는 무색의 결정체를 형성한다. 유기산과 반응할 때 염분을 생성하는 것은 기본이다. 포름산을 사용하면 3-아미노-1,2,4-트리아졸을 주기 위해 사이클화가 일어난다.[14]
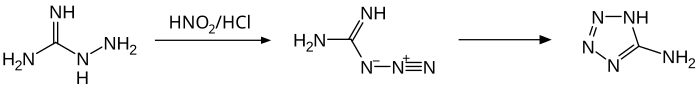
이 화합물은 산성의 매질에서 질산과 반응하여 중간 구아닐라자이드(guanylazide)를 통해 5-아미노테트라졸을 준다.[14] 중성 pH에서 반응은 테트라젠으로 이어진다.[16] 아세트산의 디아조트화효과는 1,3-di-(tetrazolyl)-triazene을 산출한다.[14]
참조
- ^ Thornalley, Paul J. (2003). "Use of aminoguanidine (Pimagedine) to prevent the formation of advanced glycation endproducts". Archives of Biochemistry and Biophysics. 419 (1): 31–40. doi:10.1016/j.abb.2003.08.013. PMID 14568006.
- ^ 신비스타 테라피틱스 주식회사 바이오센츄리. 2017년 8월 17일 회수
- ^ a b "Alteon 10-K For the fiscal year ended December 31, 1996". Alteon via SEC Edgar. March 27, 1997.
- ^ a b Harry Keen; JH Fukker; G Menzinger (July 19, 1997). "Early closure of European Pimagedine trial". The Lancet. PlumX Metrics. 350 (9072): 214–215. doi:10.1016/S0140-6736(97)26029-0. PMID 9250200. S2CID 54316555.
- ^ Barbara Marsh (January 3, 1998). "Biotech's New Watchword: Partnership". Los Angeles Times. Retrieved August 17, 2017.
- ^ "Alteon May Drop Pimagedine In NIDDM". The Pharma Letter. March 19, 1998. Retrieved August 17, 2017.
- ^ "Alteon Shares Plummet On Poor Pimagedine Test Results". San Diego Source. November 16, 1998. Retrieved August 17, 2017.
- ^ http://business.globe24h.com/sec/001/06/060000/0000060271.shtml[데드링크]
- ^ "Alteon's pimagedine fails primary endpoint". The Pharma Letter. April 12, 1999. Retrieved August 17, 2017.
- ^ https://www.sec.gov/Archives/edgar/data/878903/0000893220-00-000381.txt
- ^ https://www.sec.gov/Archives/edgar/data/878903/000089322001000240/0000893220-01-000240.txt
- ^ https://www.sec.gov/Archives/edgar/data/878903/000089322002000222/0000893220-02-000222.txt
- ^ https://www.sec.gov/Archives/edgar/data/878903/000089322003000272/0000893220-03-000272.txt
- ^ a b c d Güthner, Thomas; Mertschenk, Bernd; Schulz, Bernd (2006), "Guanidine and Derivatives", Ullmann's Encyclopedia of Industrial Chemistry, American Cancer Society, doi:10.1002/14356007.a12_545.pub2, ISBN 978-3-527-30673-2
- ^ Smith, G. B. L.; Anzelmi, Edward (1935-12-01). "Reduction of Nitroguanidine. III. Synthesis of Aminoguanidine1". Journal of the American Chemical Society. 57 (12): 2730. doi:10.1021/ja01315a510. ISSN 0002-7863.
- ^ Patinkin, Seymour H.; Horwitz, Jerome P.; Lieber, Eugene (1955-02-01). "The Structure of Tetracene1,2". Journal of the American Chemical Society. 77 (3): 562–567. doi:10.1021/ja01608a014. ISSN 0002-7863.