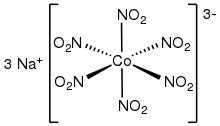
전이 금속 질산염 복합체
Transition metal nitrite complex질산염의 전이 금속 콤플렉스는 하나 이상의 질산염(NO2−) 리간드를 포함하는 조정 콤플렉스의 패밀리를 설명한다.[2]합성 유도체들은 학문적인 관심거리일 뿐이지만 금속 니트라이트 복합체는 질소 순환에 참여하는 여러 효소에서 발생한다.[3]
구조 및 본딩

본딩 모드
질산염 리간드, O-본드, N-본드, Biddate O,O-본드에는 3개의 연결 이소머가 일반적이다.이전의 두 이소머는 각각 N-니트리토와 O-니트리토라고 불리는 펜타민코발트(III) 시스템, 즉 [(NH3)5Co-NO2]2+와 [(NH3)5Co-OOOON]2+의 특징을 가지고 있다.이 두 가지 형태를 니트로와 니트리토라고도 한다.질산염 킬레이트(chelting nitrite)의 예는 다음과 같다 [Cu(bipy)(2ON2)]NO3 – "bipy"는 biddate igand2,2′bypyridyl이다.이 본딩 모드는 κ-NO라고도2O,O2 한다.
일렉트로닉 콤플렉스, O-본드, N-본드에서는 전자 계수("X-리간드")에 초점을 맞추어 1-전자 유사화("X-리간드")로 본다.오, 오-본드는 "L-X 리간드"로, 카르복실산염과 유사하다.
HSAB 이론과 관련하여, N 본딩 모드는 부드러운 금속 중심에서 더 흔하다.O와 O-bidentate 모드는 단단한 리간드로 루이스 산산염 금속 센터에서 발견된다.
운동학적으로 선호되는 O-본드 이소머 [(5NH3)Co-ONO]2+에서 [(NH3)5Co-로 변환NO2.2+ 철분포피린 복합체와의 반응에서 질산은 O-본드 이소머인 Fe(포름)를 준다.오노. 이 콤플렉스에 공여 리간드를 더하면 팔면체 저돌기 이소머로의 전환을 유도하게 되는데, 지금은 부드러운 루이스 산이다.N-bonded isomer, Fe(포름)에 nitrite isomerizes into the N-bonded isomer, Fe(포름)NO2(L)[4]
[(NH3)5Co-OON]2+에서 [(NH3)5Co-NO2]2+까지의 이소체화는 근육내 방식으로 진행된다.[5]
호몰레틱 콤플렉스
여러 개의 호몰레틱(한 종류의 리간드만 있는 복합체) 단지는 X선 결정학으로 특징지어진다.재고는 팔면복합체[M(NO2)]63− (M = Co, Rh)를 포함한다.[6][7]평방 평면의 동극성 복합체는 Pt(II)와 Pd(II)로도 알려져 있다.[M(NO2)](42−M = An, Cd)의 칼륨염은 O,O-bidentate nitrite igands 4개로 균질화 복합체가 특징이다.[8]
니트리토 복합체 합성
전통적으로 금속 니트리토 복합체는 아질산나트륨과 같은 알칼리 금속 아질산염을 이용한 염전측정법이나 리간드 치환반응에 의해 준비된다.중성 pH에서는 아질산염이 아닌 음이온으로 주로 존재한다.[9]
금속 니트로실 콤플렉스는 염기성 가수분해를 거치며 질산염 콤플렉스가 발생한다.이 패턴은 니트로프루사이드의 동작에서 나타난다.
- [Fe(CN)5NO]2− + 2 OH− → [Fe(CN)5NO2]4− + H2O
니트리토 복합체의 반응
일부 음이온질티토 복합체들은 니트로실 복합체를 주기 위해 산성으로 인한 탈산소를 겪는다.[10]
- [LnMNO2]− + H+ → [LnMNO] + OH−
어떤 경우에는 그 반응을 되돌릴 수 있다.따라서, 사람들은 전기영양 금속 니트로실스의 염기-수소 분해에 의해 니트리토 콤플렉스를 발생시킬 수 있다.
니트로 콤플렉스는 또한 알케인의 산화 작용을 촉진시킨다.[11]
바이오인유기화학
금속 니트리토 콤플렉스는 질소 사이클에서 두드러지게 나타나는데, 질산염에 이르는 암모니아와의 관계와 상호작용을 설명한다.질소는 종종 제한적인 영양소이기 때문에, 이 순환은 중요하다.아질산염 자체는 쉽게 리독스 반응을 일으키지 않지만, 금속 복합체는 리독스 반응을 일으킨다.[12]
질산화에 대한 산화
몰리브데넘 함유 효소 아질산염산화효소는 아질산염에서 질산염으로의 산화를 촉진한다.
- NO2−+ + HO2 → NO3− + 2 H
- NO-2 + HO2 → NO-3 + 2H+
축소
헤메 기반 효소 아질산염 환원효소는 아질산염을 암모니아로 변환시키는 촉매작용을 한다.주기는 철 니트로아이트 콤플렉스를 금속 니트로실 콤플렉스로 환원하는 것으로 시작한다.[3]
구리 함유 아질산염 환원효소(CuNIR)는 아질산염의 1전자를 산화질소로 환원시키는 촉매작용을 한다.제안된 메커니즘은 κ-NO-Cu2O,O2(I) 복합체의 양성을 수반한다.이 양성자는 N-O 결합의 분리를 유도하여 HO-Cu-ON 센터를 부여하는데, 이 센터에는 Cu(II)에 질소산화물 리간드 O-결합이 있다(이소니트로실).
참조
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Hitchman, Michael A.; Rowbottom, Graham L. (1982). "Transition Metal Nitrite Complexes". Coordination Chemistry Reviews. 42: 55–132. doi:10.1016/S0010-8545(00)80527-5.
- ^ a b Timmons, A. J.; Symes, M. D. (2015). "Converting between the Oxides of Nitrogen Using Metal–Ligand Coordination Complexes". Chemical Society Reviews. 44 (19): 6708–6722. doi:10.1039/C5CS00269A. PMID 26158348.
- ^ Ford, Peter C. (2010). "Reactions of NO and Nitrite with Heme Models and Proteins". Inorganic Chemistry. 49 (14): 6226–6239. doi:10.1021/ic902073z. PMID 20666383.
- ^ Jackson, W. Gregory; Lawrance, Geoffrey A.; Lay, Peter A.; Sargeson, Alan M. (1980). "Base-catalyzed nitrito to Nitro Linkage Isomerization of Cobalt(III), Rhodium(III), and Iridium(III) Pentaammine Complexes". Inorganic Chemistry. 19 (4): 904–910. doi:10.1021/ic50206a022.
- ^ Bianchi, R.; Gatti, C.; Adovasio, V.; Nardelli, M. (1996). "Theoretical and experimental (113 K) electron-density study of lithium bis(tetramethylammonium) hexanitrocobaltate(III)". Acta Crystallographica Section B Structural Science. 52 (3): 471–478. doi:10.1107/S0108768195016879.
- ^ Adovasio, V.; Lina, F.; Nardelli, M.; Pelizzi, G. (1994). "Lithium bis(tetramethyllammonium) Hexanitrocobaltate(III) at 113 and 293 K". Acta Crystallographica Section C Crystal Structure Communications. 50 (6): 871–874. doi:10.1107/S0108270193011588.
- ^ Ohba, S.; Matsumoto, F.; Takazawa, H.; Saito, Y. (1987). "Structures of cadmium nitrite dihydrate and cadmium dipotassium tetranitrite". Acta Crystallographica Section C Crystal Structure Communications. 43 (2): 191–194. doi:10.1107/S0108270187096471.
- ^ Harbulak, Edward P.; Albinak, Marvin J. (1966). "cis -Dinitrobis(ethylenediamine)cobalt(III) Nitrite and Nitrate". Inorganic Syntheses: 196–198. doi:10.1002/9780470132395.ch51. ISBN 9780470132395.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 449. ISBN 978-0-08-037941-8.
- ^ Fairlamb, Ian J. S. (2015). "Redox-Active NOx Ligands in Palladium-Mediated Processes". Angewandte Chemie International Edition. 54 (36): 10415–10427. doi:10.1002/anie.201411487. PMID 26211412.
- ^ . doi:10.1021/cr400518y.
{{cite journal}}: Cite 저널은 (도움말)을 요구한다.누락 또는 비어 있음(도움말)