전이금속염화복합체
Transition metal chloride complex
화학에서 전이 금속 염화 복합체는 하나 이상의 염화 리간드로 조정된 전이 금속으로 구성된 조정 복합체다. 단지의 등급은 광범위하다.[1]
본딩
할로겐화물은 조정화학에서 X형 리간드다. 그들은 둘 다 기부자와 기부자다. 염화물은 흔히 말단 리간드와 브리징 리간드로 발견된다. 할라이드 리간드는 약한 야전 리간드다. 에너지를 분할하는 작은 결정장 때문에 첫 번째 전환 시리즈의 호몰레틱 할로겐화 복합체는 모두 높은 스핀이다. [CrCl6]3−만 교환 불활성이다.
호몰레틱 금속 할로겐화 복합체는 여러 가지 스토이치측정법으로 알려져 있지만, 주된 것은 헥사할로메탈산염과 사할로메탈산염이다. 헥사할라이드는 팔면 조정 기하학을 채택한 반면 사면체들은 대개 사면체다. 정사각형 평면 테트라할라이드는 Pd(II), Pt(II), Au(III)로 알려져 있다. 2-과 3-조정을 가진 예는 Au(I), Cu(I), Ag(I)에서 흔히 볼 수식별은 Au(I), Cu(I), Ag(I)이다.
p 궤도 채우기π 때문에 전환 금속의 할로겐화 리간드는 π-아시드에 π-백본딩을 보강할 수 있다. 그들은 또한 시스 리간드를 힘들게 하는 것으로 알려져 있다.[2]
호몰레틱 콤플렉스
호몰레틱 복합체(염화물 리간드만 있는 복합체)는 흔히 흔히 볼 수 있는 시약이다. 거의 모든 예가 음이온이다.
1열
| 콤플렉스 | 색칠을 하다 | 전자 구성 | 구조화하다 | 기하학 | 평. |
|---|---|---|---|---|---|
| 티클4 | 무색의 | (t2g)0 | 사면의 | ||
| [Ti2Cl9]− | 백색의/무색의 | d0d0 | 얼굴 공유 생체면체 | Ti-Cl(단자) = 2.23 å, 2.45 (단자) (N(PCL3)2+ 소금)[3] | |
| [Ti2Cl9]3- | 주황색의 | (t2g)1(t2g)1 | 얼굴 공유 생체면체 | Ti-Ti = 3.22 å Ti-C1(단자) = 2.32-2.35 å, Ti-Cl(교량) = 2.42-2.55 å (NET4+)33 소금)[4] | |
| [Ti2Cl10]2− | 무색의 | d0d0 |  | 생체 해부학의 | |
| [Ti3Cl12]3- | 푸르른 | (t2g)1(t2g)1(t2g)1 | 얼굴 공유 3옥타헤드론 | Ti-Ti = 3.19, 3.10 å(단자) Ti-C1(단자), = 2.36 å(단자), Ti-Cl(교량) = 2.50 å (PPH4+)33 소금)[5] | |
| [TiCl6]2− | 노랑색의 | d0 |  | 팔면체의 | PPh4+ 소금 Ti-Cl = 2.33 å[6] |
| VCl4 | 적색의 | (t2g)1 | 사면의 | V1-Cl = 2.29 å | |
| V2Cl10 | 보랏빛의 | (t2g)0 |  | 가장자리 주름 생화학 | V1-Cl(브리지) = 2.48 å V1-Cl(단자) = 2.16-2.21 å[7] |
| [VCL6]2- | 적색의 | (t2g)1 |  | 팔면체의 | V1-Cl = 2.29 å[8] |
| [CrCl6]3− | ?? | (t2g)3 |  | 팔면체의[9] | |
| [Cr2Cl9]3− | 적색의 | (d3)2 | 얼굴 공유 생체면체 | Cr-Cl(단자) = 2.31 å, 2.42(단자) (ENH22+ 소금)[10] | |
| [MnCl4]2−[11] | 한동안 창백한 분홍색. | (eg)2(t2g)3 | 사면의 | Mn-Cl 본드 길이 = 2.3731-2.3830 å[12] | |
| [Mn2Cl6]2− | 황록색의 | (eg)2(t2g)3 |  | 쌍벽의 | Mn-Cl(단말) 결합 길이 = 2.24 å Mn-Cl(단말) 결합 길이 = 2.39 å[13] (PN+)2 소금 |
| [MnCl6]2− | 검붉은색 | (t2g)3(eg)1 |  | 팔면체의 | Mn-Cl 거리 = 2.28 å K+ 소금[14]) KPtCl을26 사용한 소금의 등축성 |
| [Mn3Cl12]6− | 분홍색의 | (t2g)3(eg)2 | 공동 3옥타헤드론 | Mn-Cl 거리 = -- å [(C(NH2)]3+6 소금[15] | |
| [FeCl4]2−[11] | 크림을 바르다 ((EtN4+)2 소금)[11] | (eg)3(t2g)3 | 사면의 | ||
| [FeCl4]− | (eg)2(t2g)3 | 사면의 | Fe-Cl 결합 길이 = 2.19 å[16] | ||
| [Fe2Cl6]2− | 엷은 노랑색 | (eg)2(t2g)3 |  | 쌍벽의 | Fe-Cl(단말) 결합 길이 = 2.24 å Fe-Cl(단말) 결합 길이 = 2.39 å[13] (PN+)2 소금 |
| [CoCl4]2−[11] | 파랑의[11] | (eg)4(t2g)3 | 사면의 | ||
| [Co2Cl6]2− | 파랑의[13] | (eg)4(t2g)3 |  | 쌍벽의 | Mn-Cl(단말) 결합 길이 = 2.24 å Co-Cl(단말) 결합 길이 = 2.35 å[13] (PN+)2 소금 |
| [NiCl4]2−[11] | 파랑의[11] | (eg)4(t2g)4 | 사면의 | Ni-Cl 결합 길이 = 2.28 å (EtN4+)2 소금[17] | |
| [Ni3Cl12]6− | 주황색의[18] | (t2g)6(eg)2 | 혼혈삼각형 | ((MeNH22+)28 소금 2Cl로− 소금을 곱하다 Ni-Cl 결합 길이 = 2.36-2.38 38[18] | |
| [CuCl4]2−[11] | 주황색의[19] 노랑(사면)[20] 녹색(평방 평면)[21] | (t2g)6(eg)3 | 납작해진 사면체 또는 정사각형 평면도[22][23] | Cu-Cl 결합 길이 = 2.24 å | |
| [Cu2Cl6]2− | 적색의 | [(t2g)6(eg)3]2 | 가장자리-모양 bis(제곱 평면)[24] | Cu-Cl(단자) = 2.24 å Cu-Cl(교량) = 2.31 å | |
| [ZnCl4]2− | 흰색/흰색/흰색 | d10 | 사면의 |
2열
2열 전이 금속의 일부 호몰레틱 복합체는 금속-금속 결합을 특징으로 한다.
| 콤플렉스 | 색칠을 하다 | 전자 구성 | 구조화하다 | 기하학 | 평. |
|---|---|---|---|---|---|
| [ZrCl6]2− | 노랑색의 | d0 |  | 팔면체의 | Zr-Cl 거리 = 2.460 å (MeN4+)2 소금[26] |
| [Zr2Cl10]2− | 무색의 | (d0)2 |  | 가장자리 안쪽의 생물학적 방면 | Zr-Cl = 2.36 å(단자), 2.43 å(브리지) N(PCL3)2+ 소금[3] |
| Nb2Cl10 | 노랑색의 | (d0)2 |  | 가장자리 공유 생물역할 [NbCl210] | 3.99 Å[27] |
| [NbCl6]− | 노랑색의 | d0 |  | 팔면체의 | Nb-Cl = 2.34 å N(PCL3)2+ 소금[3] |
| [Nb6Cl18]2− | 검게 하다 | (d2)(4d3)2 (14 군집 전자) | 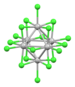 | 군집 Nb---Nb 결합 | Nb-Cl = 2.92 å (K+)2 소금[28] |
| 모클6 | 검게 하다 | d0 |  | 팔면체 | Mo-Cl = 2.28 -2.31 å[7] |
| [MoCl6]2− | 노랑색의 | (t2g)2 |  | 팔면체 | Mo-Cl = 2.37, 2.38, 2.27 å[29] |
| [MoCl6]3− | 분홍색의 | (t2g)3 |  | 팔면체의 | |
| [Mo2Cl8]4− | 자줏빛의[30] | 2(d4) |  | 모모 사중결합 | |
| [Mo2Cl9]3− | 2(d3) | 안면강화생물 | Mo-Mo (트리플) 결합 길이 = 2.65 å Mo-Cl (단말) 결합 길이 = 2.38 38 Mo-Cl (브리지) 결합 길이 = 2.49 å[31][32] | ||
| 모클210 | 푸르른 | (d1)2 |  | 엣지 공유 바이오크타헤드라[33] | |
| [Mo2Cl10]2− | (d2)2 |  | 엣지 공유 바이오크타헤드라[34] | ||
| [Mo5Cl13]2− | 갈색의[30] | Ddddd22223. |  | 불완전한 팔면체[35] | |
| [Mo6Cl14]2− | 노랑색의 | d4 |  | 팔면 성단 | (4-HOPYH+)2 소금[36] |
| [TcCl6]2− | 노랑색의 | (t2g)3 |  | 팔면체 | Tc-Cl = As(CH65)4+ 염의[37] 경우 2.35 å |
| [Tc2Cl8]2− | 푸르른 | (t2g)4 |  | Tc-Tc 쿼드러플 본드 | NBu4+[38] 소금의 경우 Tc-Tc = 2.16, Tc-Cl = 2.34 å |
| [RuCl6]2− | 갈색의 | (t2g)4 |  | 팔면체의 | (etPPh3+)2 소금[39] |
| [Ru2Cl9]3− | 적색의 | [(t2g)5]2 | 공동의 생물학적 방부. | Ru-Ru 본드 길이 = 2.71 å; Ru-Cl(단자) = 2.35 å, Ru-Cl(브리지) = 2.36 å ((EtN4)+3 소금[40] | |
| [Ru3Cl12]4− | 푸르른 | (d5)2(d6) | 동면 삼면체 | Ru-Ru 본드 길이 = 2.86 å Ru-Cl 본드 길이 = 2.37-2.39 å (EtN4+)(2HO73+)2 소금[41] | |
| [RhCl6]3− | 적색의 | (t2g)6 |  | 팔면체의 | HN2+(CHCHNH223+)2 소금)[42] |
| [Rh2Cl9]3− | 적갈색의 | (t2g)6 | 팔면체의 | Rh-Cl(단자) = 2.30 å, Rh-Cl(단자) = 2.40 å ((MecHPh32)+3 소금)[31] | |
| [PdCl4]2− | 갈색의 | d8 | 평방 평면 | ||
| [Pd2Cl6]2−[43] | 적색(EtN4+)2 소금 | d8 | 평방 평면 | ||
| [Pd3Cl8]2−[44] | 오렌지 갈색(BuN4+)2 소금 | d8 | 평방 평면 | ||
| [PdCl6]2− | 갈색의 | d6 |  | 팔면체의 | Pd(IV) |
| [Pd6Cl12] | 황갈색의 | d8 |  | 평방[45] 평면 | |
| [AgCl2]− | 흰색/흰색/흰색 | d10 | 일직선의 | [K(2.2.2-crypt)]+[46]의 소금 | |
| [CdCl4]2− | 흰색/흰색/흰색 | d10 | 사면의 | EtN4+ 소금, Cd-Cl 거리는 2.43 å이다[25]. | |
| [Cd2Cl6]2− | 흰색/흰색/흰색 | d10 |  | 가장자리 주름진 비트라헤드론 | (CN(634-CHN54)33+ 소금[47] |
| [Cd3Cl12]6− | 흰색/흰색/흰색 | d10 | 팔면체(중앙 Cd) 펜타코르다인(단말 CD) 공동효소 삼옥타헤드랄 | (CN(634-CHN54)33+ 소금[47] (3,8-다이암모늄-6-페닐페난티딘3+)2[48] | |
| [Cd6Cl19]7− | 흰색/흰색/흰색 | d10 |  | 팔면체 | 4,4'-(C6H3(2-Et)NH3+)2 소금[49] |
3열
| 콤플렉스 | 색칠을 하다 | 전자 구성 | 구조화하다 | 기하학 | 평. |
|---|---|---|---|---|---|
| [HfCl6]2− | 백색의 | d0 |  | 팔면체의 | Hf-Cl 거리 = 2.448 A ((MeN4+)2 소금)[26] |
| [Hf2Cl10]2− | 무색의/흰색의 | d0 |  | 가장자리 안쪽의 생물학적[50] 방면 | |
| [Hf2Cl9]− | 무색의/흰색의 | (d0)2 | 안면강화생물[51] | ||
| [TaCl5] | 백색의 | d0 |  | 가장자리 안쪽의 생물학적 방면 | |
| [TaCl6]− | 백색의/무색의 | d0 |  | 팔면체의 | Ta-Cl = 2.34 å (N(PCL3)2+ 소금)[3] |
| [Ta6Cl18]2- | 푸르른 | d0 |  | 팔면체의 | 타타 = 2.34 2 (H염+2 육수화물[52] |
| WCl6 | 파랑의 | d0 |  | 팔면체의 | 2.24–2.26 Å[53] |
| [WCl6]2− | (t2g)2 |  | 팔면체의 | W-Cl 거리 범위는 2.34 ~ 2.37 å (PPH4+ 소금)[54] | |
| [WCl6]− | (t2g)1 |  | 팔면체의 | W-Cl 거리 = 2.32 å (ETN4+ 소금)[55] | |
| W2Cl10 | 검게[56] 하다 | (t2g1)2 |  | 생체 해부학의 | W-W 거리 = 3.814 å[57] |
| [W2Cl8]4− | 파랑의 | 2(d4) |  | W-W 4중 결합 | dW-W = 2.259 å [Na(tmeda)]+4 소금[58] |
| [W2Cl9]2− | d3d2 | 얼굴 공유 생체 해부 | W-W 거리 = 2.54 å W-Cl(단자) = 2.36 å, W-Cl(교량) = 2.45 å ((PN+)2 소금)[59] | ||
| [W2Cl9]3− | d3d3 | 팔면체의 | W-Cl 거리 = 2.32 å (ETN4+ 소금)[59] | ||
| [W3Cl13]3− | d3,d3,d4 |  | [W3(μ3-Cl)(μ-Cl)3Cl9]3- | W-W 거리 = 2.84 å[60] | |
| [W3Cl13]2− | d3,d4,d4 |  | [W3(μ3-Cl)(μ-Cl)3Cl9]2-[60] | W-W 거리 = 2.78 å[60] | |
| [W6Cl14]2- | 노랑색의[61] | (d4)6 |  | MoCl을612 보다. | |
| [ReCl6]− | 적갈색의 | (t2g)6 |  | 팔면체의 | Re-Cl 거리 = 2.24-2.31 å (PPH4+ 소금)[62] |
| [ReCl6] | (t2g)1 |  | 팔면체의 | Re-Cl 거리 = 226.3(6) å[7] | |
| [ReCl6]2− | 푸르른 | (t2g)5 |  | 팔면체의 | Re-Cl 거리 = 2.35-2.38 å ((PN+)2 소금)[63] |
| [Re2Cl9]2− | (t2g)5 | 얼굴 공유 생체 해부 | 재장전 거리 = 2.48 å Re-Cl 거리 = 2.42 å (교량), 2.33 å (단말) ((EtN4+)2 소금)[64] | ||
| [Re2Cl9]− | (t2g)5 | 얼굴 공유 생체 해부 | 다시 거리 = 2.70 70 Re-Cl 거리 = 2.41 (교량), 2.28 å (단말) (BuN4+ 소금)[64] | ||
| [OsCl6]− | 암녹색 | (t2g)5 |  | 팔면체의 | dOs-Cl = EtN4+[65] 및 PhP4+[66] 염의 경우 2.30 å |
| [OsCl6]2− | 황갈색의 | (t2g)4 |  | 팔면체의[66] | Os-Cl 거리 2.33 å |
| [Os2Cl8]2− | 푸르른 | (d5)2 |  | 사각 반감 | dOs-Os = 2.182 å, dOs-Cl = 2.32 å (BuN4+)2 소금[67] |
| [Os2Cl10]2− | 푸르른 | (d4)2 |  | 팔면체의 | dOs-Cl(terminal) = 2.30 å dOs-Cl(bridging) = 2.42 å (EtN4+)2 소금[65] |
| [IrCl6]3− | 적색의 | (t2g)6 |  | 팔면체의 | Ir-Cl = 2.36 å[68] |
| [IrCl6]2− | 갈색의 | (t2g)5 |  | 팔면체의 | Ir-Cl = 2.33 å[69] |
| [Ir2Cl9]3− | 갈색의 | (t2g)6 | 쌍옥타이드의[70] | ||
| [PtCl4]2− | 분홍색의 | d8 | 평방 평면 | ||
| [PtCl6]2− | 노랑색의 | d6 |  | 팔면체의 | Pt-Cl 거리 = 2.32 å EtN4+ 소금, ((MeN4+)2 소금)[26] |
| [Pt2Cl9]− | 적색(BuN4+ 소금) | (t2g)6 | 팔면체의 | Pt-Clt 및 Pt-Clbridge = 2.25, 2.38 å[70] | |
| [Pt6Cl12] | 황갈색의 | d8 |  | 평방 평면 | Pt-Cl = 2.31[71] |
| [AuCl2]− | 흰색/흰색/흰색 | d10 | 일직선의 | Au-Cl 거리 2.28 å 네트4+ 소금[72] | |
| [AuCl4]− | 노랑색의 | d8 | 평방 평면 | Au-Cl 거리 2.26 å NBU4+ 소금[73] | |
| [HgCl4]2− | 흰색/흰색/흰색 | d10 | 사면의 | Hg-Cl 거리는 2.46 å이다[25]. ETN4+ 소금 | |
| [Hg2Cl6]2− | 흰색/흰색/흰색 | d10 |  | 가장자리에 있는 쌍두마감지 | Hg-Cl 거리는 2.46 å이다[74]. BUN4+ 소금 |
이질화 복합체
염화물이 함유된 이질화 복합체가 수두룩하다. 대부분의 수분이 함유된 금속 할로겐은 이 등급에 속한다. 헥삼민코발트(III)염화나 시스플라틴(cis-Pt(NH3)2Cl2)은 금속암민염화염소의 대표적인 예다.
하이드레이트

아래 표에 나타난 바와 같이 많은 금속염소화물의 수산화물은 분자 복합체다.[75][76] 이 화합물들은 종종 금속 염화물이 전이되는 중요한 상업적 원천이다. 몇몇 수산화 금속 염화물은 분자가 아니므로 이 표에는 포함되지 않는다. 예를 들어 망간의 일수화().II) 염화물, 니켈().II) 염화물, 구리()II) 염화물, 철().II) 염화물 및 코발트().II) 염화물은 조정 중합체다.
| 공식: 수분이 함유된 금속 할로겐화물 | 조정 금속의 구면 |
|---|---|
| TiCl3(H2O)6 | Trans-[TiCl2(HO2)]4+[77] |
| VCl3(H2O)6 | 트랜스[VCL2(HO2)]4+[77] |
| CrCl3(H2O)6 | Trans-[CrCl2(HO2)]4+ |
| CrCl3(H2O)6 | [CrCl(H2O)5]2+ |
| CrCl2(H2O)4 | Trans-[CrCl2(HO2)]4 |
| CrCl3(H2O)6 | [Cr(H2O)6]3+[78] |
| MnCl2(H2O)6 | Trans-[MnCl2(HO2)]4 |
| MnCl2(H2O)4 | cis-[MnCl2(H2O)4][79] |
| FeCl2(H2O)6 | Trans-[FeCl2(HO2)]4 |
| FeCl2(H2O)4 | Trans-[FeCl2(HO2)]4 |
| FeCl3(H2O)6 | 염화 철의 네 가지 하이드레이트 중 하나,[80] |
| FeCl3(H2O)2.5 | cis-[FeCl2(H2O)4]+[81] |
| CoCl2(H2O)6 | Trans-[CoCl2(HO2)]4 |
| CoCl2(H2O)4 | cis-[CoCl2(H2O)4] |
| 니클2(HO2)6 | Trans-[NiCl2(HO2)]4 |
| 니클2(HO2)4 | cis-[NiCl2(H2O)4] |
에테르 콤플렉스
금속염소화물은 에테르, 특히 테트라하이드로푸란과[82] 킬레이트 에테르를 가지고 유도체를 형성한다. 이 화합물들은 용해성과 무수성이기 때문에 종종 중요한 시약이다.
| 공식: 금속-염화물-이허 복합체 | 조정 금속의 구면 | 색을 칠하다 |
|---|---|---|
| TiCl4(thf)2 | 티오클24 | 노랑색의 |
| TiCl3(thf)3 | 티오클33 | 파랑의 |
| [TiCl3(thf)2]2 | 티오클24 | 푸르른[84] |
| ZrCl4(thf)2 | 즈로클24 | 백색의 |
| HfCl4(thf)2 | HfO2Cl4 | 백색의 |
| VCl3(thf)3 | VO3Cl3 | 분홍색의 |
| [VCl3(thf)2]2 | VO2Cl4 | 적색의[85] |
| NbCl4(thf)2 | NBOCl24 | 노랑색의 |
| Ta3Cl9(thf)4 | TaOCl24 및 TaOCl5[86] | |
| CrCl3(thf)3 | 크로클33 | 분홍색의 |
| MoCl4(thf)2 | 모오클24 | 분홍색의[87] |
| MoCl3(thf)3 | 모오클33 | 적색의[87] |
| MnCl3(thf)3 | 엠노클33 | 갈색의[88] |
| TcCl4(thf)2 | TcO2Cl4 | 노랑색의[89] |
| ReCl4(thf)2 | 레오클24 | 푸르른[90] |
| Fe4Cl8(thf)6 | FeO2Cl3, FeO2Cl4 | 갈색의[91] |
| Co4Cl8(thf)6 | CoO2Cl3, CoO2Cl4 | 파랑의[92] |
| 니클2(디메톡시네탄)2 | 니클로24 | 노랑색의[93] |
| [Cu2Cl4(thf)3]n | CuO2Cl4, CuOCl4 | 주황색의[94] |
참조
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ J. F. Hartwig (2009). "4: Covalent (X-Type) Ligands Bound Through Metal-Heteroatom Bonds". Organotransition Metal Chemistry. ISBN 978-1-891389-53-5.
- ^ a b c d Rivard, Eric; McWilliams, Andrew R.; Lough, Alan J.; Manners, Ian (2002). "Bis(trichlorophosphine)iminium salts, [Cl3P=N=PCl3]+, with transition metal halide counter-ions". Acta Crystallographica Section C. 58 (9): i114–i118. doi:10.1107/S0108270102012532. PMID 12205363.
- ^ Castro, Stephanie L.; Streib, William E.; Huffmann, John C.; Christou, George (1996). "A mixed-valence (TiIIITiIV) Carboxylate Complex: Crystal Structures and Properties of [Ti2OCl3(O2CPh)2(THF)3] and [NEt4]3[Ti2Cl9]". Chemical Communications (18): 2177. doi:10.1039/CC9960002177.
- ^ Chen, Linfeng; Cotton, F. Albert (1998). "Synthesis, Reactivity, and X-ray Structures of Face-Sharing Ti(III) Complexes; the New Trinuclear Ion, [Ti3Cl12]3−". Polyhedron. 17 (21): 3727–3734. doi:10.1016/S0277-5387(98)00171-5.
- ^ Chen, Linfeng; Cotton, F. A. (1998). "Partial Hydrolysis of Ti(III) and Ti(IV) Chlorides in the Presence of [PPh4]Cl". Inorganica Chimica Acta. 267 (2): 271–279. doi:10.1016/S0020-1693(97)05766-6.
- ^ a b c Tamadon, Farhad; Seppelt, K. (2012). "The Elusive Halides VCl5, MoCl6, and ReCl6". Angewandte Chemie International Edition. 52 (2): 767–769. doi:10.1002/anie.201207552. PMID 23172658.
- ^ Hayton, Trevor W.; Patrick, Brian O.; Legzdins, Peter (2004). "New Details Concerning the Reactions of Nitric Oxide with Vanadium Tetrachloride". Inorganic Chemistry. 43 (22): 7227–7233. doi:10.1021/ic0491534. PMID 15500362.
- ^ O. S. Filipenko, D. D. Makitova, O. N. Krasochka, V. I. Ponomarev, L. O. Atovmyan (1987). Koord. Khim. 13: 669.
{{cite journal}}: 누락 또는 비어 있음title=(도움말)CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Dyer, Philip W.; Gibson, Vernon C.; Jeffery, John C. (1995). "Unexpected Synthesis of a Binuclear Chromium(III) salt Exhibiting NH…Cl Hydrogen-Bonding Interactions". Polyhedron. 14 (20–21): 3095–3098. doi:10.1016/0277-5387(95)00089-B.
- ^ a b c d e f g h Gill, N. S.; Taylor, F. B. (1967). "Tetrahalo Complexes of Dipositive Metals in the First Transition Series". Inorganic Syntheses. 9: 136–142. doi:10.1002/9780470132401.ch37. ISBN 9780470132401.
- ^ Chang, Jui-Cheng; Ho, Wen-Yueh; Sun, I-Wen; Chou, Yu-Kai; Hsieh, Hsin-Hsiu; Wu, Tzi-Yi (2011). "Synthesis and Properties of New Tetrachlorocobaltate (II) and Tetrachloromanganate (II) Anion Salts with Dicationic Counterions". Polyhedron. 30 (3): 497–507. doi:10.1016/j.poly.2010.11.009.
- ^ a b c d Sun, Jui-Sui; Zhao, Hanhua; Ouyang, Xiang; Clérac, Rodolphe; Smith, Jennifer A.; Clemente-Juan, Juan M.; Gómez-Garcia, Carlos; Coronado, Eugenio; Dunbar, Kim R. (1999). "Structures, Magnetic Properties, and Reactivity Studies of Salts Containing the Dinuclear Anion [M2Cl6]2-(M = Mn, Fe, Co)". Inorganic Chemistry. 38 (25): 5841–5855. doi:10.1021/ic990525w.
- ^ Moews, P. C. (1966). "The Crystal Structure, Visible, and Ultraviolet Spectra of Potassium Hexachloromanganate(IV)". Inorganic Chemistry. 5: 5–8. doi:10.1021/ic50035a002.
- ^ Sen, Abhijit; Swain, Diptikanta; Guru Row, Tayur N.; Sundaresan, A. (2019). "Unprecedented 30 K Hysteresis Across Switchable Dielectric and Magnetic Properties in a Bright Luminescent Organic–Inorganic Halide (CH6N3)2MnCl4" (PDF). Journal of Materials Chemistry C. 7 (16): 4838–4845. doi:10.1039/C9TC00663J.
- ^ Lutz, Martin; Huang, Yuxing; Moret, Marc-Etienne; Klein Gebbink, Robertus J. M. (2014). "Phase Transitions and Twinned Low-Temperature Structures of Tetraethylammonium Tetrachloridoferrate(III)". Acta Crystallographica Section C. 70 (5): 470–476. doi:10.1107/S2053229614007955. hdl:1874/307900. PMID 24816016.
- ^ Stucky, G. D.; Folkers, J. B.; Kistenmacher, T. J. (1967). "The Crystal and Molecular Structure of Tetraethylammonium Tetrachloronickelate(II)". Acta Crystallographica. 23 (6): 1064–1070. doi:10.1107/S0365110X67004268.
- ^ a b Gerdes, Allison; Bond, Marcus R. (2009). "Octakis(dimethylammonium) Hexa-μ2-chlorido-Hexachloridotrinickelate(II) Dichloride: A Linear Trinickel Complex with Asymmetric Bridging". Acta Crystallographica Section C. 65 (10): m398–m400. doi:10.1107/S0108270109036853. PMID 19805875.
- ^ Mahoui, A.; Lapasset, J.; Moret, J.; Saint Grégoire, P. (1996). "Tetraethylammonium Tetramethylammonium Tetrachlorocuprate(II), [(C2H5)4N][(CH3)4N][CuCl4]". Acta Crystallographica Section C. 52 (11): 2674–2676. doi:10.1107/S0108270196009031.
- ^ Guillermo Mínguez Espallargas, Lee Brammer, Jacco van de Streek, Kenneth Shankland, Alastair J. Florence, and Harry Adams (2006). "Reversible Extrusion and Uptake of HCl Molecules by Crystalline Solids Involving Coordination Bond Cleavage and Formation". J. Am. Chem. Soc. 128 (30): 9584–9585. doi:10.1021/ja0625733. PMID 16866484.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Kelley, A.; Nalla, S.; Bond, M. R. (2015). "The Square-Planar to Flattened-Tetrahedral CuX42- (X = Cl, Br) Structural Phase Transition in 1,2,6-Trimethylpyridinium salts". Acta Crystallographica Section B. 71 (Pt 1): 48–60. doi:10.1107/S205252061402664X. PMID 25643715.
- ^ Halcrow, Malcolm A. (2013). "Jahn–Teller Distortions in Transition Metal Compounds, and Their Importance in Functional Molecular and Inorganic Materials" (PDF). Chemical Society Reviews. 42 (4): 1784–1795. doi:10.1039/C2CS35253B. PMID 22968285.
- ^ Reinen, Dirk (2014). "A New Approach to Treating Vibronic Coupling Under Stress—The Strain-Induced Enhancement or Suppression of Jahn–Teller Distortions in Tetrahedral CuIICl4-Complexes, and the Transition to Octahedral Structures". Coordination Chemistry Reviews. 272: 30–47. doi:10.1016/j.ccr.2014.03.004.
- ^ Willett, Roger D.; Butcher, Robert E.; Landee, Christopher P.; Twamley, Brendan (2006). "Two Halide Exchange in Copper(II) Halide Dimers: (4,4′-Bipyridinium)Cu2Cl6−x BRX". Polyhedron. 25 (10): 2093–2100. doi:10.1016/j.poly.2006.01.005.
- ^ a b c Mahoui, A.; Lapasset, J.; Moret, J.; Saint Grégoire, P. (1996). "Bis(tetraethylammonium) Tetrachlorometallates, [(C2H5)4N]2[MCl4], where M = Hg, Cd, Zn". Acta Crystallographica Section C. 52 (11): 2671–2674. doi:10.1107/S010827019600666X.
- ^ a b c Autillo, Matthieu; Wilson, Richard E. (2017). "Phase Transitions in Tetramethylammonium Hexachlorometalate Compounds (TMA)2MCl6 (M = U, Np, Pt, Sn, Hf, Zr)". European Journal of Inorganic Chemistry. 2017 (41): 4834–4839. doi:10.1002/ejic.201700764.
- ^ Cotton, F.A., P. A. Kibala, M. Matusz and R. B. W. Sandor (1991). "Structure of the Second Polymorph of Niobium Pentachloride". Acta Crystallogr. C. 47 (11): 2435–2437. doi:10.1107/S0108270191000239.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Simon, Arndt; von Schnering, Hans-Georg; Schäfer, Harald (1968). "Beiträge zur Chemie der Elemente Niob und Tantal. LXIX K4Nb6Cl18 Darstellung, Eigenschaften und Struktur". Zeitschrift für anorganische und allgemeine Chemie. 361 (5–6): 235–248. doi:10.1002/zaac.19683610503.
- ^ Rabe, Susanne; Bubenheim, Wilfried; Müller, Ulrich (2004). "Crystal Structures of Acetonitrile Solvates of Bis(tetraphenylphosphonium) Tetrachlorooxovanadate(IV), Hexachlorostannate(IV) and -Molybdate(IV), [P(C6H5)4]2[VOCl4] · 4CH3CN, [P(C6H5)4]2[MCl6]·4CH3CN (M = Sn, Mo)". Zeitschrift für Kristallographie - New Crystal Structures. 219 (2): 101–105. doi:10.1524/ncrs.2004.219.2.101. S2CID 201122319.
- ^ a b Brignole, A. B.; Cotton, F. A.; Dori, Z. (1972). Rhenium and Molybdenum Compounds Containing Quadruple Bonds. Inorg. Synth. Inorganic Syntheses. Vol. 13. pp. 81–89. doi:10.1002/9780470132449.ch15. ISBN 9780470132449.
- ^ a b Cotton, F.A; Ucko, David A. (1972). "The Structure of Trimethylphenylammonium Nonachlorodirhodate(III) and a Survey of Metal-Metal Interactions in Confacial Bioctahedra". Inorganica Chimica Acta. 6: 161–172. doi:10.1016/S0020-1693(00)91778-X.
- ^ R. A. D. Wentworth, R. Saillant, R. B. Jackson, W. E. Streib, K. Folting (1971). "Crystal structures of Cs3Cr2Br9, Cs3Mo2Cl9, and Cs3Mo2Br9". Inorg. Chem. 10 (7): 1453–1457. doi:10.1021/ic50101a027.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Beck, J.; Wolf, F. (1997). "Three New Polymorphic Forms of Molybdenum Pentachloride". Acta Crystallogr. B53 (6): 895–903. doi:10.1107/S0108768197008331.
- ^ Hey, E.; Weller, F.; Dehnicke, K. (1984). "Synthese und Kristallstruktur von (PPh4)2[Mo2Cl10]". Zeitschrift für anorganische und allgemeine Chemie. 508: 86–92. doi:10.1002/zaac.19845080113.
- ^ Ahmed, Ejaz; Ruck, Michael (2011). "Chemistry of Polynuclear Transition-Metal Complexes in Ionic Liquids". Dalton Transactions. 40 (37): 9347–57. doi:10.1039/c1dt10829h. PMID 21743925.
- ^ Kei Inumaru, Takashi Kikudome, Hiroshi Fukuoka, Shoji Yamanaka (2008). "Reversible Emergence of a Self-Assembled Layered Structure From Three-Dimensional Isotropic Ionic Crystal of a Cluster Compound (4-HNC5H4OH)2Mo6Cl14 Driven By Absorption of Water and Alcohols". J. Am. Chem. Soc. 130 (31): 10038–10039. doi:10.1021/ja802752y. PMID 18613684.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Baldas, J.; Bonnyman, J.; Samuels, D. L.; Williams, G. A. (1984). "Structure Studies of Technetium Complexes. VII. Structure of Tetraphenylarsonium Hexachlorotechnetate(IV), [As(C6H5)4]2[TcCl6]". Acta Crystallographica Section C Crystal Structure Communications. 40 (8): 1343–1346. doi:10.1107/S0108270184007903.
- ^ Poineau, Frederic; Johnstone, Erik V.; Forster, Paul M.; Ma, Longzou; Sattelberger, Alfred P.; Czerwinski, Kenneth R. (2012). "Probing the Presence of Multiple Metal–Metal Bonds in Technetium Chlorides by X-ray Absorption Spectroscopy: Implications for Synthetic Chemistry". Inorganic Chemistry. 51 (17): 9563–9570. doi:10.1021/ic3014859. PMID 22906536.
- ^ Sharutin, V. V.; Sharutina, O. K.; Senchurin, V. S.; Andreev, P. V. (2018). "Synthesis and Structure of Ruthenium Complexes [Ph
3PR]+2[RuCl
6]2− (R = C
2H
5, CH=CHCH
3, CH
2CH=CHCH
3, CH
2OCH
3), and [Ph
3PCH
2CH CHCH
2PPh
3]2+2[Ru
2Cl
10O]4− · 4H2O". Russian Journal of Inorganic Chemistry. 63 (9): 1178–1185. doi:10.1134/S0036023618090188. S2CID 105746627. - ^ I. A. Efimenko, T. A. Balakaeva, A. P. Kurbakova, A. S. Kanishcheva, A. V. Chuvaev, V. M. Stepanovich, Yu. N. Mikhailov (1992). Zh. Neorg. Khim. (Russ. J. Inorg. Chem.). 37: 1312.
{{cite journal}}: 누락 또는 비어 있음title=(도움말)CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Bino, Avi; Cotton, F. Albert (1980). "A Linear, Trinuclear, Mixed-Valence Chloro Complex of Ruthenium, [Ru3Cl12]4-". Journal of the American Chemical Society. 102 (2): 608–611. doi:10.1021/ja00522a027.
- ^ Frank, Walter; Reiß, Guido J.; Kleinwächter, Ingo (1996). "Spezielle Alkylammoniumhexachlorometallate. I. Kristallisationsverhalten und Kristallstruktur von Diethylentriammoniumhexachlororhodat, [H3N(CH2)2NH2(CH2)2NH3][RhCl6]". Zeitschrift für anorganische und allgemeine Chemie. 622 (4): 729–733. doi:10.1002/zaac.19966220428.
- ^ Schwarz, Simon; Strähle, Joachim; Weisser, Ulrike (2002). "Synthese und Struktur der Komplexe [(n-Bu)4N]2[{(THF)Cl4Re≡N}2PdCl2], [Ph4P]2[(THF)Cl4Re≡N-Pd Cl(μ-Cl)]2 und [(n-Bu)4N]2[Pd3Cl8]". Zeitschrift für anorganische und allgemeine Chemie. 628 (11): 2495–2499. doi:10.1002/1521-3749(200211)628:11<2495::AID-ZAAC2495>3.0.CO;2-G.
- ^ Fábry, Jan; Dušek, Michal; Fejfarová, Karla; Krupková, Radmila; Vaněk, Přemysl; Němec, Ivan (2004). "Two Phases of Bis(tetraethylammonium) Di-μ-chloro-bis[dichloropalladium(II)]". Acta Crystallographica Section C Crystal Structure Communications. 60 (9): m426–m430. doi:10.1107/S0108270104016725. PMID 15345822.
- ^ Dell'Amico, Daniela Belli; Calderazzo, Fausto; Marchetti, Fabio; Ramello, Stefano (1996). "Molecular Structure of[Pd6Cl12] in Single Crystals Chemically Grown at Room Temperature". Angewandte Chemie International Edition in English. 35 (12): 1331–1333. doi:10.1002/anie.199613311.
- ^ Helgesson, Goeran; Jagner, Susan (1991). "Halogenoargentate(I) with unusual coordination geometries. Synthesis and Structure of Potassium-crypt Salts of Chloro-, Bromo- and Iodoargentates(I), Including the First Example of a Two-Coordinated Chloroargentate(I) in the Solid State". Inorganic Chemistry. 30 (11): 2574–2577. doi:10.1021/ic00011a024.
- ^ a b Hao, Pengfei; Guo, Chunyu; Shen, Junju; Fu, Yunlong (2019). "A Novel Photochromic Hybrid Containing Trinuclear [Cd3Cl12]6− Clusters and Protonated Tripyridyl-Triazines". Dalton Transactions. 48 (44): 16497–16501. doi:10.1039/C9DT03494C. PMID 31559400.
- ^ Costin-Hogan, Christina E.; Chen, Chun-Long; Hughes, Emma; Pickett, Austin; Valencia, Richard; Rath, Nigam P.; Beatty, Alicia M. (2008). ""Reverse" engineering: Toward 0-D Cadmium Halide clusters". CrystEngComm. 10 (12): 1910. doi:10.1039/b812504j.
- ^ Chen, Chun-Long; Beatty, Alicia M. (2007). "From Crystal Engineering to Cluster Engineering: How to Transform Cadmium Chloride from 2-D to 0-D". Chemical Communications (1): 76–78. doi:10.1039/B613761J. PMID 17279266.
- ^ Neumüller, Bernhard; Dehnicke, Kurt (2004). "Die Kristallstrukturen von (Ph4P)2[HfCl6]2CH2Cl2 und (Ph4P)2[Hf2Cl10]CH2Cl2". Zeitschrift für anorganische und allgemeine Chemie. 630 (15): 2576–2578. doi:10.1002/zaac.200400370.
- ^ Dötterl, Matthias; Haas, Isabelle; Alt, Helmut G. (2011). "Solubility Behaviour of TiCl4, ZrCl4, and HfCl4 in Chloroaluminate Ionic Liquids". Zeitschrift für anorganische und allgemeine Chemie. 637 (11): 1502–1506. doi:10.1002/zaac.201100244.
- ^ Jacobson, Robert A.; Thaxton, Charles B. (1971). "Crystal structure of H2[Ta6Cl18].6H2O". Inorganic Chemistry. 10 (7): 1460–1463. doi:10.1021/ic50101a029.
- ^ J. C. Taylor, P. W. Wilson (1974). "The Structure of β-Tungsten Hexachloride by Powder Neutron and X-ray Diffraction". Acta Crystallographica. B30 (5): 1216–1220. doi:10.1107/S0567740874004572.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Lau, C.; Dietrich, A.; Plate, M.; Dierkes, P.; Neumüller, B.; Wocadlo, S.; Massa, W.; Harms, K.; Dehnicke, K. (2003). "Die Kristallstrukturen der Hexachlorometallate NH4[SbCl6], NH4[WCl6], [K(18-Krone-6)(CH2Cl2)]2[WCl6]·6CH2Cl2 und (PPh4)2[WCl6]·4CH3CN". Zeitschrift für anorganische und allgemeine Chemie. 629 (3): 473–478. doi:10.1002/zaac.200390078.
- ^ Eichler, W.; Seifert, H.-J. (1977). "Strukturelle und magnetische Untersuchungen an Hexachlorowolframaten(V)". Zeitschrift für anorganische und allgemeine Chemie. 431: 123–133. doi:10.1002/zaac.19774310112.
- ^ McCann, III, E. L.; Brown, T. M. (1972). "Tungsten(V) Chloride". Inorganic Syntheses. XIII: 150-154. doi:10.1002/9780470132449.ch29.
- ^ Cotton, F. A.; Rice, C. E. (1978). "Tungsten Pentachloride". Acta Crystallogr. B34: 2833-2834. doi:10.1107/S0567740878009322.
- ^ Cotton, F. Albert; Mott, Graham N.; Schrock, Richard R.; Sturgeoff, Lynda G. (1982). "Preparation and Characterization of a Compound Containing the Octachloroditungstate (Tungsten-Tungsten Quadruple Bond) Ion, [W2Cl8]4-". Journal of the American Chemical Society. 104 (24): 6781–6782. doi:10.1021/ja00388a050.
- ^ a b Cotton, F. Albert; Falvello, Larry R.; Mott, Graham N.; Schrock, Richard R.; Sturgeoff, Lynda G. (1983). "Structural Characterization of the Nonachloroditungsten(II, III) Ion". Inorganic Chemistry. 22 (18): 2621–2623. doi:10.1021/ic00160a031.
- ^ a b c Kolesnichenko, Vladimir; Luci, Jeffrey J.; Swenson, Dale C.; Messerle, Louis (1998). "W3(μ3-Cl)(μ-Cl)3Cl9n-(n= 2, 3), Discrete Monocapped Tritungsten Clusters Derived from a New Binary Tungsten Chloride, W3Cl10: Effect of Electron Count on Bonding in Isostructural Triangulo M3X13 Clusters1". Journal of the American Chemical Society. 120 (50): 13260–13261. doi:10.1021/ja9831958.
- ^ Kolesnichenko, Vladimir; Messerle, Louis (1998). "Facile Reduction of Tungsten Halides with Nonconventional, Mild Reductants. 2. Four Convenient, High-Yield Solid-State Syntheses of the Hexatungsten Dodecachloride Cluster W6Cl12 and Cluster Acid (H3O)2[W6(μ3-Cl)8Cl6](OH2)x, Including New Cation-Assisted Ternary Routes". Inorganic Chemistry. 37 (15): 3660–3663. doi:10.1021/ic980232n. PMID 11670462.
- ^ Arp, O.; Preetz, W. (1994). "Darstellung, Schwingungsspektren und Normalkoordinatenanalyse von Hexachlororhenat(V) sowie Kristallstruktur von [P(C6H5)4][ReCl6]". Zeitschrift für anorganische und allgemeine Chemie. 620 (8): 1391–1396. doi:10.1002/zaac.19946200811.
- ^ Chau, C.-N.; Wardle, R. W. M.; Ibers, J. A. (1988). "Structure of Di[bis(triphenylphosphine)iminium] Hexachlororhenate(IV)". Acta Crystallographica Section C. 44 (4): 751–753. doi:10.1107/S0108270187011910.
- ^ a b Heath, Graham A.; McGrady, John E.; Raptis, Raphael G.; Willis, Anthony C. (1996). "Valence-Dependent Metal−Metal Bonding and Optical Spectra in Confacial Bioctahedral [Re2Cl9]z- (z= 1, 2, 3). Crystallographic and Computational Characterization of [Re2Cl9]−and [Re2Cl9]2-". Inorganic Chemistry. 35 (23): 6838–6843. doi:10.1021/ic951604k. PMID 11666851.
- ^ a b Krebs, B.; Henkel, G.; Dartmann, M.; Preetz, W.; Bruns, M. (1984). "Reaktionen und Strukturen von [(C2H5)4N][OsCl6] und [(n-C4H9)4N]2[Os2Cl10]". Z. Naturforsch. 39 (7): 843. doi:10.1515/znb-1984-0701. S2CID 95254820.
- ^ a b Kim, Eunice E.; Eriks, Klaas; Magnuson, Roy (1984). "Crystal Structures of the Tetraphenylphosphonium salts of Hexachloroosmate(V) and Hexachloroosmate(IV), [(C6H5)4P]OsCl6 and [(C6H5)4P]2OsCl6". Inorganic Chemistry. 23 (4): 393–397. doi:10.1021/ic00172a003.
- ^ Agaskar, Pradyot A.; Cotton, F. Albert.; Dunbar, Kim R.; Falvello, Larry R.; Tetrick, Stephen M.; Walton, Richard A. (1986). "The Multiply Bonded Octahalodiosmate(III) Anions. 2. Structure and Bonding". Journal of the American Chemical Society. 108 (16): 4850–4855. doi:10.1021/ja00276a024.
- ^ Rankin, DA; Penfold, BR; Fergusson, JE (1983). "The Chloro and Bromo Complexes of Iridium(III) and Iridium(IV). II. Structural Chemistry of IrIII Complexes". Australian Journal of Chemistry. 36 (5): 871. doi:10.1071/CH9830871.
- ^ Sanchis-Perucho, Adrián; Martínez-Lillo, José (2019). "Ferromagnetic Exchange Interaction in a New Ir(IV)–Cu(II) Chain Based on the Hexachloroiridate(IV) Anion". Dalton Transactions. 48 (37): 13925–13930. doi:10.1039/C9DT02884F. PMID 31411207.
- ^ a b Belli Dell'Amico, Daniela; Calderazzo, Fausto; Marchetti, Fabio; Ramello, Stefano; Samaritani, Simona (2008). "Simple Preparations of Pd6Cl12, Pt6Cl12, and Qn[Pt2Cl8+n],n= 1, 2 (Q = TBA+, PPN+) and Structural Characterization of [TBA][Pt2Cl9] and [PPN]2[Pt2Cl10]·C7H8". Inorganic Chemistry. 47 (3): 1237–1242. doi:10.1021/ic701932u. PMID 18166044.
- ^ von Schnering, Hans Georg; Chang, Jen-Hui; Peters, Karl; Peters, Eva-Maria; Wagner, Frank R.; Grin, Yuri; Thiele, Gerhard (2003). "Structure and Bonding of the Hexameric Platinum(II) Dichloride, Pt6Cl12 (β-PtCl2)". Zeitschrift für Anorganische und Allgemeine Chemie. 629 (3): 516–522. doi:10.1002/zaac.200390084.
- ^ Helgesson, Göran; Jagner, Susan; Vicentini, G.; Rodellas, C.; Niinistö, L. (1987). "Crystal Structures of Tetraethylammonium Dichloroaurate(I) and Tetraethylammonium Diiodoaurate(I)". Acta Chemica Scandinavica. 41a: 556–561. doi:10.3891/acta.chem.scand.41a-0556.
- ^ Buckley, Robbie W.; Healy, Peter C.; Loughlin, Wendy A. (1997). "Reduction of [NBu4][AuCl4] to [NBu4][AuCl2] with Sodium Acetylacetonate". Australian Journal of Chemistry. 50 (7): 775. doi:10.1071/C97029.
- ^ Goggin, Peter L.; King, Paul; McEwan, David M.; Taylor, Graham E.; Woodward, Peter; Sandström, Magnus (1982). "Vibrational Spectroscopic Studies of Tetra-n-butylammonium Trihalogenomercurates; Crystal Structures of [NBun4](HgCl3) and [NBun4(HgI3)". Journal of the Chemical Society, Dalton Transactions (5): 875–882. doi:10.1039/dt9820000875.
- ^ Waizumi, K.; Masuda, H.; Ohtaki, H. (1992). "X-ray Structural Studies of FeBr2 · 4 H2O, CoBr2 · 4 H2O, NiCl2 · 4 H2O, and CuBr2 · 4 H2O. cis/trans Selectivity in Transition Metal(II) dihalide Tetrahydrate". Inorganica Chimica Acta. 192: 173–181. doi:10.1016/S0020-1693(00)80756-2.
- ^ Morosin, B. (1967). "An X-ray Diffraction Study on Nickel(II) Chloride Dihydrate". Acta Crystallographica. 23 (4): 630–634. doi:10.1107/S0365110X67003305.
- ^ a b Donovan, William F.; Smith, Peter W. (1975). "Crystal and Molecular Structures of Aquahalogenovanadium(III) Complexes. Part I. X-Ray Crystal Structure of trans-Tetrakisaquadibromo-Vanadium(III) Bromide Dihydrate and the Isomorphous Chloro- Compound". Journal of the Chemical Society, Dalton Transactions (10): 894. doi:10.1039/DT9750000894.
- ^ 앤드레스, K.R.; 카펜터, C. "크리스탈하이드레이트. II.Die Struktur von Chromclorid- und Alummiccloridhexahydat" Zeitschrift für Kristalogie, Kristallometrie, Kristallphyikie 1934, 제87권, p446-p463.
- ^ Zalkin, Allan; Forrester, J. D.; Templeton, David H. (1964). "Crystal structure of manganese dichloride tetrahydrate". Inorganic Chemistry. 3 (4): 529–33. doi:10.1021/ic50014a017.
- ^ Lind, M. D. (1967). "Crystal Structure of Ferric Chloride Hexahydrate". The Journal of Chemical Physics. 47 (3): 990–993. Bibcode:1967JChPh..47..990L. doi:10.1063/1.1712067.
- ^ Simon A. Cotton (2018). "Iron(III) chloride and its coordination chemistry". Journal of Coordination Chemistry. 71 (21): 3415–3443. doi:10.1080/00958972.2018.1519188. S2CID 105925459.
- ^ Manzer, L. E. (1982). Tetrahydrofuran Complexes of Selected Early Transition Metals. Inorganic Syntheses. Vol. 21. pp. 135–140. doi:10.1002/9780470132524.ch31.
- ^ Hagenbach, Adelheid; Yegen, Eda; Abram, Ulrich (2006). "Technetium Tetrachloride as a Precursor for Small Technetium(IV) Complexes". Inorganic Chemistry. 45 (18): 7331–7338. doi:10.1021/ic060896u. PMID 16933935.
- ^ Sobota, Piotr; Ejfler, Jolanta; Szafert, Sławomir; Szczegot, Krzysztof; Sawka-Dobrowolska, Wanda (1993). "New intermediates for the synthesis of olefin polymerization catalysts: The complexes [M2(μ-Cl)2Cl4(THF)4](M = Ti or V, THF = tetrahydrofuran); crystal structures and properties". Journal of the Chemical Society, Dalton Transactions (15): 2353–2357. doi:10.1039/dt9930002353.
- ^ Sobota, Piotr; Ejfler, Jolanta; Szafert, Sławomir; Szczegot, Krzysztof; Sawka-Dobrowolska, Wanda (1993). "New intermediates for the synthesis of olefin polymerization catalysts: The complexes [M2(μ-Cl)2Cl4(THF)4](M = Ti or V, THF = tetrahydrofuran); crystal structures and properties". Journal of the Chemical Society, Dalton Transactions (15): 2353–2357. doi:10.1039/dt9930002353.
- ^ Babaian-Kibala, Elizabeth; Cotton, F. Albert; Shang, Maoyu (1990). "New synthetic routes for the preparation of niobium(III) and tantalum(III) triangular cluster compounds". Inorganic Chemistry. 29 (26): 5148–5156. doi:10.1021/ic00351a005.
- ^ a b Dilworth, Jonathan R.; Richards, Raymond L. (1990). "The Synthesis of Molybdenum and Tungsten Dinitrogen Complexes". Inorganic Syntheses. Inorganic Syntheses. Vol. 28. pp. 33–43. doi:10.1002/9780470132593.ch7. ISBN 9780470132593.
- ^ Nachtigall, Olaf; Pataki, Astrid; Molski, Matthias; Lentz, Dieter; Spandl, Johann (2015). "Solvates of Manganese Trichloride Revisited - Synthesis, Isolation, and Crystal Structure of MnCl3(THF)3". Zeitschrift für Anorganische und Allgemeine Chemie. 641 (6): 1164–1168. doi:10.1002/zaac.201500106.
- ^ Hagenbach, Adelheid; Yegen, Eda; Abram, Ulrich (2006). "Technetium Tetrachloride as a Precursor for Small Technetium(IV) Complexes". Inorganic Chemistry. 45 (18): 7331–7338. doi:10.1021/ic060896u. PMID 16933935.
- ^ H.-W.Swidersky, J.Pebler, K.Dehnicke, D.Fenske (1990). "Technetium Tetrachloride as a Precursor for Small Technetium(IV) Complexes". Z.Naturforsch.,B:Chem.Sci. 45 (18): 7331–8. doi:10.1021/ic060896u. PMID 16933935.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Cotton, F.Albert; Luck, Rudy L.; Son, Kyung-Ae (1991). "New polynuclear compounds of iron(II) chloride with oxygen donor ligands Part I. Fe4Cl8(THF)6: Synthesis and a single crystal X-ray structure determination". Inorganica Chimica Acta. 179: 11–15. doi:10.1016/S0020-1693(00)85366-9.
- ^ Sobota, Piotr; Olejnik, Zofia; Utko, Józef; Lis, Tadeusz (1993). "Synthesis, magnetic properties and structure of the [Co4(μ3-Cl)2(μ2-Cl)4Cl2(THF)6] complex". Polyhedron. 12 (6): 613–616. doi:10.1016/S0277-5387(00)84976-1.
- ^ Ward, Laird G. L. (1972). "Anhydrous Nickel(II) Halides and their Tetrakis(ethanol) and 1,2-Dimethoxyethane Complexes". Inorganic Syntheses. Inorganic Syntheses. Vol. 13. pp. 154–164. doi:10.1002/9780470132449.ch30. ISBN 9780470132449.
- ^ Becker, Sabine; Dürr, Maximilian; Miska, Andreas; Becker, Jonathan; Gawlig, Christopher; Behrens, Ulrich; Ivanović-Burmazović, Ivana; Schindler, Siegfried (2016). "Copper Chloride Catalysis: Do μ4-Oxido Copper Clusters Play a Significant Role?". Inorganic Chemistry. 55 (8): 3759–3766. doi:10.1021/acs.inorgchem.5b02576. PMID 27045752.