트리코테센
Trichothecene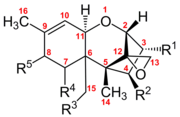
트리코테센은 푸사리움, 미로테슘, 트리코데르마 등의 다양한 종에 의해 생성되는 화학적으로 매우 가까운 마이코톡신 과입니다.포도스트로마, 트리코테슘, 세팔로스포리움, 베르티시모노스포리움, 스타키보트리움.트리코테센은 세스키테르펜의 일종이다.트리코테센의 생물학적 활성을 유발하는 가장 중요한 구조적 특징은 12,13-에폭시 고리, 트리코테센 핵의 적절한 위치에 수산기 또는 아세틸기가 존재하는 것, 그리고 측쇄의 구조와 위치이다.그것들은 밀, 귀리, 옥수수 등 다양한 푸사리움 종에 의해 생산된다.F. graminearum, F. sportotrichioides, F. poae, F. equiseti.
Stachybotrys chartarum과 같이 트리코테센 마이코톡신을 생산하는 일부 곰팡이는 습한 실내 환경에서 자랄 수 있습니다.S. chartarum에 의해 생산된 거시순환 트리코테센은 공기로 운반되어 건물 [1][2]거주자의 건강 문제에 기여할 수 있는 것으로 밝혀졌다.사트라톡신H, 로리딘E, 베루카린 등 6종의 트리코테센을 함유한 일본과 중국의 독버섯 포도스트로마 콘우다마에.
분류
일반구분
트리코테센은 150개 이상의 화학적으로 연관된 마이코톡신들의 [3]그룹이다.각 트리코테센은 단일 산소 원자를 포함한 단일 6원환으로 이루어진 코어 구조를 나타내며, 그 옆에는 2개의 탄소 [4]고리가 있다.이 코어 링 구조에는 12,13개의 탄소 위치에 에폭시드 또는 삼환식 에테르와 9,10개의 탄소 [5]위치에 이중 결합이 포함되어 있습니다.이 두 가지 기능군은 단백질 합성을 억제하고 일반적인 세포독성 [6]효과를 일으키는 트리코테센 능력에 주로 책임이 있다.특히 이 코어 구조는 양극성 [7]및 비극성 부분을 모두 포함하는 양극성 구조이다.모든 트리코테센은 이러한 공통 구조를 통해 관련되지만, 각 트리코테센은 또한 탄소 3,4,7,8 [5]및 15의 가능한 부위에 기능기를 포함하는 산소의 고유한 치환 패턴을 가지고 있다.이러한 기능 그룹은 개별 트리코테센의 특성을 통제하고 또한 이 독소 패밀리에 가장 일반적으로 사용되는 분류 시스템의 기초가 됩니다.이 분류 체계에서는 트리코테센 패밀리를 4개의 그룹으로 나눕니다.A, B, C 및 D를 입력합니다.
A형 트리코테센은 코어 고리 [4]구조 주위에 수산기, 에스테르 또는 관능기 치환을 가지고 있지 않다.대표적인 예로는 탄소8에서 수산기 치환의 네오솔라니올과 탄소8에서 에스테르 치환의 T-2 독소를 들 수 있다.
B형 트리코테센은 코어링 [4]구조 주위에 치환된 카르보닐 관능기의 존재에 따라 분류된다.이들의 일반적인 예로는 니발레놀과 트리코테신이 있으며, 둘 다 탄소 8에 케톤 관능기를 가지고 있다.
C형 트리코테센은 여분의 탄소 7, 카본 [4]8 에폭시드기를 가진다.일반적인 예는 크로토신입니다.또한 탄소 4에 에스테르 관능기를 가지고 있다.
D형 트리코테센은 탄소4와 탄소15 [4]사이에 추가 고리를 가진다.이러한 링에는 다양한 기능 그룹이 있을 수 있습니다.일반적인 예로는 로리딘 A와 사트라톡신 H가 있다.
이러한 분류 유형의 개별 기능군은 각 트리코테센에 고유한 화학적 특성을 제공하지만, 이들의 분류 유형은 상대적인 [4]독성을 명시적으로 나타내지 않는다.D형 트리코테센이 가장 독성이 높은 것으로 생각되지만 A형과 B형은 비교적 혼합 [4]독성을 가지고 있다.
대체 분류
위에서 설명한 분류 체계는 트리코테센 계열의 분자를 그룹화하기 위해 가장 일반적으로 사용된다.그러나, 이러한 복잡한 분자에 대한 다양한 대체 분류 체계도 존재한다.트리코테센은 또한 일반적으로 단순 또는 거시 [6]순환으로 묘사될 수 있다.단순 트리코테센은 A형, B형, C형이며, 매크로사이클릭 트리코테센은 D형이며 탄소4 - 탄소15 브릿지가 존재하는 것이 특징이다.또한, J. F. Grove는 고리 [8]골격의 기능적 대체 패턴에 기초한 트리코테인을 세 그룹으로 분류할 것을 제안했다.1족 트리코테인은 세 번째 완전 포화 탄소 [8]고리에만 치환된 관능기를 가진다.2족 트리코테센은 9,10개의 탄소 이중결합을 [8]포함한 코어링에 부가적인 관능기를 포함한다.마지막으로, 3족 트리코테센은 탄소8에 케톤 관능기를 포함하고 있으며, 이는 B형 트리코테센과 [8]동일한 기준이다.
진화 유전학 분야의 발전은 또한 그들의 생합성 경로를 기반으로 한 트리코테센 분류 시스템을 제안하게 만들었다.마이코톡신의 생합성을 담당하는 유전자는 전형적으로 클러스터 안에 위치하고 있으며, 후사리움에서는 TRI [9]유전자로 알려져 있다.TRI 유전자는 각각 트리코테센의 생합성에서 특정한 단계를 수행하는 효소를 생산하는 데 책임이 있다.이러한 유전자의 돌연변이는 변종 트리코테센의 생산을 이끌 수 있으며, 따라서 이러한 분자는 공유 생합성 단계에 따라 그룹화될 수 있다.예를 들어 트리코테센 생합성에서의 공유 단계는 유전자 TRI4에 [10]의해 제어된다.이 효소 생성물은 트리코디엔에 대한 산소 3개 또는 4개의 첨가를 조절하여 각각 [10]이소트리코디올 또는 이소트리코트리올을 형성한다.그 후 이들 중간체 중 하나에서 다양한 트리코테센을 합성할 수 있으므로, 이소트리코트리올로부터 합성할 경우 t형, 이소트리코디올로부터 [4]합성할 경우 d형 중 하나로 분류할 수 있다.
작용 메커니즘
트리코테센의 독성은 주로 단백질 합성 억제제로 널리 인용되는 작용의 결과이다. 이러한 억제 작용은 단백질 합성의 시작, 신장, [11]종료의 세 단계 모두에서 리보솜에서 일어난다.개시 중에 트리코테센은 2개의 리보솜 서브유닛의 결합을 억제하거나 제1 tRNA와 시작 코돈의 [11]결합을 방지함으로써 성숙한 리보솜의 기능을 억제할 수 있다.신장 억제는 트리코테센이 [12]60년대 리보솜 서브유닛에서 새로운 펩타이드 결합 형성을 촉매하는 효소인 기능 펩티딜 전이효소를 방해하기 때문에 발생할 가능성이 높다.종단 중의 억제는 또한 펩티딜전달효소 억제 또는 이 [11]최종 단계에서 요구되는 가수분해를 방지하는 트리코테센의 능력의 결과일 수 있다.
트리코테센의 고리 코어 치환 패턴이 개시 억제제 또는 신장/[11]종단 억제제로서의 독소의 작용에 영향을 미친다는 것은 흥미롭다.트리코테센은 또한 활성 부위 티올기가 12,13개의 에폭시드 탄소 [13]고리를 공격하는 경향 때문에 일반적인 세포 효소 기능에 영향을 미치는 능력을 가지고 있다.이러한 억제 효과는 위장관이나 골수와 같은 활발하게 증식하는 세포에서 가장 극적으로 나타난다.
단백질 합성은 세포의 에너지를 생산하는 세포질인 미토콘드리아의 내강 공간뿐만 아니라 세포의 세포질에서도 일어난다.이것은 반응성 산소종이라고 불리는 고도로 산화한 분자를 생성하는 효소 경로를 통해 이루어집니다. 예를 들어 [14]과산화수소입니다.활성산소는 세포막, 단백질,[15] DNA를 포함한 세포의 많은 중요한 부분과 반응하고 손상을 일으킬 수 있습니다.미토콘드리아에서의 단백질 합성의 트리코테센 억제는 활성산소종이 세포 내에 축적되도록 하며, 이는 불가피하게 산화적 스트레스 및 프로그램된 세포사망 경로인 [15]아포토시스의 유도를 초래한다.
활성산소종이 높은 세포에서 아포토시스의 유도는 다양한 세포 신호 경로 때문이다.첫 번째는 T-2 독소에 의해 상향 조절되는 것으로 보이는 p53 경로이다.p53은 세포주기를 조절하는 단백질이지만, 이 단백질의 활성 증가는 또한 [16]세포에서 BAX 단백질의 활성화를 증가시킨다.이러한 BAX 단백질은 주로 미토콘드리아 막의 투과성을 증가시키고 시토크롬 c와 활성산소 [16]종의 방출을 이끈다.미토콘드리아로부터의 시토크롬c 방출은 카스파아제 즉 내부에서 세포를 분해하는 단백질의 조립을 개시함으로써 아포토시스를 유도한다.
또한 T-2와 같은 트리코테센은 세포에서 [17]c-Jun N-Terminal Kinase 시그널링 경로를 증가시키는 것으로 나타났다.여기서, c-Jun N-Terminal 키나제는 표적인 c-Jun의 활성 형태로 인산화까지 증가할 수 있다.활성화된 c-jun은 하류 아포토시스 [17]경로를 촉진하는 데 중요한 단백질의 세포핵에서 전사 인자로 작용한다.
증상학
트리코테센 마이코톡신은 인간, 다른 포유류, 조류, 물고기, 다양한 무척추동물, 식물, 그리고 진핵세포에 [18]독성이 있다.특이 독성은 특정 독소와 동물의 종류에 따라 다르지만, 투여 경로는 치사율을 결정하는 데 있어 상당히 높은 역할을 한다.중독의 영향은 노출의 농도, 시간 및 노출 방법에 따라 달라집니다.고농축 용액이나 다량의 독소가스 형태는 사망을 포함한 심각한 영향을 일으킬 가능성이 높다.섭취 시 독소는 리보솜 단백질, DNA 및 RNA [19][18][20]합성을 억제하고 미토콘드리아는 세포[21][22][23] 분열을 억제하는 동시에 리보톡시 스트레스 [26]반응이라는 세포 스트레스 반응을 활성화한다.
트리코테센 마이코톡신은 국소적, 경구적 및 흡입 경로를 통해 흡수될 수 있으며 세포하,[18] 세포하 및 유기계 수준에서 매우 독성이 강하다.
트리코테센은 피부를 통해 작용할 수 있기 때문에 대부분의 잠재적인 무기 독소와 다르며, 이는 양친매성 및 친유성 특징에 기인한다.트리코테카네의 작은 양성 성질은 그들이 세포막을 쉽게 교차하고 미토콘드리아,[27][28][29] 소포체 그리고[30] 엽록체와 같은 다른 기관들과 상호작용할 수 있게 해줍니다 트리코테카네의 친유성 성질은 그들이 폐 점막과 내장을 통해 쉽게 흡수되도록 합니다.트리코테센의 직접 피부 도포 또는 경구 섭취는 피부 또는 장 [19][18]점막에 빠른 자극을 일으킨다.피부 자극제와 수포제로서 유황 겨자보다 400배 더 중독성이 있다고 알려져 있다.
마이코톡신(소화성 독성 알류키아)에 대한 체내 반응은 섭취 후 며칠 후 4단계로 나타난다.
- 첫 단계는 위 점막과 장 점막의 염증을 포함한다.
- 2단계는 백혈구감소증, 과립감소증, 진행성 림프구증입니다.
- 세 번째 단계는 피부와 점막의 출혈뿐만 아니라 몸의 피부에 붉은 발진이 나타나는 것이 특징이다.심하면 실어증과 교살에 의한 사망이 발생할 수 있다.
- 제4단계에서는 림프기관 및 골수 및 비장의 적혈구 세포가 고갈되어 면역반응이 저하된다.
상처, 찰과상 또는 [32]찰과상과 같은 경미한 부상에 의해 감염이 유발될 수 있습니다.
다음과 같은 현상이 나타납니다.
- 심한 가려움증, 피부홍조, 상처, 피부탈락
- 감각의 왜곡, 근육의 움직임을 조정하는 능력의 상실
- 메스꺼움, 구토 및 설사
- 코와 목의 통증, 코에서 분비물, 가려움증, 재채기
- 기침, 호흡곤란, 쌕쌕거림, 가슴 통증, 피 토하기
- 일시적인 출혈 장애
- 체온[33][34] 상승
규제에 관한 문제
동물 및 인간 식품과 관련하여, A형 트리코테센(예: T-2 독소, HT-2 독소, 디아세톡시스시시르페놀)은 다른 식중독 트리코테센(예: 디옥시니발레놀, 니발레놀, 3-아세틸데옥시)보다 더 독성이 강하기 때문에 특별한 관심을 끈다.하지만 디옥시니발레놀은 유럽에서 [35]가장 널리 사용되는 트리코테센이기 때문에 걱정거리다.트리코테센의 주요 효과는 상품 내 농도와 관련이 있으며 사료 섭취 감소, 구토 및 면역 억제입니다.유럽 연합을 중심으로 비교적 적은 수의 국가들이 식품과 동물 사료에서 이러한 마이코톡신에 대한 최대 제한을 권고하고 있다.하지만 트리코테신은 먹이사슬에 들어가는 것을 막고 동물의 생산 손실을 막기 위해 종종 다른 곳에서 테스트된다.
역사
트리코테세네는 제2차 세계대전 중 1932년 러시아 오렌부르크에서 소련에 의해 발견된 것으로 알려져 있다.약 10만 명(사망률 60%)이 방사능과 유사한 증상을 보이는 치명적인 질병인 소화성 독성 알류키아로 고통받고 사망하기 시작했다.소련 민간인들은 오염된 빵을 섭취하고 오염된 건초, 먼지, 환기 시스템을 통해 곰팡이를 흡입하여 병에 걸린 것으로 여겨진다.범인은 T-2 [36]독소의 높은 생산량인 푸사리움 포자충 포자충과 푸사리움 포아에로 추정된다.퓨사리움 종은 아마도 트리코테센을 생산하는 균류 [37]중 가장 흔하게 인용되고 가장 풍부한 균류 중 하나일 것이다.
트리코테센은 다량으로 생산하기에 치명적이고 저렴하며, 분산용 에어로졸로서 안정적이며, 효과적인 예방접종/[12]치료 없이 이상적인 생물전제이다.증거는 마이코톡신이 이미 생물전으로 이용되었음을 시사한다.
- 1964년 이집트나 러시아군이 T-2를 겨자 가스와 함께 사용했다는 확인되지 않은 보고가 있다.
- 1974-1981년 동남아시아(라오스, 캄보디아)와[38][39][40][41] 아프가니스탄에서 발생한 '황우' 사건
- 1975년과 1981년 베트남 전쟁 당시 소련은 라오스와 캄보디아 저항군에 대항하기 위해 베트남과 라오스 군대에 마이코톡신을 공급했다는 주장이 있었다.
- 1985-1989년 이란-이라크 전쟁, 이라크에 대한 마이코톡신 수송 보고(분말과 [44]연기 형태)
그 이후로 트리코테센은 [45]전 세계에 보고되었다.인간과 동물의 생명 손실, 건강관리와 수의료 비용 증가, 가축 생산 감소, 오염된 식품과 사료 폐기, 마이코톡신 문제의 심각성을 줄이기 위한 연구와 응용에 대한 투자 등의 이유로 인해 그들은 세계에 상당한 경제적 영향을 끼쳤다.이러한 마이코톡신은 종종 인간의 통제를 벗어난 요인(환경, 생태 또는 저장 방법)[46]으로 인해 연간 수백만 달러의 손실을 초래합니다.
식품 오염
옥수수, 밀, 보리, 귀리, 쌀, 호밀, 채소 및 기타 농작물에서 위험한 트리코테센 농도가 검출되었습니다.감염으로 인한 질병은 씨앗 썩음, 모종병, 뿌리 썩음, 줄기 썩음, 귀 [47]썩음 등이다.트리코테센은 또한 가금류 사료의 일반적인 오염물질이며 가금류의 건강과 생산성에 미치는 악영향은 광범위하게 [48]연구되어 왔다.
몇몇 연구는 곰팡이 생장에 최적의 조건이 독소 [49]생산에 반드시 최적인 것은 아니라는 것을 보여주었다.독소 생성은 6-24°C의 높은 습도와 온도에서 가장 높습니다.곰팡이의 번식 및 생산은 고온과 습도가 높은 열대 기후에서 강화된다. 수확 중 [50]몬순, 갑작스러운 홍수, 때아닌 비가 내린다.공기 샘플에서 트리코테센이 검출되어 포자나 작은 입자에 에어로졸화될 수 있습니다.
아시아, 아프리카, 남미, 유럽 및 북미에서[53] TCT의 자연 발생이 보고되고 있다.
- 비슷한 병인 아카카비보는 일본에서도 [54]트리코테센에 오염된 곡물과 관련이 있다.
- 중국에서도 DON, T-2 독소, NIV 등 트리코테센에 오염된 곡물이나 그 제품들이 위장 [55]장애의 발생과 관련이 있다.
- 유고슬라비아에서는 생우유의 균류 발생에 대한 연구에 따르면 테스트한 샘플의 91%가 오염되었다[56].
- 미국에서는 1988-1989년 중서부 7개 주에서 연구가 진행됐으며 옥수수 [57]샘플의 19.5%-24.7%에서 마이코톡신이 검출됐다.1900년대 초반부터 후사리움균에 감염된 곡물을 섭취한 후 동물과 사람에게서 구토가 발생하는 사례가 [58][59]보고되고 있다.
- 1985년부터 1987년까지 비하르 지역에서 실시된 연구에서 테스트한 검체 중 51%가 [60]곰팡이에 오염되었습니다.
- 비하르 지역의 [61]또 다른 연구에서는 젖소용으로 사용되는 견과류 분쇄물에서 높은 수치가 보고되었다.
- Ludhiana와 Punjab의 연구원들은 낙농장에서 나온 샘플의 75%가 [62]오염된 것을 발견했다.
- 인도에서는 마이코톡신에 [63]의한 땅콩 오염으로 약 1000만 달러의 손실이 발생했다.
안전.
트리코테센 노출에 대한 직접적인 해독제는 알려져 있지 않다.따라서 오염 지역의 위험 관리는 주로 노출 증상 처리와 향후 노출 방지에 의해 정의된다.
치료
트리코테센 독소에 노출되는 전형적인 경로에는 국소 흡수, 섭취 및 흡입이 포함된다.증상의 심각도는 피폭량과 유형에 따라 다르지만, 치료는 주로 마이코톡신에 의해 손상된 신체 시스템을 지원하는 데 초점이 맞춰진다.대부분의 노출 사례에서 첫 번째 단계는 잠재적으로 오염된 의류를 제거하고 노출 부위를 [64]물로 완전히 씻어내는 것이다.이로 인해 피해자가 반복적으로 노출되는 것을 방지할 수 있습니다.체액과 전해질을 높은 수준의 위장 손상을 입은 환자에게 투여하여 트랙트 흡수 감소의 영향을 완화할 수 있다.신선한 공기와 보조 호흡은 가벼운 호흡곤란이 [64]생길 때 투여될 수 있다.증상이 점점 더 심각해지면 고도의 의학적 지원이 필요할 수 있습니다.백혈구 감소증의 시작 또는 백혈구 수 감소는 혈장 또는 혈소판 [64]수혈로 치료할 수 있다.저혈압은 노르에피네프린이나 [64]도파민 투여로 치료될 수 있다.심각한 심폐 장애의 발병은 심장과 폐의 활동을 안정시키기 위해 삽관과 추가적인 약물 치료를 필요로 할 수 있다.
또한 트리코테센이 세포와 조직에 미치는 피해를 간접적으로 줄일 수 있는 다양한 화학물질이 있다.활성탄 용액은 흡착제로 [65]섭취 사례에 자주 투여됩니다.여기서 숯은 독소가 결합하는 다공질 물질로 작용하여 위장관을 통한 흡수를 방지하고 장 배설을 통해 독소의 체내 제거를 증가시킨다.또한 유사한 해독 흡착제를 오염 시 동물 사료에 첨가하여 섭취 시 독소의 생물학적 가용성을 낮출 수 있다.항산화제는 또한 트리코테센이 세포에서 생성하는 활성산소종의 증가에 대한 반응으로 트리코테센의 해로운 영향을 완화하는데 유용하다.일반적으로, 프로바이오틱스, 비타민과 영양소, 단백질, 그리고 리피디스가 풍부한 좋은 식단은 트리코테센 [16]중독 증상을 줄이는데 효과적이라고 여겨진다.예를 들어 비타민 E는 [66]닭에서 T-2 독소에 의해 유도되는 지질 과산화물의 형성을 중화시키는 것으로 밝혀졌다.마찬가지로, T-2 독소를 섭취하는 닭의 식단에서 변형된 글루코만난과 셀레늄의 공보충은 간에서 항산화제의 독소 고갈과 관련된 해로운 영향을 감소시켰다.직접적인 해독제가 아님에도 불구하고, 이러한 항산화제는 트리코테센 노출의 심각성을 줄이는데 매우 중요할 수 있습니다.
예방
트리코테센은 곡물 저장고를 자주 오염시키는 곰팡이에 의해 생성되는 마이코톡신이다.이것은 트리코테센 오염을 공중 보건의 중대한 문제로 만들고, 많은 지역에서 허용되는 트리코테센 함량에 엄격한 제한을 두고 있다.예를 들어, 유럽연합(EU)에서는 사람이 [67]소비하는 베이커리 제품에는 0.025ppm의 T-2 독소만 허용된다.트리코테센을 만들 수 있는 곰팡이는 수분 함량이 높은 어둡고 온화한 곳에서 잘 자랍니다.따라서 식품에서 트리코테센 오염을 예방하는 가장 좋은 방법 중 하나는 [16]곰팡이의 성장을 막기 위해 적절한 조건에서 자원을 저장하는 것이다.예를 들어, 일반적으로 수분 함량이 15% [68]미만인 영역에만 곡물을 저장하는 것이 좋습니다.그러나 트리코테센 독소로 이미 오염된 지역은 추가 노출을 방지하기 위해 다양한 가능한 제염 전략이 있습니다.0.1M 수산화나트륨(NaOH)에 1% 차아염소산나트륨(NaOCL)을 4~5시간 동안 투여하면 T-2 [16]독소의 생물학적 활성을 억제하는 것으로 나타났다.약 25ppm의 수성 오존에 의한 배양은 9,10 탄소 이중 [69]결합의 산화와 관련된 메커니즘을 통해 다양한 트리코테센을 분해하는 것으로 나타났다.UV 노출은 또한 적절한 [16]조건하에서 효과가 있는 것으로 나타났다.
물리적 및 화학적 오염 제거 전략 외에도 분자 유전학의 진보된 연구는 생물학적 오염 제거 접근의 가능성을 낳았다.박테리아, 효모, 곰팡이를 포함한 많은 미생물들은 트리코테센 마이코톡신의 [68]특이적이고 효율적인 분해를 촉진하는 효소 유전자 산물을 진화시켜 왔다.이들 효소 중 다수는 트리코테센의 독성에 중요한 12,13개의 탄소 에폭시드 고리를 특이적으로 분해한다.예를 들어 Eubacteria 균주 BBSH797은 12,13개의 카본에폭시드환을 이중결합기로 [68]환원하는 탈에폭시다아제 효소를 생성한다.이들은 트리코테센 해독성을 발현하는 다른 미생물들과 함께 오염된 사료의 [16]섭취에 대한 독성 영향을 방지하기 위해 사료 저장소에서 사용될 수 있다.게다가, 이러한 해독 효소를 생산하는 데 책임이 있는 유전자의 분자 복제는 트리코테센 [16]중독에 내성이 있는 농산물의 변종을 생산하는 데 유용할 수 있다.
에폭시트리히토테센스
Epoxitrichotecene은 위의 변형으로 동독에서, 그리고 [70]아마도 소련 블록 전체에서 군사용으로 한 때 탐색되었습니다.에폭시티코테센 중독 증상이 나타나면 영구적인 손상을 남기지 않고 효과가 진정될 수 있지만 실행 가능한 치료법은 없다.
관련 에폭시트리히토테센이 자외선과 열, 염소 노출에 의해 매우 빠르게 분해되어 공개 공격 및 물 공급 [citation needed]중독에 사용할 수 없게 되면서 대규모 바이오 무기 사용 계획은 폐기되었다.
레퍼런스
- ^ 실내환경에서의 대기성 스타키보트리차타럼 거시환 트리코테센 마이코톡신 검출
- ^ Etzel RA (2002). "Mycotoxins". JAMA. 287 (4): 425–7. doi:10.1001/jama.287.4.425. PMID 11798344.
- ^ "American Phytopathological Society". American Phytopathological Society. Retrieved 2018-05-07.
- ^ a b c d e f g h McCormick SP, Stanley AM, Stover NA, Alexander NJ (July 2011). "Trichothecenes: from simple to complex mycotoxins". Toxins. 3 (7): 802–14. doi:10.3390/toxins3070802. PMC 3202860. PMID 22069741.
- ^ a b Protection Against Trichothecene Mycotoxins. National Academies. 1983-01-01. ISBN 9780309034302.
- ^ a b Bennett JW, Klich M (July 2003). "Mycotoxins". Clinical Microbiology Reviews. 16 (3): 497–516. doi:10.1128/CMR.16.3.497-516.2003. PMC 164220. PMID 12857779.
- ^ a b Middlebrook JL, Leatherman DL (September 1989). "Specific association of T-2 toxin with mammalian cells". Biochemical Pharmacology. 38 (18): 3093–102. doi:10.1016/0006-2952(89)90020-8. PMID 2783163.
- ^ a b c d Grove JF (1988). "Non-macrocyclic trichothecenes". Natural Product Reports. 5 (2): 187–209. doi:10.1039/NP9880500187. ISSN 0265-0568. PMID 3062504.
- ^ Kimura, Makoto; Tokai, Takeshi; o'Donnell, Kerry; Ward, Todd J.; Fujimura, Makoto; Hamamoto, Hiroshi; Shibata, Takehiko; Yamaguchi, Isamu (2003-03-27). "The trichothecene biosynthesis gene cluster of Fusarium graminearum F15 contains a limited number of essential pathway genes and expressed non-essential genes". FEBS Letters. 539 (1–3): 105–110. doi:10.1016/S0014-5793(03)00208-4. PMID 12650935. S2CID 19787988.
- ^ a b McCormick SP, Alexander NJ, Proctor RH (July 2006). "Fusarium Tri4 encodes a multifunctional oxygenase required for trichothecene biosynthesis". Canadian Journal of Microbiology. 52 (7): 636–42. doi:10.1139/w06-011. PMID 16917519.
- ^ a b c d Kiessling K (1986). "Biochemical mechanism of action of mycotoxins" (PDF). Pure and Applied Chemistry. 58 (2): 327–338. doi:10.1351/pac198658020327. S2CID 94777285.
- ^ a b Henghold WB (July 2004). "Other biologic toxin bioweapons: ricin, staphylococcal enterotoxin B, and trichothecene mycotoxins". Dermatologic Clinics. 22 (3): 257–62, v. doi:10.1016/j.det.2004.03.004. PMID 15207307.
- ^ Ueno Y, Matsumoto H (October 1975). "Inactivation of some thiol-enzymes by trichothecene mycotoxins from Fusarium species". Chemical & Pharmaceutical Bulletin. 23 (10): 2439–42. doi:10.1248/cpb.23.2439. PMID 1212759.
- ^ Zorov DB, Juhaszova M, Sollott SJ (July 2014). "Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release". Physiological Reviews. 94 (3): 909–50. doi:10.1152/physrev.00026.2013. PMC 4101632. PMID 24987008.
- ^ a b Fang H, Wu Y, Guo J, Rong J, Ma L, Zhao Z, Zuo D, Peng S (August 2012). "T-2 toxin induces apoptosis in differentiated murine embryonic stem cells through reactive oxygen species-mediated mitochondrial pathway". Apoptosis. 17 (8): 895–907. doi:10.1007/s10495-012-0724-3. PMID 22614820. S2CID 17446994.
- ^ a b c d e f g h Adhikari M, Negi B, Kaushik N, Adhikari A, Al-Khedhairy AA, Kaushik NK, Choi EH (May 2017). "T-2 mycotoxin: toxicological effects and decontamination strategies". Oncotarget. 8 (20): 33933–33952. doi:10.18632/oncotarget.15422. PMC 5464924. PMID 28430618.
- ^ a b Li M, Pestka JJ (September 2008). "Comparative induction of 28S ribosomal RNA cleavage by ricin and the trichothecenes deoxynivalenol and T-2 toxin in the macrophage". Toxicological Sciences. 105 (1): 67–78. doi:10.1093/toxsci/kfn111. PMC 2734305. PMID 18535001.
- ^ a b c d Wannemacher R, Wiener SL, Sidell FR, Takafuji ET, Franz DR (1997). Trichothecene mycotoxins. Medical Aspects of Chemical and Biological Warfare. Vol. 6 (1st ed.). United States Government Printing. pp. 655–76. ISBN 978-9997320919.
- ^ a b McLaughlin C, Vaughan M, Campbell I, Wei CM, Stafford M, Hansen B (1977). "Inhibition of protein synthesis by trichothecenes.". Mycotoxins in human and animal health. Park Forest South, IL: Pathotox Publishers. pp. 263–75.
- ^ Desjardins AE, Hohn TM, McCormick SP (September 1993). "Trichothecene biosynthesis in Fusarium species: chemistry, genetics, and significance". Microbiological Reviews. 57 (3): 595–604. doi:10.1128/MMBR.57.3.595-604.1993. PMC 372927. PMID 8246841.
- ^ Fried HM, Warner JR (January 1981). "Cloning of yeast gene for trichodermin resistance and ribosomal protein L3". Proceedings of the National Academy of Sciences of the United States of America. 78 (1): 238–42. Bibcode:1981PNAS...78..238F. doi:10.1073/pnas.78.1.238. PMC 319027. PMID 7017711.
- ^ Bouaziz C, Martel C, Sharaf el dein O, Abid-Essefi S, Brenner C, Lemaire C, Bacha H (August 2009). "Fusarial toxin-induced toxicity in cultured cells and in isolated mitochondria involves PTPC-dependent activation of the mitochondrial pathway of apoptosis". Toxicological Sciences. 110 (2): 363–75. doi:10.1093/toxsci/kfp117. PMID 19541794.
- ^ Bin-Umer MA, McLaughlin JE, Basu D, McCormick S, Tumer NE (December 2011). "Trichothecene mycotoxins inhibit mitochondrial translation--implication for the mechanism of toxicity". Toxins. 3 (12): 1484–501. doi:10.3390/toxins3121484. PMC 3268453. PMID 22295173.
- ^ Azcona-Olivera JI, Ouyang Y, Murtha J, Chu FS, Pestka JJ (July 1995). "Induction of cytokine mRNAs in mice after oral exposure to the trichothecene vomitoxin (deoxynivalenol): relationship to toxin distribution and protein synthesis inhibition". Toxicology and Applied Pharmacology. 133 (1): 109–20. doi:10.1006/taap.1995.1132. PMID 7597700.
- ^ Thompson WL, Wannemacher RW (1986). "Structure-function relationships of 12,13-epoxytrichothecene mycotoxins in cell culture: comparison to whole animal lethality". Toxicon. 24 (10): 985–94. doi:10.1016/0041-0101(86)90004-8. PMID 3824405.
- ^ Shifrin VI, Anderson P (May 1999). "Trichothecene mycotoxins trigger a ribotoxic stress response that activates c-Jun N-terminal kinase and p38 mitogen-activated protein kinase and induces apoptosis". The Journal of Biological Chemistry. 274 (20): 13985–92. doi:10.1074/jbc.274.20.13985. PMID 10318810.
- ^ Cundliffe E, Cannon M, Davies J (January 1974). "Mechanism of inhibition of eukaryotic protein synthesis by trichothecene fungal toxins". Proceedings of the National Academy of Sciences of the United States of America. 71 (1): 30–4. Bibcode:1974PNAS...71...30C. doi:10.1073/pnas.71.1.30. PMC 387925. PMID 4521056.
- ^ Cundliffe E, Davies JE (March 1977). "Inhibition of initiation, elongation, and termination of eukaryotic protein synthesis by trichothecene fungal toxins". Antimicrobial Agents and Chemotherapy. 11 (3): 491–9. doi:10.1128/AAC.11.3.491. PMC 352012. PMID 856003.
- ^ Ueno Y (1985). "The toxicology of mycotoxins". Critical Reviews in Toxicology. 14 (2): 99–132. doi:10.3109/10408448509089851. PMID 3158480.
- ^ Pace JG, Watts MR, Canterbury WJ (1988). "T-2 mycotoxin inhibits mitochondrial protein synthesis". Toxicon. 26 (1): 77–85. doi:10.1016/0041-0101(88)90139-0. PMID 3347933.
- ^ Coulombe RA (March 1993). "Biological action of mycotoxins". Journal of Dairy Science. 76 (3): 880–91. doi:10.3168/jds.S0022-0302(93)77414-7. PMID 8463495.
- ^ Schwarzer K (2009). "Harmful effects of mycotoxins on animal physiology". 17th Annual ASAIM SEA Feed Technology and Nutrition Workshop. Hue, Vietnam.
- ^ "Trichothecene Mycotoxin IDPH". www.dph.illinois.gov. Retrieved 2018-05-07.
- ^ Ueno Y (April 1984). "Toxicological features of T-2 toxin and related trichothecenes". Fundamental and Applied Toxicology. 4 (2 Pt 2): S124–32. doi:10.1016/0272-0590(84)90144-1. PMID 6609858.
- ^ Miller JD (2003). "Aspects of the ecology of fusarium toxins in cereals.". In de Vries JW, Trucksess MW, Jakson LS (eds.). Mycotoxins and Food Safety. New York: Kluwer Academic/Plenum Publishers. pp. 19–27.
- ^ Joffe AZ (1950). Toxicity of fungi on cereals overwintered in the field: on the etiology of alimentary toxic aleukia (Ph.D.). Leningrad: Inst. Bot. Acad. Sci. p. 205.
- ^ Rocha O, Ansari K, Doohan FM (April 2005). "Effects of trichothecene mycotoxins on eukaryotic cells: a review". Food Additives and Contaminants. 22 (4): 369–78. doi:10.1080/02652030500058403. PMID 16019807. S2CID 1534222.
- ^ Heyndrickx A, Sookvanichsilp N, Van den Heede M (1984). "Detection of trichothecene mycotoxins (yellow rain) in blood, urine and faeces of Iranian soldiers treated as victims of a gas attack". Archives Belges = Belgisch Archief. Suppl: 143–6. PMID 6535464.
- ^ Mirocha CJ, Pawlosky RA, Chatterjee K, Watson S, Hayes W (November 1983). "Analysis for Fusarium toxins in various samples implicated in biological warfare in Southeast Asia". Journal of the Association of Official Analytical Chemists. 66 (6): 1485–99. PMID 6643363.
- ^ Spyker MS, Spyker DA (October 1983). "Yellow rain: chemical warfare in Southeast Asia and Afghanistan". Veterinary and Human Toxicology. 25 (5): 335–40. PMID 6636506.
- ^ Wannemacher JR, Wiener SL. "Chapter 34,: Trichothecene Mycotoxins". In Sidell FR, Takafuji ET, Franz DR (eds.). Medical Aspects Of Chemical And Biological Warfare. Textbook of Military Medicine series. Office of The Surgeon General, Department of the Army, United States of America.
- ^ Haig AM (March 22, 1982). Special Report 98: Chemical Warfare in Southeast Asia and Afghanistan: Report to the Congress from Secretary of State Haig (Report). Washington, DC: US Government Printing Office.
- ^ Tucker JB (2001). "The yellow rain controversy: lessons for arms control compliance". Nonproliferation Rev. 8: 25–39. doi:10.1080/10736700108436836. S2CID 22473397.
- ^ "CNS - Obtain Microbial Seed Stock for Standard or Novel Agent". webarchive.loc.gov. Archived from the original on 2001-11-27. Retrieved 2018-05-06.
- ^ Dohnal V, Jezkova A, Jun D, Kuca K (January 2008). "Metabolic pathways of T-2 toxin". Current Drug Metabolism. 9 (1): 77–82. doi:10.2174/138920008783331176. PMID 18220574.
- ^ Zain, Mohamed E. (2011-04-01). "Impact of mycotoxins on humans and animals". Journal of Saudi Chemical Society. 15 (2): 129–144. doi:10.1016/j.jscs.2010.06.006. ISSN 1319-6103.
- ^ Schollenberger M, Müller HM, Ernst K, Sondermann S, Liebscher M, Schlecker C, Wischer G, Drochner W, Hartung K, Piepho HP (October 2012). "Occurrence and distribution of 13 trichothecene toxins in naturally contaminated maize plants in Germany". Toxins. 4 (10): 778–87. doi:10.3390/toxins4100778. PMC 3496988. PMID 23162697.
- ^ Leeson S, Dias GJ, Summers JD (1995). "Tricothecenes". Poultry Metabolic Disorders. Guelph, Ontario, Canada. pp. 190–226.
- ^ Hesseltine CW, Shotwell OL, Smith M, Ellis JJ, Vandegraft E, Shannon G (1970). "Production of various aflatoxins by strains of the Aspergillis flavus series.". Proc. first US–Japan Conf. Toxic Microorg. Washington.
- ^ Dudeja P, Gupta RK, Minhas AS (eds.). Food Safety in the 21st Century: Public Health Perspective.
- ^ Brasel TL, Douglas DR, Wilson SC, Straus DC (January 2005). "Detection of airborne Stachybotrys chartarum macrocyclic trichothecene mycotoxins on particulates smaller than conidia". Applied and Environmental Microbiology. 71 (1): 114–22. Bibcode:2005ApEnM..71..114B. doi:10.1128/AEM.71.1.114-122.2005. PMC 544211. PMID 15640178.
- ^ Cho S, Seo S, Schmechel D, Grinshpun SA, Reponen T (September 2005). "Aerodynamic characteristics and respiratory deposition of fungal fragments". Atmospheric Environment. 39 (30): 5454–5465. Bibcode:2005AtmEn..39.5454C. doi:10.1016/j.atmosenv.2005.05.042.
- ^ Beasley VR, ed. (1989). Tricothecene Mycotoxicosis: Pathophysiologic Effects. Vol. 1. Boca Raton: CRC Press. pp. 1–26.
- ^ Ueno Y, Ishii K, Sakai K, Kanaeda S, Tsunoda H (1972). "Toxicological approaches to the metabolites of Fusaria. IV. Microbial survey on "bean-hulls poisoning of horses" with the isolation of toxic trichothecenes, neosolaniol and T-2 toxin of Fusarium solani M-1-1". Japanese J. Exp. Med. 42 (3): 187–203. PMID 4538152.
- ^ Lou XY (1988). "Fusarium toxins contamination of cereals in China". Proc. Japanese Assoc. Mycotoxicology. Suppl. 1: 97–98.
- ^ Skrinjar M, Danev M, Dimic G (1995). "Investigation on the presence of toxigenic fungi and aflatoxins in raw milk". Acta Aliment. 24: 395–402.
- ^ Russell L, Cox DF, Larsen G, Bodwell K, Nelson CE (January 1991). "Incidence of molds and mycotoxins in commercial animal feed mills in seven midwestern states, 1988-1989". Journal of Animal Science. 69 (1): 5–12. doi:10.2527/1991.6915. PMID 1825995.
- ^ Naumov NA (1916). "Intoxicating bread". Min. Yeml. (Russia), Trudy Ruiri Miwel. I. Fitopatol. Uchen, Kom.: 216.
- ^ Dounin M (1930). "The fusariosis of cereal crops in European-Russia in 1923". Phytopathol. 16: 305–308.
- ^ Ranjan KS, Sinha AK (1991). "Occurrence of mycotoxigenic fungi and mycotoxins in animal feed from bihar, India". Journal of the Science of Food and Agriculture. 56 (1): 39–47. doi:10.1002/jsfa.2740560105.
- ^ Phillips SI, Wareing PW, Dutta A, Panigrahi S, Medlock V (1996-01-01). "The mycoflora and incidence of aflatoxin, zearalenone and sterigmatocystin in dairy feed and forage samples from Eastern India and Bangladesh". Mycopathologia. 133 (1): 15–21. doi:10.1007/BF00437094. ISSN 0301-486X. S2CID 32084324.
- ^ Dhand NK, Joshi DB, Jand SK (1998). "Aflatoxins in dairy feeds/ingredients". Ind. J. Anim. Nutr. 15: 285–286.
- ^ Vasanthi S, Bhat RV (November 1998). "Mycotoxins in foods--occurrence, health & economic significance & food control measures". The Indian Journal of Medical Research. 108: 212–24. PMID 9863277.
- ^ a b c d "T-2 TOXIN - National Library of Medicine HSDB Database". toxnet.nlm.nih.gov. Retrieved 2018-05-07.
- ^ Edrington TS, Kubena LF, Harvey RB, Rottinghaus GE (September 1997). "Influence of a superactivated charcoal on the toxic effects of aflatoxin or T-2 toxin in growing broilers". Poultry Science. 76 (9): 1205–11. doi:10.1093/ps/76.9.1205. PMID 9276881.
- ^ Hoehler D, Marquardt RR (December 1996). "Influence of vitamins E and C on the toxic effects of ochratoxin A and T-2 toxin in chicks". Poultry Science. 75 (12): 1508–15. doi:10.3382/ps.0751508. PMID 9000276.
- ^ Stoev SD (March 2015). "Foodborne mycotoxicoses, risk assessment and underestimated hazard of masked mycotoxins and joint mycotoxin effects or interaction". Environmental Toxicology and Pharmacology. 39 (2): 794–809. doi:10.1016/j.etap.2015.01.022. PMID 25734690.
- ^ a b c Devreese M, De Backer P, Croubels S (2013). "Different methods to counteract mycotoxin production and its impact on animal health". Vlaams Diergen Tijds. 82 (4): 181–190. doi:10.21825/vdt.v82i4.16695.
- ^ Young JC, Zhu H, Zhou T (March 2006). "Degradation of trichothecene mycotoxins by aqueous ozone". Food and Chemical Toxicology. 44 (3): 417–24. doi:10.1016/j.fct.2005.08.015. PMID 16185803.
- ^ Die Chemie der Kampfstoffe, GDR 정부출판, 1988