주변기호
Peripherin| PRPH | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||||||||||||||||||
| 별칭 | PRPH, NEF4, PRPH1, 주변 장치 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 170710 MGI: 9774 호몰로진: 4559 GeneCard: PRPH | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) |
| ||||||||||||||||||||||||
| 위치(UCSC) | Chr 12: 49.29 – 49.3Mb | Cr 15: 99.06 – 99.06Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
주변성 단백질은 주로 말초신경계의 뉴런에서 발현되는 타입 III의 중간 필라멘트 단백질이다. 중추신경계의 뉴런에서도 척수 운동 뉴런과 같이 말초 구조를 향해 돌출되어 있는 것이 발견된다. 단백질 모티브의 크기, 구조, 염기서열/위치는 데스민, 비멘틴, 글라이알 섬유산성 단백질과 같은 다른 타입 III 중간 필라멘트 단백질과 유사하다. 이러한 단백질과 마찬가지로 주변기기도 자가조립하여 동종 고분자 필라멘트 네트워크(주변기 단백질 디머로 형성된 망막)를 형성할 수 있지만, 여러 뉴런 유형의 신경필름과 이질적으로 결합할 수도 있다. 인간의 이 단백질은 PRPH 유전자에 의해 암호화된다.[5][6] 주변기기는 발달 중 뉴런 연신증, 부상 후 축 재생 등에 역할을 하는 것으로 생각되지만 정확한 기능은 알려져 있지 않다. 또한 편향성 측경화증(ALS)을 특징짓는 주요 신경병리학 일부와도 관련이 있지만, 신경필름과 주변인 등이 ALS에 어떻게 기여하는지에 대한 광범위한 연구에도 불구하고, 이 질병에서 이들의 역할은 여전히 확인되지 않고 있다.[7]
역사
1984년에 처음 그렇게 이름 붙여진 주변 장치는 1990년 이전에 57 kDa 뉴런 중간 필라멘트로도 알려져 있었다. 1987년, 두 번째로 주변에 위치한 망막봉 단백질에도 주변기라는 이름이 붙여졌다. 이 두 번째 단백질을 구별하기 위해 망막 질환의 위치와 역할을 위해 주변기 2 또는 주변기/RDS(망막 퇴화 느림)로 지칭한다.[8]
구조 및 특성
주변 장치는 신경블라스토마 세포 라인과 쥐의 페로모사이토마 세포에서 주요 중간 필라멘트로 발견되었다. 유전자 구조와 코딩 순서에 따라 비멘틴, 글라이알 섬유산성 단백질, 데스민 등의 호몰로지 때문에 타입 III 중간 필라멘트 단백질로 분류된다.[9] 모든 중간 필라멘트 단백질은 세 개의 주요 영역으로 구성된 공통의 2차 구조를 공유하며, 그 중 가장 많이 보존된 영역은 중심 α-헬리컬 로드 영역이다. 이 중앙 코일은 비헬리컬 헤드(N-단자) 및 테일(C-단자) 도메인으로 덮혀 있다. α-헬리컬 로드 영역은 소수성 아미노산의 반복적인 세그먼트를 포함하며, 7개의 아미노산 세트의 모든 세트의 첫 번째와 네 번째 잔여물은 보통 극성이 아니다. 이 특정한 구조는 두 개의 중간 필라멘트 폴리펩타이드들이 서로 결합하여 "수소성 밀봉"[10]을 만들 수 있게 한다. 또한 막대에는 4개의 아미노산이 간격을 두고 있는 많은 산성과 기본 잔류물이 교대로 배치되어 있다. 이 간격은 이온 염교 형성에 최적이며, 이는 차내 상호작용을 통해 α-헬리컬 막대를 안정화시키는 역할을 한다.[10] 차내 소금 교량에서 체인 간 이온 연결로 전환하면 코일형 조광기를 안정화하기 위해 정전기 교호작용을 활용하여 중간 필라멘트 조립을 지원할 수 있다.[10] 중간 필라멘트 단백질의 머리와 꼬리 부위는 길이와 아미노산 성분에 따라 다르며, 꼬리 부위에서 길이의 차이가 더 크다.[10]
주변기기는 케라틴 IF와 달리 자가조립이 가능하고 균일폴리머로 존재한다(중합체 참조). 그들은 또한 중간 필라멘트 네트워크를 형성하기 위해 다른 타입 III 단백질이나 가벼운 신경필름 소단위(NF-L)와 이질화하거나 공동조립할 수 있다.[10] 주변장치와 같은 타입 III 단백질은 세포 내의 다른 상태에 존재할 수 있다. 이 상태들은 단단하고 짧은 IFs, 또는 찌그러짐과 결합하는 비필라멘틱 입자를 포함한다. 이 찌부러기들은 세포골격계 네트워크를 구성하는 긴 IF를 형성하기 위해 모인다.[11] 섬유화합물 확산과 신경세포 분화에서의 네트워크 조립에 관한 연구는 입자가 키네신과 다이네인에 의존하는 방식으로 미세관관을 따라 이동하며, 확산이 계속됨에 따라 입자가 중간 필라멘트로 중합된다는 것을 보여준다.[11]
주종인 57 kDa 외에 생쥐에서 두 가지 다른 형태가 확인되었다. 61번과 56번. 이 두 가지 대안은 모두 대체 스플라이싱에 의해 만들어진다. per 61은 주변기기의 α-헬리컬 로드 영역의 코일 2b 내에 32개의 아미노산 삽입을 도입하여 생성된다. 56개 당은 주변기 유전자의 exon 9에 있는 수용체에 의해 만들어지며, 이는 지배적인 57 형태에서 발견된 21개의 아미노산 염기서열을 새로운 8개의 아미노산 염기서열로 대체하고 프레임시프트를 유도한다. 이 두 가지 대체적인 형태의 주변기기의 기능은 알려져 있지 않다. 57과 56은 보통 공동 발현되는 반면, 61은 성인의 운동 신경세포에서 정상적인 주변기기 발현에서는 발견되지 않는다.[12]
조직 분포
주변성은 세포 몸체와 말초신경계 내 신경세포의 축에 넓게 표현된다. 여기에는 작은 크기의 뿌리 갱년기 뉴런, 하부 운동 뉴런, 두개골 신경의 감각과 운동 뉴런, 갱년기 및 장신경계의 자율 뉴런 등이 포함된다. 그것은 또한 말초적인 구조를 향해 돌출되어 있는 작은 뇌계와 척수 뉴런의 집합에서 중추신경계에 표현된다. 이러한 구조들 중에는 대뇌피질 내에 있는 저체질 마그노세포핵, 폰틴 콜린거핵, 일부 소뇌핵, 산란된 뉴런 등이 있다.[8] 그것들은 또한 복측 경음기 뉴런과 콜린거성 후측골격(LDT) 및 페둔쿨로폰틴(PPPT) 핵에서도 발견될 수 있다.[13]
쥐의 후측 시상하부와 측측 시상하부의 주변인 발현 비교에서는 후측 시상하부에서 60배 높은 발현을 보였다. 이 높은 표현은 생쥐 후측 시상하부의 결핵성 신경세포에 주변성이 존재하기 때문이다.[13]
함수
보존된 미세관 및 액틴 필라멘트 단백질과 비교하여 중간 필라멘트의 다양한 성질은 다른 세포 유형의 분자 모양을 구별하는 데 책임이 있을 수 있다. 예를 들어 신경세포에서 다른 유형의 IF의 표현은 발달 중 형상변화와 관련이 있다. 뉴런의 초기 발달 단계는 세포 비대칭 형상에 기여하는 뉴런과 액손의 발육에 의해 두드러진다. 이러한 세포 형상의 전환 중에는 주변기기가 있는 것과 같은 호모폴리머 타입 III 중간 필라멘트만 만들어진다. 신경 세포가 성숙함에 따라, 이러한 타입 III IFs는 정상적인 행동 전위의 속도를 얻기 위해 축의 직경을 확장하는 보다 복잡한 타입 IV 신경필름으로 대체된다.[14]
주변기기의 정확한 기능은 알려져 있지 않다. 개발 중인 주변부의 발현이 축 성장기에 가장 크고 산후에 감소하는데, 이는 발달 중 뉴런의 신장 및 축 유도에서 역할을 시사한다. 운동 신경세포의 말초절개술, 등근골신경절개술 등 축손상 후 발현도 증가한다. 이 상향 조정은 주변기가 액손 재생에도 역할을 할 수 있음을 암시한다.[13] 그러나, 주변기기가 고갈된 PC12 세포와 주변기기 녹아웃 생쥐를 사용한 실험은 대다수의 뉴런들이 축 방향과 역행의 주변기기를 필요로 하지 않는다는 증거를 제공한다. 주변기질이 부족한 PC12 세포는 뉴런의 발육에 결함이 없고 주변기형 녹아웃 생쥐는 해부학적 이상이나 다른 표현형 없이 정상적으로 발달한다.[9] 이러한 실험에서 주변기기 결핍은 이 타입 IV 중간 필라멘트가 주변기기 손실을 보충할 가능성을 나타내는 α-internexin의 상향 조절을 생성했다. 주변인과 α-internexin 유전자를 위한 이중 녹아웃 생쥐에 대한 향후 연구는 이 이론을 다룰 수 있을 것이다.[9] 그러나, 대부분의 주변성 녹아웃 생쥐는 정상적인 뉴런 성장을 보였지만, 그것의 부재는 미염색 감각 축의 일부의 발달에 영향을 미쳤다. 이러한 생쥐에서는 "강좌 IB4의 결합 감소와 상관관계가 있는 L5 미면조 감각 섬유의 수가 34% 감소하였다."[9]
유전자(PRPH)
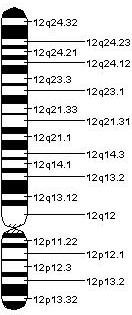
인간(GenBank L14565), 랫드(GenBank M26232) 및 마우스(EMBL X59840) 주변 유전자(PRPH)의 전체 순서가 보고되었으며 지금까지 설명한 보완 DNA(cDNA)는 랫드, 마우스, 제노푸스 주변기기에 대한 것이다.[8] 현장 교배 절차 중 마우스 cDNA 프로브를 사용하면 마우스 15번 염색체의 E-F 영역과 인간 12번 염색체의 q12-q13 영역에 PRPH 유전자를 국산화시킬 수 있었다.[6]
주변 유전자의 전체적인 구조는 8개의 인트로 분리된 9개의 엑손이다. 이 구성은 주변부 코딩이 알려진 세 가지 알려진 포유류 종, 즉 사람, 쥐, 쥐 중에서 보존된다. 인간과 쥐 엑손의 뉴클레오티드 염기서열은 90%가 동일했고 아미노산 잔류물 475개 중 18개에서 차이가 나는 예측 단백질을 생성했다. 인트론 1과 2의 비교도 보존된 세그먼트의 높은 동질성을 산출했다. 5'의 옆구리 부위와 규제 순서도 매우 유사했으며 신경 성장 인자 음의 규제 요소, Hox 단백질(See Hox gene) 결합 부위, 열충격 요소가 알려진 모든 주변 유전자에서 발견되었다.[15]
규제 메커니즘
주변기기 규제에는 신경성장인자(NGF)가 큰 역할을 한다. PC12와 신경블라스토마 세포에서 주변기기 발현에 대한 전사유도제 및 변환 후 조절제다. NGF 유도 활성화 메커니즘은 TATA 박스 및 기타 업스트림 요소와 관련된 5' 옆면 요소 및 내부 시퀀스를 통해 발생하며 음극 요소에서의 우울증도 포함된다. 생체 내 주변기기 발현을 조절하는 특정 신호는 알려져 있지 않다. 주변 유전자는 E10일쯤 등근의 등근성 신경세포의 작은 감각 신경세포와 큰 크기의 감각 신경세포에서 모두 전사적으로 활성화되며, mRNA는 산후 2일 이후와 성인기 전반에 걸쳐 이들 세포에 존재한다. 사후 전사 메커니즘은 검출 가능한 주변장치를 작은 크기의 세포로만 감소시키지만, 등뿌리 갱년기 뉴런의 주변 과정을 파쇄하면 mRNA와 큰 크기의 세포에서 검출 가능한 주변장치로 이어진다.[8]
또한 JAK-STAT 신호 경로를 통해 소염 시토킨, 인터루킨-6 및 백혈병 억제 인자 또한 주변기기의 발현을 유도할 수 있다. 이 특정한 상향 조정은 뉴런 재생과 연관되어 있다.[12]
근위축성 측경화증의 병원생성에 있어 잠재적인 역할
단백질과 신경필라멘탈 골재는 진행성 치명적인 신경퇴행성 질환인 근위축성 측경화증 환자의 특징이다. 특히 신경 중간 필라멘트의 단백질 골재인 스피로이드는 근위축성 측경화증 환자에게서 발견되었다. 주변 장치는 다른 신경 질환의 다른 신경필름과 연계하여 그러한 신경영양체에서 발견되어 주변 인체가 근위축성 측경화증의 병원생성에 역할을 할 수 있음을 시사한다.[7]
대체 스플라이싱
풍부한 주변기기 형태에서 분리되는 영역인 intron 4를 포함하는 다른 분할된 마우스 주변기기 변종이 확인되었다. 판독 프레임의 변화 때문에 이 변형은 더 큰 형태의 주변기기를 생산한다(Per61). 인간 주변기기에서는 풍부한 주변기기 단백질 형태에서 유사하게 쪼개진 영역인 인트론 3과 4를 포함하면 잘린 주변기기 단백질(Per28)이 생성된다. 두 경우 모두 인트론 영역에 의해 코딩된 펩타이드에 특유한 항체가 근위축성 측경화증의 영향을 받는 조직의 필라멘트 포함에 얼룩졌다. 이러한 연구들은 그러한 대체적인 스플라이싱이 질병에 대한 역할을 할 수 있고 추가적인 조사에 도움이 될 수 있음을 시사한다.[7]
돌연변이
쥐의 주변기기 과대압압을 검사하는 실험에서는 PRPH 돌연변이가 근위축성 측경화증의 병원체 생성에 역할을 하고 있으며, 최근 연구에서 그러한 돌연변이가 인간에게 퍼지는 것을 조사하였다. 많은 다형성 PRPH 변형이 존재하지만, 두 변종의 PRPH가 ALS 환자들에게서 독특하게 보여졌는데, 두 변형은 모두 프레임-변형으로 구성되었다. 첫 번째 변종에서, PRPH의 exon 1에서 단일 염기쌍 삭제는 85개의 아미노산으로 잘린 주변성 종을 예측했다. 이러한 절단은 신경필라멘트 네트워크의 조립 능력에 부정적인 영향을 미쳤으며, 따라서 PRPH의 돌연변이가 적어도 인간의 근위축성 측경화증 환자 중 소수에 역할을 할 수 있음을 시사한다.[16]
두 번째 변종은 exon 1의 단일 점 돌연변이의 결과로 아스파르테이트에서 티로신까지 아미노산 치환으로 구성되었다. 이는 신경필름망 조립에도 악영향을 미치는 것으로 나타났다. 근위축성 측경화증에서 관찰된 PRPH 돌연변이는 단백질의 3D 구조에 변화를 일으킨다. 결과적으로 돌연변이 주변기는 그것이 보통 형성하는 필라멘트 네트워크 대신에 골재를 형성한다.[17]
기타 임상적 중요성
주변기기는 동물에서 인슐린 의존성 당뇨병의 병리학(또는 당뇨병 타입 1)에 관여할 수 있지만, 인간 환자에게는 직접적인 연관성이 발견되지 않았다. 비오베즈 당뇨 마우스 모델에서 주변기는 알려진 자가 항원(항원 참조)으로 발견되었다. 주변기기에 반응하는 B세포 복제도 질병의 초기 단계에서 발견되었다. 주변기기는 말초신경계와 어린 동물에서 모두 섬 베타세포에 의해 발현되기 때문에 인슐린 의존성 당뇨병의 말초신경계 원소와 섬 β-세포가 모두 파괴되는 것은 자가 활성 주변기기에 대한 면역 반응 때문일 가능성이 있다.[13]
퍼데버틴은 또한 허쉬스프룽병의 결정적인 진단에도 역할을 할 수 있다. 이 병에 걸린 것으로 의심되는 환자들은 갱년기 세포의 유무를 확인하기 위해 직장 조직검사를 받는다. 그러나 이러한 세포의 식별은 매우 어려울 수 있으며, 특히 미성숙 갱년기 세포가 내피, 중피, 염증 세포와 혼동되기 쉬운 신생아에서는 더욱 그러하다. 식별을 돕기 위해, 직장 생물학에서 갱리온 세포의 인식을 돕기 위해 주변기기와 S-100 면역화학 얼룩을 이용하는 프로토콜이 개발되었다.[18]
잠재적 응용 프로그램
신경퇴행성질환에 주변기기와 같은 중간 필라멘트의 관여 가능성을 현재 조사 중이다. 중간 필라멘트와 다른 단백질 간의 상호작용도 추구되고 있다. 퍼스펙틴은 단백질 키나제 Cε과 연관되어 그 집적을 유도하고 세포사멸의 증가를 초래하는 것으로 나타났다. siRNA와 단백질 키나아제 Cε을 이용하여 이 집적과 사멸을 조절하는 것이 가능할 수 있다.[19] 단백질 골재의 출처와 가능한 분해능을 정확히 파악하는 것이 잠재적 치료법의 전도유망한 방향이다.[7]
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000135406 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000023484 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Entrez Gene: Peripherin".
- ^ a b Moncla A, Landon F, Mattei MG, Portier MM (April 1992). "Chromosomal localisation of the mouse and human peripherin genes". Genetical Research. 59 (2): 125–9. doi:10.1017/s0016672300030330. PMID 1378416.
- ^ a b c d Liem RK, Messing A (July 2009). "Dysfunctions of neuronal and glial intermediate filaments in disease". The Journal of Clinical Investigation. 119 (7): 1814–24. doi:10.1172/JCI38003. PMC 2701870. PMID 19587456.
- ^ a b c d Vale, Ronald; Kreis, Thomas (1999). Guidebook to the Cytoskeletal and Motor Proteins (2nd ed.). Sambrook & Tooze Partnership.
- ^ a b c d Larivière RC, Nguyen MD, Ribeiro-da-Silva A, Julien JP (May 2002). "Reduced number of unmyelinated sensory axons in peripherin null mice". Journal of Neurochemistry. 81 (3): 525–32. doi:10.1046/j.1471-4159.2002.00853.x. PMID 12065660. S2CID 15737750.
- ^ a b c d e Fuchs E, Weber K (1994). "Intermediate filaments: structure, dynamics, function, and disease". Annual Review of Biochemistry. 63: 345–82. doi:10.1146/annurev.bi.63.070194.002021. PMID 7979242.
- ^ a b Chang L, Shav-Tal Y, Trcek T, Singer RH, Goldman RD (February 2006). "Assembling an intermediate filament network by dynamic cotranslation". The Journal of Cell Biology. 172 (5): 747–58. doi:10.1083/jcb.200511033. PMC 2063706. PMID 16505169.
- ^ a b Xiao S, McLean J, Robertson J (2006). "Neuronal intermediate filaments and ALS: a new look at an old question". Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1762 (11–12): 1001–12. doi:10.1016/j.bbadis.2006.09.003. PMID 17045786.
- ^ a b c d Eriksson KS, Zhang S, Lin L, Larivière RC, Julien JP, Mignot E (2008). "The type III neurofilament peripherin is expressed in the tuberomammillary neurons of the mouse". BMC Neuroscience. 9: 26. doi:10.1186/1471-2202-9-26. PMC 2266937. PMID 18294400.
- ^ Chang L, Goldman RD (August 2004). "Intermediate filaments mediate cytoskeletal crosstalk". Nature Reviews. Molecular Cell Biology. 5 (8): 601–13. doi:10.1038/nrm1438. PMID 15366704. S2CID 31835055.
- ^ Foley J, Ley CA, Parysek LM (July 1994). "The structure of the human peripherin gene (PRPH) and identification of potential regulatory elements". Genomics. 22 (2): 456–61. doi:10.1006/geno.1994.1410. PMID 7806235.
- ^ Gros-Louis F, Larivière R, Gowing G, Laurent S, Camu W, Bouchard JP, Meininger V, Rouleau GA, Julien JP (October 2004). "A frameshift deletion in peripherin gene associated with amyotrophic lateral sclerosis". The Journal of Biological Chemistry. 279 (44): 45951–6. doi:10.1074/jbc.M408139200. PMID 15322088.
- ^ Leung CL, He CZ, Kaufmann P, Chin SS, Naini A, Liem RK, Mitsumoto H, Hays AP (July 2004). "A pathogenic peripherin gene mutation in a patient with amyotrophic lateral sclerosis". Brain Pathology. 14 (3): 290–6. doi:10.1111/j.1750-3639.2004.tb00066.x. PMC 8095763. PMID 15446584. S2CID 43439366.
- ^ Holland SK, Hessler RB, Reid-Nicholson MD, Ramalingam P, Lee JR (September 2010). "Utilization of peripherin and S-100 immunohistochemistry in the diagnosis of Hirschsprung disease". Modern Pathology. 23 (9): 1173–9. doi:10.1038/modpathol.2010.104. PMID 20495540.
- ^ Sunesson L, Hellman U, Larsson C (June 2008). "Protein kinase Cepsilon binds peripherin and induces its aggregation, which is accompanied by apoptosis of neuroblastoma cells". The Journal of Biological Chemistry. 283 (24): 16653–64. doi:10.1074/jbc.M710436200. PMID 18408015.