내부 압력
Internal pressure내부 압력은 일정한 온도에서 팽창하거나 수축할 때 시스템의 내부 에너지가 어떻게 변하는지 나타내는 척도다. 압력과 동일한 치수를 가지며 의 SI 단위는 파스칼이다.
내부 압력은 보통 기호가 주어진다 일정한 온도에서 부피와 관련하여 내부 에너지의 부분적인 파생어로 정의된다.
열역학적 상태 방정식
내부 압력은 온도, 압력 및 상호의존성 측면에서 표현될 수 있다.
이 방정식은 가장 간단한 열역학 방정식 중 하나이다. 보다 정확히 말하면, 열역학적 특성 관계인데, 이는 어떤 시스템에서도 참이 되며 상태 방정식을 하나 이상의 열역학적 에너지 특성에 연결하기 때문이다. 여기서 우리는 이것을 "열역학적 상태의 방정식"이라고 부른다.
상태 열역학 방정식의 도출 기본 열역학 방정식은 내부 에너지의 정확한 차이에 대해 다음과 같이 설명한다. 이 방정식을 일정한 에서 V 으)로 나누면 다음과 같은 결과를 얻을 수 있다.
그리고 맥스웰 관계 중 를 사용: ( V) T= ( ) {\ S 그러면 T= ( T) V- 가 제공됨
퍼펙트 가스
완벽한 기체에서는 입자 사이에 잠재적인 에너지 상호작용이 없기 때문에 기체의 내부 에너지의 변화는 구성 종의 운동에너지의 변화에 정비례하며 따라서 온도 변화에도 정비례한다.
{U\ {.
따라서 내부 압력은 일정한 온도로 측정된다.
= 즉 d U= 0 으로 and =
즉, 완벽한 가스의 내부 에너지는 그것이 차지하는 부피와 무관하다. 위의 관계는 완벽한 가스의 정의로 사용될 수 있다.
관계 T = {\ _은(는) 분자 인수를 호출할 필요 없이 증명할 수 있다. 이상적인 가스 법칙 = n 을를) 사용하는 경우 상태의 열역학 방정식에서 직접 따라온다.
실가스
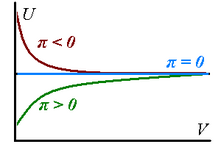
왜냐하면 그들의 내부 에너지 변화로 가스들은 등온선상. 확대되고 있어 진정한 가스-확장(π T>0{\displaystyle \pi_{T}>0}일 경우, 지배적인 매력적인 힘의 입자 사이에는 가스의signifying 존재)에 또는 감소시키(π T<0{\displaystyle \pi_{T}<0}을 증가시킬 수 있는 0이 아닌 내부 압력이 있다. 아무도,dominant맥박
무한 확장 볼륨의 한계에서 이러한 내부 압력은 0의 값에 도달한다.
→ ∞ =
모든 실제 가스는 적절한 양의 한도에서 완벽하다고 대략 추정할 수 있다는 사실에 대응한다. 위의 고려사항은 오른쪽 그래프에 요약되어 있다.
만약 실제 가스가 주의 반 데르 발스 방정식으로 설명될 수 있다면
그것은 열역학적 상태의 방정식에서 다음과 같다.
매개 변수 은 항상 양성이므로 내부 압력도 양성이므로 반데르발 가스의 내부 에너지는 항상 반대로 팽창할 때 증가한다.
는 기체 내 분자 사이의 매력적인 힘의 영향을 모델링한다. 그러나 실제 비이상적 기체는 관심 시스템에 따라 혐오적 상호작용이 중요해지면 적절한 환경 조건에서 양압과 음압의 내부 압력 사이의 신호 변화를 보일 것으로 예상할 수 있다. 느슨하게 말하면, 이것은 기체의 압축 계수가 1보다 큰 조건 하에서 일어나는 경향이 있다.
또한 오일러 체인 관계를 이용하여 다음과 같은 것을 보여줄 수 있다.
= ( ) 을(를 "Joule 계수"로 인식 및 인식 u T ) {\ U T한 체적에서의 열 용량= V
계수 는 일정한 실험의 온도 변화를 측정하여 얻을 수 있다(아래 참조). 이 계수는 종종 작으며 보통 적당한 압력에서 음수(van der Wals 방정식으로 예측)이다.
줄 실험
제임스 줄(James Joule)은 팽창 실험에서 한 금속 용기에서 다른 진공 용기로 고압 공기를 극적으로 펌핑하여 공기 내부 압력을 측정하려고 했다. 시스템이 담근 수조는 온도를 바꾸지 않아 내부 에너지에 변화가 없었다는 것을 의미한다. 따라서 공기의 내부 압력은 분명히 0과 같았고 공기는 완벽한 기체 역할을 했다. 완벽한 거동으로부터의 실제 편차는 매우 작고 물의 특정 열 용량이 상대적으로 높기 때문에 관찰되지 않았다.
참조
Peter Atkins and Julio de Paula, 물리 화학 8판, 페이지 60-61
- ^ J. Westin, A Course in Thermodynamics, 1권, Taylor and Francis, New York (1979년)

























 and
and 







 체적에서의 열 용량
체적에서의 열 용량