로바스타틴
Lovastatin | |
 | |
| 임상 데이터 | |
|---|---|
| 상호 | 메바코르, 알토코르, 기타 |
| 기타 이름 | 모나콜린 K, 메비놀린 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a688006 |
| 라이선스 데이터 |
|
| 루트 행정부. | 입으로 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 |
|
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 5%[1] 미만 |
| 단백질 결합 | 98%[1] 이상 |
| 대사 | 간(CYP3A 및 CYP2C8 기질)[1] |
| 반감기 제거 | 2~5시간[1] |
| 배설물 | 대변(83%), 소변(10%)[1] |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.115.931 |
| 화학 및 물리 데이터 | |
| 공식 | C24H36O5 |
| 몰 질량 | 404.547 g/120−1 |
| 3D 모델(JSmol) | |
| |
| |
| (표준) | |
메바코르라는 상표명으로 판매되는 로바스타틴은 고혈중 콜레스테롤을 치료하고 심혈관 [2]질환의 위험을 줄이기 위한 스타틴 약물이다.생활습관 변화와 [2]함께 사용하는 것이 좋습니다.입으로 [2]먹는 거예요.
일반적인 부작용으로는 설사, 변비, 두통, 근육통, 발진, [2]수면장애 등이 있다.심각한 부작용에는 간 질환, 근육 쇠약, [2]신부전이 포함될 수 있다.임신 중 사용은 아기에게 해를 끼칠 수 있으며 모유 수유 [3]중 사용은 권장되지 않습니다.그것은 HMG-CoA 환원효소를 [2]차단함으로써 간의 콜레스테롤 생성 능력을 감소시킴으로써 작용한다.
로바스타틴은 1979년에 특허를 받았으며 [4]1987년에 의료용으로 승인되었다.그것은 세계보건기구의 필수 [5]의약품 목록에 있다.제네릭 [2]의약품으로 구입할 수 있습니다.2019년에는 미국에서 95번째로 많이 처방된 의약품으로 800만 건 이상의 [6][7]처방을 받았다.
의료 용도
로바스타틴의 주요 용도는 이상지질혈증 치료와 심혈관 [8]질환 예방이다.다이어트, 운동, 체중 감소와 같은 다른 조치들이 콜레스테롤 [8]수치를 개선하지 않은 후에만 사용하는 것이 좋습니다.
부작용
로바스타틴은 대개 잘 견디며, 가장 흔한 부작용은 대략적인 빈도의 내림차순으로: 크레아틴 포스포키나아제 상승, 팽만감, 복통, 변비, 설사, 근육통,[9] 메스꺼움, 소화불량, 약함, 흐릿한 시야, 현기증, 근육경련이다.모든 스타틴 약물과 마찬가지로 근병증, 간독성(간 손상), 피부근염 또는 횡문근융해증을 거의 [9]유발하지 않는다.이것은 제때에 인식되고 치료되지 않으면 생명을 위협할 수 있으므로, Lovastatin을 복용하는 동안 설명되지 않은 근육통이나 허약함은 즉시 처방된 의사에게 언급되어야 한다.처방받은 의사나 응급 의료 서비스 기관에게 즉시 언급해야 하는 다른 흔치 않은 부작용은 다음과 같습니다.[10]
- 근육통, 압통 또는 쇠약함
- 기력 부족
- 약점
- 열.
- 진한 소변
- 황달: 피부 또는 눈의 황색
- 위 오른쪽 상부의 통증
- 메스꺼움
- 비정상적인 출혈 또는 멍
- 식욕 부진
- 독감 유사 증상
- 발진
- 벌집
- 가려움증
- 호흡 곤란 또는 삼키기 어려움
- 얼굴, 목, 혀, 입술, 눈, 손, 발, 발목 또는 아랫다리의 붓기
- 웅성거림
이러한 덜 심각한 부작용은 지속되거나 [10]심각도가 증가하는 경우에도 보고되어야 한다.
- 변비
- 기억 상실 또는 건망증
- 혼란
금지 사항
금기사항, 로바스타틴 치료를 보류할 수 있는 조건은 임신, 모유 수유, 간 질환을 포함한다.로바스타틴은 임신 중 금지된다(임신 범주 X). 골격 기형이나 학습 장애와 같은 선천적 기형을 일으킬 수 있다.유아 지질 대사를 방해할 수 있기 때문에 모유 [11]수유 중에 로바스타틴을 복용해서는 안 됩니다.간질환 환자는 로바스타틴을 [12]복용해서는 안 된다.
상호 작용
CYP3A4를 통해 대사되는 아토르바스타틴, 심바스타틴 및 기타 스타틴 약물과 마찬가지로, 로바스타틴 치료 중에 자몽 주스를 마시는 것은 부작용의 위험을 증가시킬 수 있다.자몽주스, 플라보노이드나린 또는 플라보노쿠마린 베르가모틴의 성분은 [13]체외에서 CYP3A4를 억제하며, 자몽주스 농축액의 생체내 효과를 설명하여 로바스타틴의 대사 클리어런스를 감소시키고 혈장 [14]농도를 높일 수 있다.
작용 메커니즘
로바스타틴은 3-히드록시-3-메틸글루타릴-코엔자임A환원효소(HMG-CoA환원효소)의 억제제로서, HMG-CoA의 [15]메발론산으로의 전환을 촉매하는 효소이다.메발론산염은 콜레스테롤 생합성에 필수적인 구성 요소이며, 로바스타틴은 HMG-CoA 환원효소에 결합하는 HMG-CoA의 가역적 경쟁 억제제 역할을 함으로써 콜레스테롤 생합성의 생산을 방해한다.로바스타틴은 프로드러그이며, 본래의 불활성 락톤이며, 이것이 투여되는 감마락톤 폐쇄 고리 형태는 생체 내에서 가수분해되어 활성 형태인 β-히드록시산 개방 고리 형태이다.
로바스타틴과 다른 스타틴은 화학 예방 및 화학 요법의 효과를 위해 연구되어 왔다.초기 [16]연구에서는 그러한 효과가 나타나지 않았다.보다 최근의 조사에서는 특정 종류의 암에 대한 화학 예방 및 치료 효과가 밝혀졌으며, 특히 스타틴과 다른 [17]항암제와의 조합에서 더욱 그러했다.이러한 효과는 프로테아솜 활성을 감소시키기 위해 스타틴의 특성에 의해 매개되어 사이클린 의존성 키나아제 억제제 p21 및 p27의 축적을 초래하고 다른 암 [18][19]라인의 세포에서 볼 수 있는 후속 G상1 정지를 초래할 수 있다.
역사
1970년대에 HMG-CoA 환원효소에 강력한 억제 효과가 있는 천연산물인 콤팩트인과 로바스타틴이 발견되어 LDL 콜레스테롤을 [21][22]낮추는 잠재적 약물로 임상 개발에 투입되었다.
1982년, 매우 고위험 환자를 대상으로 아스페르길루스 테레우스에서 분리된 폴리케티드 유래 천연물인 로바스타틴에 대한 소규모 임상 연구가 수행되었으며, LDL 콜레스테롤의 급격한 감소가 관찰되었지만 부작용은 거의 없었다.로바스타틴을 사용한 추가적인 동물 안전성 연구 결과 콤팩틴과 관련된 것으로 생각되는 유형의 독성이 발견되지 않은 후 임상 연구가 계속되었다.
대규모 실험을 통해 로바스타틴의 효과가 확인되었다.관찰된 내성이 계속 우수하여 1987년 [23]미국 FDA에 의해 로바스타틴이 승인되었다.그것은 [24]FDA에 의해 승인된 최초의 스타틴이었다.
Lovastatin은 또한 Pleurotus ostreatus와 밀접하게 연관된 Pleurotus [25]spp와 같은 특정 고등 균류에 의해 자연적으로 생성됩니다.느타리버섯과 그 추출물이 실험동물의 콜레스테롤 수준에 미치는 영향에 대한 연구는 매우 제한적인 수의 인간 [37]실험대상자들에게서 그 효과가 입증되었지만 [26][27][25][28][29][30][31][32][33][34][35][36]광범위했다.
1998년 FDA는 천연 로바스타틴이 함유된 붉은 효모 쌀에서 유래한 영양 보조식품의 [38]판매를 금지했다.판사 데일 A. 미국 유타 지방법원의 킴볼은 콜레스틴의 제조사인 파마넥스로부터 1994년 제정된 건강 및 교육법에 따라 이 제품의 판매 금지가 불법이라는 신청을 받았다. 왜냐하면 이 제품은 [39]마약이 아닌 영양 보조 식품으로 판매되었기 때문이다.
목표는 콜레스테롤의 과잉 수치를 정상 신체 기능의 유지와 일치하는 양으로 줄이는 것입니다.콜레스테롤은 아세틸-CoA 단위의 연속 세 개의 연속적인 축합을 수반하여 6탄소 화합물 3-히드록시-3-메틸글루타릴 코엔자임 A(HMG CoA)를 형성하는 25개 이상의 개별 효소 반응에서 생합성된다.이는 메발론산염으로 환원된 후 스테롤의 직접적인 전구체인 스쿠알렌의 구성 블록인 이소프레네에 대한 일련의 반응으로 전환되며, 스테롤은 라노스테롤(메틸화 스테롤)로 환산되고 콜레스테롤로 더욱 대사됩니다.콜레스테롤 합성을 차단하기 위한 많은 초기 시도는 라노스테롤과 콜레스테롤 사이의 생합성 경로에서 늦게 억제되는 약물을 야기했다.경로의 주요 속도 제한 단계는 메발론산으로의 HMG CoA의 전환을 촉매하는 마이크로솜 효소 수준이며,[15] 이는 수년간 약리학적 개입의 주요 대상으로 여겨져 왔다.
HMG CoA 환원효소는 생합성 경로에서 초기에 발생하며 콜레스테롤 제형에 대한 첫 번째 커밋 단계 중 하나이다.이 효소의 억제는 더 단순한 분자로 쉽게 대사될 수 있는 수용성 중간체인 HMG CoA의 축적을 초래할 수 있다.이러한 환원효소의 억제는 포르말 스테롤 고리와 함께 리포필산 중간체의 축적을 초래할 수 있다.
로바스타틴은 고콜레스테롤혈증 치료 승인을 받은 최초의 HMG CoA 환원효소의 특이적 억제제였다.HMG CoA 환원효소의 강력하고 특이적이며 경쟁력 있는 억제제를 찾기 위한 노력의 첫 번째 돌파구는 엔도 등이 페니실륨 [40]구연 배양액에서 분리된 고기능화 진균 대사물인 메바스타틴의 발견을 보고한 1976년에 일어났다.
생합성
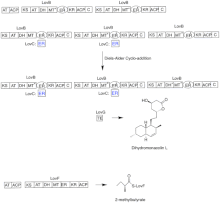
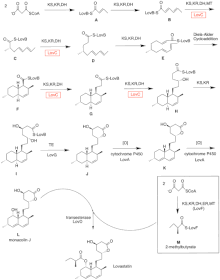
로바스타틴의 생합성은 반복형 I 폴리케타이드 합성효소(PKS) 경로를 통해 일어난다.Lovastatin의 생합성에 필수적인 효소를 코드하는 6개의 유전자는 lovB, lovC, lovA, lovD, lovG, 그리고 [41][42]lovF입니다.디히드로모나콜린 L의 합성에는 총 9-말로닐 Coa가 [41]필요하다.이는 (E) 헥사케타이드까지 PKS 경로를 진행하며, 여기서 Diels-Alder 사이클로드디션을 거쳐 융합 고리를 형성한다.환화 후 비아케타이드(I)에 도달할 때까지 PKS 경로를 통해 계속되며, 비아케타이드(Nonaketide)는 LovG에 의해 코드된 티오에스테라아제를 통해 LovB에서 방출된다.디히드로모나콜린 L, (J)은 LovA에 의해 코드된 시토크롬 P450 산소화효소를 통해 산화 및 탈수되어 모나콜린 J, (L)를 얻는다.
LovB로부터의 MT 도메인은 S-아데노실-L-메티오닌(SAM)에서 테트라케타이드(C)[41]로 메틸기를 전달할 때 (B)에서 (C)로의 변환에서 활성화되며, LoVB가 비활성 ER 도메인을 포함하고 있기 때문에 완전히 감소된 생성물을 얻기 위해서는 특정 단계에서 LoVC가 필요하다.LovB, LovC, LovG 및 LovF의 도메인 구성을 그림 2에 나타냅니다.lovB의 비활성 ER 도메인은 타원형으로 표시되고 LovC가 LovB로 이행할 때 동작하는 위치는 빨간색 상자로 표시됩니다.
평행경로 중 Lovastatin의 디케타이드 측쇄는 LovF에 의해 코드된 또 다른 고환원형 I 폴리케타이드 신타아제 효소에 의해 합성되며, 마지막으로 사이드체인 2-메틸부틸레이트(M)는 LoV에 의해 코드된 모나콜린J(L)의 C-8 하이드록시기(Hydroxydroxy group)에 공유 결합된다.
종합합성
Lovastatin의 합성에 대한 주요 작업의 대부분은 M에 의해 수행되었다.1980년대의 [43]히라마.[44] 히라마는 콤팩틴을 합성하여 중간체 중 하나를 사용하여 다른 경로를 따라 로바스타틴에 도달했습니다.합성 시퀀스는 다음 스킴에 나타나 있습니다.γ-락톤은 야마다 방법론을 이용하여 글루탐산을 시작으로 합성되었다.락톤 개방은 메탄올에 리튬 메톡시드를 사용한 후 시릴화를 통해 시작 락톤과 시릴 에테르를 분리할 수 있는 혼합물을 얻었다.수소 분해 시 실릴 에테르에 이어 콜린스 산화를 통해 알데히드가 생성되었다.트랜스-크로틸페닐술폰 음이온을 첨가하여 (E,E)-디엔의 입체선택적 제제를 달성한 후 AcO에2 의한 담금질 및 후속 아세트산술폰 환원제거.이를 디메틸메틸포스폰산 리튬 음이온과 축합하면 화합물 1이 된다.화합물 2는 합성 공정의 체계에 나타난 바와 같이 합성되었다.그런 다음 화합물 1과 2를 THF에서 1.3eq 수소화 나트륨을 사용한 후 질소 하에서 82시간 동안 클로로벤젠을 환류시켜 에논 3을 얻었다.
간단한 유기반응을 이용하여 스킴에 나타난 바와 같이 로바스타틴에 도달하였다.
사회와 문화
천연원
로바스타틴은 느타리버섯,[45] 붉은 효모쌀,[46] Pu-erh와 [47]같은 식품에서 저농도로 발견되는 자연적으로 발생하는 화합물이다.
브랜드명
메바코르, 어드바이저(니아신과의 조합), 알토코르, 알토프레브
기타 응용 프로그램
식물 생리학에서 로바스타틴은 때때로 사이토키닌 [48]생합성 억제제로 사용되어 왔다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d e Neuvonen, PJ; Backman, JT; Niemi, M (2008). "Pharmacokinetic comparison of the potential over-the-counter statins simvastatin, lovastatin, fluvastatin and pravastatin". Clinical Pharmacokinetics. 47 (7): 463–74. doi:10.2165/00003088-200847070-00003. PMID 18563955. S2CID 11716425.
- ^ a b c d e f g "Lovastatin Monograph for Professionals". Drugs.com. American Society of Health-System Pharmacists. Retrieved 3 March 2019.
- ^ "Lovastatin Pregnancy and Breastfeeding Warnings". Drugs.com. Retrieved 3 March 2019.
- ^ Fischer, Jnos; Ganellin, C. Robin (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 472. ISBN 9783527607495.
- ^ World Health Organization (2021). World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. hdl:10665/345533. WHO/MHP/HPS/EML/2021.02.
- ^ "The Top 300 of 2019". ClinCalc. Retrieved 16 October 2021.
- ^ "Lovastatin - Drug Usage Statistics". ClinCalc. Retrieved 16 October 2021.
- ^ a b "Lovastatin". The American Society of Health-System Pharmacists. Retrieved 3 April 2011.
- ^ a b "Mevacor, Altoprev (lovastatin) dosing, indications, interactions, adverse effects, and more". Medscape Reference. WebMD. Retrieved 17 March 2014.
- ^ a b "Lovastatin". MedlinePlus. U.S. National Library of Medicine. 15 June 2012. Retrieved 1 December 2012.
- ^ "Lovastatin". LactMed. U.S. National Library of Medicine. Retrieved 1 December 2012.
- ^ Stöppler, Melissa. "Mevacor Side Effects Center". RxList. Retrieved 1 December 2012.
- ^ Bailey DG, Malcolm J, Arnold O, Spence JD (1998). "Grapefruit juice-drug interactions". Br J Clin Pharmacol. 46 (2): 101–110. doi:10.1046/j.1365-2125.1998.00764.x. PMC 1873672. PMID 9723817.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Kantola T, Kivistö KT, Neuvonen PJ (April 1998). "Grapefruit juice greatly increases serum concentrations of lovastatin and lovastatin acid". Clin Pharmacol Ther. 63 (4): 397–402. doi:10.1016/S0009-9236(98)90034-0. PMID 9585793. S2CID 31911751.
- ^ a b Alberts AW (1998). "Discovery, biochemistry and biology of lovastatin". The American Journal of Cardiology. 62 (15): 10J–15J. doi:10.1016/0002-9149(88)90002-1. PMID 3055919.
- ^ Katz MS (2005). "Therapy insight: Potential of statins for cancer chemoprevention and therapy". Nature Clinical Practice Oncology. 2 (2): 82–9. doi:10.1038/ncponc0097. PMID 16264880. S2CID 9766310.
- ^ Chae YK, Yousaf M, Malecek MK, Carneiro B, Chandra S, Kaplan J, Kalyan A, Sassano A, Platanias LC, Giles F (2015). "Statins as anti-cancer therapy; Can we translate preclinical and epidemiologic data into clinical benefit?". Discovery Medicine. 20 (112): 413–27. PMID 26760985.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Jakóbisiak M, Bruno S, Skierski J, Darzynkiewicz Z (1991). "The cell cycle specific effects of lovastatin". Proc Natl Acad Sci USA. 88 (9): 3628–3632. Bibcode:1991PNAS...88.3628J. doi:10.1073/pnas.88.9.3628. PMC 51505. PMID 1673788.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Rao S, Porter DC, Chen X, Herliczek T, Lowe M, Keyomarsi K (July 1999). "Lovastatin-mediated G1 arrest is through inhibition of the proteasome, independent of hydroxymethyl glutaryl-CoA reductase". Proc. Natl. Acad. Sci. U.S.A. 96 (14): 7797–802. Bibcode:1999PNAS...96.7797R. doi:10.1073/pnas.96.14.7797. PMC 22141. PMID 10393901.
- ^ Alarcón J, Aguila S, Arancibia-Avila P, Fuentes O, Zamorano-Ponce E, Hernández M (January–February 2003). "Production and purification of statins from Pleurotus ostreatus (Basidiomycetes) strains". Z Naturforsch C. 58 (1–2): 62–4. doi:10.1515/znc-2003-1-211. PMID 12622228. S2CID 29392568.
- ^ Vederas JC, Moore RN, Bigam G, Chan KJ (1985). "Biosynthesis of the hypocholesterolemic agent mevinolin by Aspergillus terreus. Determination of the origin of carbon, hydrogen and oxygen by 13C NMR and mass spectrometry". J Am Chem Soc. 107 (12): 3694–701. doi:10.1021/ja00298a046.
- ^ Alberts AW, Chen J, Kuron G, Hunt V, Huff J, Hoffman C, Rothrock J, Lopez M, Joshua H, Harris E, Patchett A, Monaghan R, Currie S, Stapley E, Albers-Schonberg G, Hensens O, Hirshfield J, Hoogsteen K, Liesch J, Springer J (July 1980). "Mevinolin: a highly potent competitive inhibitor of hydroxymethlglutaryl-coenzyme A reductase and a cholesterol-lowering agent". Proc Natl Acad Sci U S A. 77 (7): 3957–61. Bibcode:1980PNAS...77.3957A. doi:10.1073/pnas.77.7.3957. PMC 349746. PMID 6933445.
- ^ 1987년 8월 31일 20mg 정제 및 1988년 12월 14일 40mg 정제 승인을 나타내는 애플리케이션 N019643의 FDA 오렌지북 상세
- ^ Endo, Akira (October 2004). "The origin of the statins". Atheroscler. Suppl. 5 (3): 125–30. doi:10.1016/j.atherosclerosissup.2004.08.033. PMID 15531285.
- ^ a b Bobek P, Ozdín L, Galbavý S (1998). "Dose- and time-dependent hypocholesterolemic effect of oyster mushroom (Pleurotus ostreatus) in rats". Nutrition. 14 (3): 282–6. doi:10.1016/S0899-9007(97)00471-1. PMID 9583372.
- ^ Hossain S, Hashimoto M, Choudhury EK, et al. (July 2003). "Dietary mushroom (Pleurotus ostreatus) ameliorates atherogenic lipid in hypercholesterolaemic rats". Clin Exp Pharmacol Physiol. 30 (7): 470–5. doi:10.1046/j.1440-1681.2003.03857.x. PMID 12823261. S2CID 39632962.
- ^ Bobek P, Galbavý S (October 1999). "Hypocholesterolemic and antiatherogenic effect of oyster mushroom (Pleurotus ostreatus) in rabbits". Nahrung. 43 (5): 339–42. doi:10.1002/(SICI)1521-3803(19991001)43:5<339::AID-FOOD339>3.0.CO;2-5. PMID 10555301.
- ^ Opletal L, Jahodár L, Chobot V, et al. (December 1997). "Evidence for the anti-hyperlipidaemic activity of the edible fungus Pleurotus ostreatus". Br. J. Biomed. Sci. 54 (4): 240–3. PMID 9624732.
- ^ Bajaj M, Vadhera S, Brar AP, Soni GL (October 1997). "Role of oyster mushroom (Pleurotus florida) as hypocholesterolemic/antiatherogenic agent". Indian J. Exp. Biol. 35 (10): 1070–5. PMID 9475042.
- ^ Bobek P, Ozdín L, Kuniak L, Hromadová M (March 1997). "[Regulation of cholesterol metabolism with dietary addition of oyster mushrooms (Pleurotus ostreatus) in rats with hypercholesterolemia]". Cas. Lek. Cesk. (in Slovak). 136 (6): 186–90. PMID 9221192.
- ^ Bobek P, Ozdín L, Kuniak L (August 1996). "Effect of oyster mushroom (Pleurotus Ostreatus) and its ethanolic extract in diet on absorption and turnover of cholesterol in hypercholesterolemic rat". Nahrung. 40 (4): 222–4. doi:10.1002/food.19960400413. PMID 8810086.
- ^ Bobek P, Ozdín O, Mikus M (1995). "Dietary oyster mushroom (Pleurotus ostreatus) accelerates plasma cholesterol turnover in hypercholesterolaemic rat". Physiol Res. 44 (5): 287–91. PMID 8869262.
- ^ Bobek P, Ozdin L, Kuniak L (1995). "The effect of oyster mushroom (Pleurotus ostreatus), its ethanolic extract and extraction residues on cholesterol levels in serum, lipoproteins and liver of rat". Nahrung. 39 (1): 98–9. doi:10.1002/food.19950390113. PMID 7898579.
- ^ Bobek P, Ozdin L, Kuniak L (March 1994). "Mechanism of hypocholesterolemic effect of oyster mushroom (Pleurotus ostreatus) in rats: reduction of cholesterol absorption and increase of plasma cholesterol removal". Z Ernahrungswiss. 33 (1): 44–50. doi:10.1007/BF01610577. PMID 8197787. S2CID 41820928.
- ^ Chorváthová V, Bobek P, Ginter E, Klvanová J (1993). "Effect of the oyster fungus on glycaemia and cholesterolaemia in rats with insulin-dependent diabetes". Physiol Res. 42 (3): 175–9. PMID 8218150.
- ^ Bobek P, Ginter E, Jurcovicová M, Kuniak L (1991). "Cholesterol-lowering effect of the mushroom Pleurotus ostreatus in hereditary hypercholesterolemic rats". Ann. Nutr. Metab. 35 (4): 191–5. doi:10.1159/000177644. PMID 1897899.
- ^ Khatun K, Mahtab H, Khanam PA, Sayeed MA, Khan KA (January 2007). "Oyster mushroom reduced blood glucose and cholesterol in diabetic subjects". Mymensingh Med J. 16 (1): 94–9. doi:10.3329/mmj.v16i1.261. PMID 17344789.
- ^ McCarthy M (1998). "FDA bans red yeast rice product". The Lancet. 351 (9116): 1637. doi:10.1016/s0140-6736(05)77698-4. S2CID 54229753.
- ^ 콜레스테롤 치료 확정, 뉴욕타임스, 1999년 2월 18일
- ^ Endo, Akira; Kuroda M.; Tsujita Y. (December 1976). "ML-236A, ML-236B, and ML-236C, new inhibitors of cholesterogenesis produced by Penicillium citrinium". Journal of Antibiotics. 29 (12): 1346–8. doi:10.7164/antibiotics.29.1346. PMID 1010803.
- ^ a b c Campbell, Chantel D.; Vederas, John C. (2010). "Biosynthesis of lovastatin and related metabolites formed by fungal iterative PKS enzymes". Biopolymers. 93 (9): 755–763. doi:10.1002/bip.21428. ISSN 1097-0282. PMID 20577995.
- ^ W, Xu; Yh, Chooi; Jw, Choi; S, Li; Jc, Vederas; Na, Da Silva; Y, Tang (17 June 2013). "LovG: The Thioesterase Required for Dihydromonacolin L Release and Lovastatin Nonaketide Synthase Turnover in Lovastatin Biosynthesis". Angewandte Chemie International Edition in English. 52 (25): 6472–5. doi:10.1002/anie.201302406. PMC 3844545. PMID 23653178.
- ^ Hirama M, Vet M (1982). "A chiral total synthesis of compactin". J. Am. Chem. Soc. 104 (15): 4251–4253. doi:10.1021/ja00379a037.
- ^ Hirama M, Iwashita; Iwashita, Mitsuko (1983). "Synthesis of (+)-Mevinolin starting from Naturally occurring building blocks and using an asymmetry inducing reaction". Tetrahedron Lett. 24 (17): 1811–1812. doi:10.1016/S0040-4039(00)81777-3.
- ^ Gunde-Cimerman, N; Cimerman, A (March 1995). "Pleurotus fruiting bodies contain the inhibitor of 3-hydroxy-3-methylglutaryl-coenzyme A reductase-lovastatin". Experimental Mycology. 19 (1): 1–6. doi:10.1006/emyc.1995.1001. PMID 7614366.
- ^ Liu J, Zhang J, Shi Y, Grimsgaard S, Alraek T, Fønnebø V (2006). "Chinese red yeast rice (Monascus purpureus) for primary hyperlipidemia: a meta-analysis of randomized controlled trials". Chin Med. 1 (1): 4. doi:10.1186/1749-8546-1-4. PMC 1761143. PMID 17302963.
- ^ Zhao ZJ, Pan YZ, Liu QJ, Li XH (2013). "Exposure assessment of lovastatin in Pu-erh tea". International Journal of Food Microbiology. 164 (1): 26–31. doi:10.1016/j.ijfoodmicro.2013.03.018. PMID 23587710.
- ^ Hartig K, Beck E (2005). "Assessment of lovastatin application as tool in probing cytokinin-mediated cell cycle regulation". Physiologia Plantarum. 125 (2): 260–267. doi:10.1111/j.1399-3054.2005.00556.x.
외부 링크
![]() 위키미디어 커먼스의 로바스타틴 관련 미디어
위키미디어 커먼스의 로바스타틴 관련 미디어
- "Lovastatin". Drug Information Portal. U.S. National Library of Medicine.