레티나
Retina| 레티나 | |
|---|---|
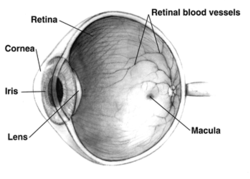 인간의 오른쪽 눈 단면도; 눈은 동물마다 상당히 다르다. | |
| 세부 사항 | |
| 발음 | 영국: /rɛtɪn/, /rətən/, 망막 /-ni/ |
| 일부 | 눈 |
| 시스템. | 시각계 |
| 동맥 | 망막 중심 동맥 |
| 식별자 | |
| 라틴어 | 뢰테, 쯔니카인테나불비 |
| 메쉬 | D012160 |
| TA98 | A15.2.04.002 |
| TA2 | 6776 |
| FMA | 58301 |
| 해부학 용어 | |
망막(라틴어: rete "net"에서 유래)은 대부분의 척추동물과 일부 연체동물의 눈의 가장 안쪽에 있는 빛에 민감한 조직층이다.눈의 광학은 망막에 초점을 맞춘 시각 세계의 2차원 이미지를 생성하는데, 망막은 망막 내에서 그 이미지를 처리하고 시각 신경을 따라 시각 피질에 신경 자극을 보내 시각 인식을 만듭니다.망막은 많은 면에서 카메라의 필름이나 이미지 센서와 유사한 기능을 한다.
신경망막은 시냅스에 의해 상호 연결된 여러 개의 뉴런 층으로 구성되고 색소 상피 세포의 외부 층에 의해 지지된다.망막의 1차 광감지 세포는 광수용체 세포로, 두 가지 유형: 막대기와 원추체이다.로드는 주로 어두운 빛에서 기능하며 단색 시야를 제공합니다.원뿔은 밝은 조건에서 작동하며, 다양한 opsins를 사용하여 색상의 지각과 독서 등의 작업에 사용되는 높은 시력을 담당합니다.광감지세포의 세 번째 타입인 광감지신경절세포는 동공광반사 등의 반사반응과 일주기 리듬의 교합에 중요하다.
빛은 망막에 닿으면 궁극적으로 시신경의 섬유질을 통해 뇌의 다양한 시각 중추로 보내지는 신경 자극을 유발하는 화학적이고 전기적 사건들의 연속을 시작합니다.막대기와 원추체로부터의 신경 신호는 다른 뉴런에 의해 처리되며, 그 출력은 축삭이 시신경을 [1]형성하는 망막 신경절 세포에서 활동 전위의 형태를 취합니다.시각지각의 몇 가지 중요한 특징은 빛의 망막 부호화와 처리로 추적할 수 있다.
척추동물의 배아 발달에서 망막과 시신경은 발달 중인 뇌, 특히 배아 간뇌의 성장기 이상으로 발생한다. 따라서 망막은 중추신경계의 일부로 간주되며 실제로 뇌 [2][3]조직이다.CNS에서 비침습적으로 시각화할 수 있는 유일한 부분입니다.뇌의 나머지 부분이 혈액-뇌 장벽을 통해 혈관 체계로부터 분리되는 것과 마찬가지로 망막도 마찬가지로 혈액-망막 장벽에 의해 보호됩니다.
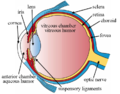
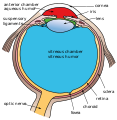
구조.
반전 망막 대 비반전 망막
척추동물의 망막은 빛을 감지하는 세포가 망막의 뒤쪽에 있다는 점에서 반전되어 빛이 막대기와 [4]원추체의 감광성 부분에 도달하기 전에 뉴런과 모세혈관의 층을 통과해야 한다.축삭이 시신경을 형성하는 신경절 세포는 망막의 앞쪽에 있다; 그러므로 시신경은 뇌로 가는 도중에 망막을 통과해야 한다.이 영역에는 광수용체가 없어 [5]사각지대가 발생한다.이와는 대조적으로 두족류 망막에서는 광수용체가 앞에 있고, 그 뒤에는 처리 뉴런과 모세혈관이 있다.이 때문에 두족류는 사각지대가 없다.
비록 덮인 신경 조직이 부분적으로 투명하고, 부수되는 글리아 세포가 광수용체로 [6][7]광자를 직접 운반하는 광섬유 채널로 작용하는 것으로 보여졌지만, 빛 산란이 일어난다.[8]인간을 포함한 일부 척추동물들은 높은 시력에 적응된 중심 망막의 영역을 가지고 있다.이 영역인 구근 중앙부는 혈관이 없고 광수용체 앞에 최소한의 신경 조직이 있어 빛의 [8]산란을 최소화합니다.
두족류는 많은 척추동물의 눈에 필적하는 분해능력이 있는 비반전 망막을 가지고 있다.오징어 눈에는 척추동물의 망막색소상피(RPE)와 유사체가 없다.비록 그들의 광수용체가 망막을 재활용하고 척추동물 RPE의 기능 중 하나를 복제하는 단백질인 레티노크롬을 포함하고 있지만, 사람들은 두족류 광수용체가 척추동물에서뿐만 아니라 잘 유지되지 않고 그 결과, 무척추동물에서 광수용체의 유용한 수명이 척추동물에서보다 훨씬 짧다고 주장할 수 있다.랍스터(가재) 또는 망상거미(Deinopis[10] 등)를 쉽게 대체할 수 있는 경우는 거의 없습니다.[9]
두족류 망막은 척추동물처럼 뇌의 성장에서 비롯되지 않는다.이 차이는 척추동물과 두족류의 눈이 상동성이 아니라 따로 진화했다는 것을 보여주는 것이라고 주장할 수 있다.진화적 관점에서, 역망막과 같은 보다 복잡한 구조는 일반적으로 두 가지 대체 과정의 결과로 나타날 수 있다: (a) 경쟁하는 기능적 한계 사이의 유리한 "좋은" 타협 또는 (b) 장기 진화와 변환의 복잡한 경로의 역사적 부적응적 유물로서.시력은 고등 척추동물에게 중요한 적응이다.
그"거꾸로"척추 동물 눈의 세번째 관점은 그것이, 빛의 세기의 하락 현대 먹장어류(매우 깊고 어두운 물에서 사는 물고기)의 조상들의 극도로 민감한 눈에 기반을 두고 있는 광수용체 눈이 부신을 방지하는데 필요한 두가지 이점:미생물의 광수용체가 위에서 언급한 유지를 결합한다.[11]
망막층


척추동물의 망막은 10개의 뚜렷한 [13]층을 가지고 있다.유리체에서 가장 가까운 곳부터 가장 먼 곳까지:
- 내부 한계막 – 뮐러 세포가 정교하게 만든 기저막.
- 신경 섬유층 – 신경절 세포체의 축삭(이 층과 내부 제한막 사이에 얇은 뮐러 세포 발판이 있음에 유의하십시오).
- 신경절 세포층 – 축삭이 시신경 섬유가 되는 신경절 세포의 핵과 일부 치환된 아마크린 [2]세포를 포함합니다.
- 내부 플렉스 형태 층 – 양극성 세포 축삭과 신경절 및 아마크린 [2]세포의 수상돌기 사이의 시냅스를 포함합니다.
- 내부 핵층 – 아마크린 세포, 양극 세포 및 수평 [2]세포의 핵과 주변 세포체(주위 세포체)를 포함합니다.
- 외측 플렉스폼층 – 로드 스피룰과 콘 페디클에서 끝나는 로드와 콘의 돌출부.이것들은 양극성 세포와 수평 [2]세포들의 수상돌기와 시냅스를 만든다.황반 영역에서는 이것을 헨리의 섬유층이라고 부릅니다.
- 외부 핵층 – 막대 및 원추 세포체.
- 외부 제한막 – 감광체의 내부 세그먼트 부분을 세포핵에서 분리하는 층.
- 내부 세그먼트/외부 세그먼트 레이어 – 로드 및 원뿔의 내부 세그먼트 및 외부 세그먼트.외부 세그먼트에는 고도로 특수화된 광 감지 [14][15]장치가 포함되어 있습니다.
- 망막 색소 상피 – 입방체 상피 세포의 단층(그림에 표시되지 않은 압출물 포함).이 층은 맥락막에 가장 가깝고, 신경망막에 영양과 보조 기능을 제공합니다, 색소 층의 검은 색소 멜라닌은 안구의 지구 전체에 빛의 반사를 방지합니다; 이것은 선명한 [16][17][18]시력에 매우 중요합니다.
이 층들은 4가지 주요 처리 단계로 분류될 수 있습니다: 광수용체, 양극성 세포로의 전달, 또한 광수용체를 포함하는 신경절 세포로의 전달, 그리고 시신경을 따른 전달.각각의 시냅스 단계에서 수평세포와 아마크린세포가 측면으로 연결되어 있다.
시신경은 주로 간뇌의 시각 중계소인 측두엽에 연결된 많은 신경절 세포 축삭의 중심 관로입니다.그것은 또한 상부 콜리큘러스, 상완골핵, 시신경관의 핵으로 돌출된다.영장류에서 시신경 디스크를 [19]만들면서 다른 층을 통과합니다.
일부 척추동물군에서는 시력과 직접 관련이 없는 추가 구조가 망막의 성장 이상으로 발견됩니다.조류에서 펙텐은 망막에서 유리액으로 돌출하는 복잡한 형태의 혈관 구조입니다; 그것은 눈에 산소와 영양분을 공급하고 또한 시력을 도울 수 있습니다.파충류는 비슷하지만 훨씬 단순한 [20]구조를 가지고 있다.
성인 인간의 경우, 전체 망막은 지름이 약 22mm인 구의 약 72%이다.전체 망막은 약 7백만 개의 원추체와 7억 5천만 개에서 1억 5천만 개의 막대기를 가지고 있습니다.광수용체가 부족하기 때문에 때때로 "사각지대"라고 불리는 망막의 일부인 광학 디스크는 광섬유 섬유가 눈을 떠나는 유두부에 위치합니다.3mm²의 타원형 흰색 영역으로 나타납니다.이 디스크에 대한 시간적(관자놀이의 방향)은 황반이며, 그 중심에는 날카로운 중심 시력에 책임이 있지만 막대기가 없기 때문에 빛에 덜 민감합니다.인간과 인간이 아닌 영장류는 두 갈래로 갈라지는 매와 같은 특정 조류 종과 시각적인 [citation needed]줄무늬로 알려진 중심 띠를 가진 개와 고양이와 달리 하나의 거미줄을 가지고 있다.망막 주변은 중앙 망막을 약 6mm 연장하고 그 다음 말초 망막을 연장합니다.망막의 가장 먼 가장자리는 오라 혈청에 의해 정의된다.한 오라에서 다른 오라(또는 황반)까지의 거리는 수평 자오선을 따라 가장 민감한 영역인 약 32mm이다.[clarification needed]
단면적으로 망막의 두께는 0.5mm를 넘지 않는다.그것은 독특한 리본 시냅스를 포함한 세 개의 신경 세포 층과 두 개의 시냅스를 가지고 있습니다.시신경은 신경절 세포 축삭을 뇌로 운반하고 망막을 공급하는 혈관을 운반한다.신경절 세포는 눈 가장 안쪽에 있는 반면 광수용 세포는 그 너머에 있다.이러한 직관에 반하는 배열 때문에, 빛은 막대기와 원추체에 도달하기 전에 먼저 신경절 세포와 그 주변을 통과해야 하고 망막 두께를 통과해야 합니다.빛은 망막 색소 상피 또는 맥락막(둘 다 불투명)에 의해 흡수됩니다.
감광체 앞의 모세혈관에 있는 백혈구는 푸른 빛을 볼 때 아주 작고 밝은 움직임의 점으로 인식될 수 있다.이것은 블루필드 엔옵틱 현상(또는 쉐이러 현상)으로 알려져 있습니다.
신경절 세포층과 막대 그리고 원추체 사이에는 시냅스 접촉이 이루어지는 두 개의 신경세포 층이 있다.신경질층은 바깥쪽 플렉스폼층과 안쪽 플렉스폼층이다.외측신경일층에서는 막대 및 원추체가 수직으로 흐르는 양극성 세포에 접속되고 수평방향의 수평세포가 신경절 세포에 접속된다.
중앙 망막은 주로 원추체를 포함하고, 말초 망막은 주로 막대를 포함합니다.총 7백만 개의 원뿔과 1억 개의 막대기가 있다.황반 중앙에는 원추체가 좁고 긴 구덩이가 있으며,[21] 망막 주위에 위치한 훨씬 뚱뚱한 원추체와는 대조적으로 가장 밀도가 높은 육각형 모자이크로 배열되어 있습니다.포볼 피트에서는 망막의 가장 두꺼운 부분인 포볼의 테두리, 즉 파라포바에 도달할 때까지 다른 망막층이 포볼 경사면을 따라 변위한다.황반에는 선별 색소로부터 노란색의 색소가 침착되어 있으며 황반 황반으로 알려져 있습니다.오목한 부분을 직접 둘러싼 영역은 단일 양극성 셀에 모이는 가장 높은 밀도를 가지고 있습니다.원추형의 신호 수렴이 훨씬 적기 때문에, 원추형은 눈이 얻을 수 있는 [2]가장 선명한 시야를 가능하게 합니다.
막대기와 원추체는 일종의 모자이크이지만 수용체에서 쌍극자로, 신경절 세포로 전달되는 것은 직접적이지 않습니다.수용체는 약 1억 5천만 개이고 시신경 섬유는 1백만 개에 불과하기 때문에, 수렴이 있어야 하며, 따라서 신호가 혼합되어야 한다.또한, 수평 및 아마크린 세포의 수평적 작용은 망막의 한 영역이 다른 영역을 제어할 수 있게 한다(예를 들어 다른 자극이 억제된다).이러한 억제는 뇌의 상위 영역으로 전송되는 메시지의 합을 줄이는 데 핵심적입니다.일부 하등 척추동물(예: 비둘기)에서는, 메시지에 대한 "중심" 제어가 있습니다. 즉, 한 층이 다른 층을 통제할 수 있거나 뇌의 상위 영역이 망막 신경 세포를 움직일 수 있지만,[2] 영장류에서는 이것이 일어나지 않습니다.
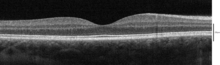
광학 코히렌스 단층 촬영으로 상상할 수 있는 레이어
광학 간섭 단층촬영(OCT)을 사용하여 망막에서 식별할 수 있는 18개의 층이 있습니다.레이어 및 해부학적 상관 관계는 다음과 같습니다.[22][23][24]
안쪽에서 바깥쪽까지 OCT로 식별할 수 있는 레이어는 다음과 같습니다.
| # | OCT 레이어/기존 라벨 | 해부학적 상관 관계 | 반사율 | 특정한 해부학의 경계? | 추가의 레퍼런스 |
|---|---|---|---|---|---|
| 1 | 후피질 유리체 | 후피질 유리체 | 초반사성 | 네. | [23] |
| 2 | 망막 전 공간 | 유리체가 망막에서 완전히 또는 부분적으로 분리된 눈에서, 이것은 후피질 유리면과 망막의 내부 제한막 사이에 만들어진 공간이다. | 저반사성 | [23] | |
| 3 | 내부제한막(ILM) | 뮐러 세포 말단에 의해 형성됨 (OCT에서 관찰할 수 있는지 여부 불명) | 초반사성 | 아니요. | [23] |
| 신경섬유층(NFL) | 시신경을 향해 이동하는 신경절 세포 축삭 | ||||
| 4 | 신경절세포층(GCL) | 신경절 세포체(및 일부 치환된 아마크린 세포) | 저반사성 | [23] | |
| 5 | 내부 플렉시폼층(IPL) | 양극성 세포, 아마크린 세포 및 신경절 세포 사이의 시냅스 | 초반사성 | [23] | |
| 6 | 내부핵층(INL) | a) 수평, 양극 및 아마크린 세포체 | 저반사성 | [23] | |
| 7 | 외부 플렉시폼층(OPL) | 광수용체, 양극성 및 수평 세포 사이의 시냅스 | 초반사성 | [23] | |
| 8 | (내측 절반) 헨리의 신경섬유층(HL) | 감광 축삭 (사각 방향의 섬유, 중심 또는 말초 망막에는 존재하지 않음) | 저반사성 | 아니요. | [23] |
| (외측 절반)외측핵층(ONL) | 광수용체 세포체 | ||||
| 9 | 외부제한막(ELM) | 뮐러 세포와 감광체 내부 세그먼트 사이에 Zonulae Adherens로 구성됨 | 초반사성 | [23] | |
| 10 | 근위대(MZ) | 다음을 포함하는 감광체 내부 세그먼트(IS)의 가장 안쪽 부분: | 저반사성 | 아니요. | [25][26] |
| 11 | 타원대(EZ) | 미토콘드리아로 채워진 감광체 내부 세그먼트(IS)의 가장 바깥쪽 부분 | 초반사성 | 아니요. | [22][27][25][23][28][29] |
| IS/OS 접합 또는 광수용체 무결성 라인(PIL) | 감광체 세포의 내부와 외부 세그먼트를 연결하는 섬모를 연결하는 감광체. | ||||
| 12 | 감광체 외부 세그먼트(OS) | 광자를 흡수하는 분자인 옵신이 채워진 디스크를 포함하는 광수용체 외부 세그먼트(OS)입니다. | 저반사성 | [30][23] | |
| 13 | 인터다이제이션존(IZ) | 콘 OS의 일부를 감싸는 RPE 셀의 꼭대기. RPE와 구별하기 어렵다. 이전 페이지: "원뿔 외부 세그먼트 팁 라인" (비용) | 초반사성 | 아니요. | |
| 14 | RPE/Bruch 콤플렉스 | RPE 파고솜 존 | 초반사성 | 아니요. | [22][23] |
| RPE멜라노솜대 | 저반사성 | ||||
| RPE 미토콘드리아 영역 + RPE와 브루흐 막 사이의 접합부 | 초반사성 | ||||
| 15 | 초리오카필라리스 | 내측 맥락막의 중간 반사율의 얇은 층 | 아니요. | [23] | |
| 16 | 새틀러층 | 원형 또는 타원형 초반사 프로파일의 두꺼운 레이어, 중간 코어에 저굴절 코어 포함 | [23] | ||
| 17 | 할러층 | 타원형 초반사 프로파일의 두꺼운 층으로 외측 맥락막 내에 저굴절 코어가 있음 | [23] | ||
| 18 | 맥락막-스크렐라 접합부 | 큰 원형 또는 난형 프로파일이 접하는 텍스처의 현저한 변화가 있는 바깥쪽 맥락막의 구역 가변 반사율의 균질 영역 | [23] | ||
발전
망막의 발달은 SH와 SIX3 단백질에 의해 매개되는 안장의 확립으로 시작되며, 이후 PAX6와 LHX2 [31]단백질에 의해 조절되는 시신포의 발달로 시작된다.Pax6의 눈 발달에 대한 역할은 월터 게링과 동료들에 의해 우아하게 증명되었는데, 그는 Pax6의 이소성 표현이 드로소필라 더듬이, 날개, [32]다리에 눈 형성을 초래할 수 있다는 것을 보여주었다.시신경 소낭은 신경망막, 망막 색소 상피, 시신경 줄기의 세 가지 구조를 일으킨다.신경망막은 망막의 7가지 세포 유형을 발생시키는 망막 전구 세포들을 포함합니다.분화는 망막 신경절 세포에서 시작하여 멀러 글리아 [33]생성으로 끝납니다.각 셀 타입은 순차적으로 RPC와 구별되지만 개별 셀 타입이 [31]구별되는 타이밍에는 상당한 중복이 있습니다.RPC 도터 세포의 운명을 결정하는 단서는 bHLH 및 호메오도메인 [34][35]인자를 포함한 여러 전사인자 패밀리에 의해 코드화된다.
세포운명의 결정을 유도하는 것 외에, 등측복부(D-V) 및 비측복부(N-T) 축을 결정하기 위한 단서가 망막에 존재한다.D-V 축은 VAX2의 배에서 배까지의 구배에 의해 설정되며, N-T 축은 포크헤드 전사 인자 FOXD1과 FOXG1의 표현에 의해 조정된다.망막 [35]내에 추가적인 구배가 형성된다.이 공간 분포는 망막 [31]맵을 확립하기 위해 기능하는 RGC 축삭의 적절한 타겟팅에 도움이 될 수 있습니다.
혈액 공급
망막은 각각 다른 영양 [37]요구 사항을 가진 신진대사를 가진 특정 세포 유형 또는 세포[36] 구획을 포함하는 뚜렷한 층으로 계층화됩니다.이러한 요구 사항을 충족시키기 위해, 안와 동맥은 두 개의 뚜렷한 혈관 네트워크를 통해 망막을 분기하고 공급합니다: 맥락막과 외측 망막을 공급하는 맥락막 네트워크와 망막 [38]내층을 공급하는 망막 네트워크입니다.
순환 메커니즘
얼핏 척추동물의 망막이 "잘못 배선되었다"거나 "잘못 설계되었다"고 생각할 수 있지만, 사실, 망막이 뒤집히지 않으면 기능을 할 수 없었다.광수용체층은 망막색소상피(RPE)에 내장되어야 하며, 망막색소상피(RPE)는 최소 7가지 중요한 기능을 [39]수행하는데, 이는 광수용체가 기능하는 데 필요한 산소와 기타 필요한 영양소를 공급하는 가장 명백한 요소 중 하나이다.이러한 영양소에는 포도당, 지방산, 망막이 포함됩니다.포유류의 광수용체 증폭 과정은 광학적 조건(스코프 조건 하에서 덜 필요한)에서 시력을 위해 많은 양의 에너지를 사용하기 때문에, RPE를 벗어난 맥락막의 혈관에 의해 공급되는 많은 영양소를 필요로 한다.맥락막은 이러한 영양소의 약 75%를 망막에 공급하고 망막 혈관 구조는 25%[4]만 공급합니다.
빛이 (로드와 원뿔의 디스크에서) 11-cis-retinal에 도달하면 11-cis-retinal이 all-trans-retinal로 바뀌어 opsin의 변화가 트리거됩니다.이제 외부 세그먼트는 망막이 빛에 의해 변경되면 다시 시스 형태로 재생되지 않습니다.대신 망막은 주변 RPE로 펌핑되어 재생되어 광수용체의 외부 세그먼트로 반송됩니다.RPE의 이러한 재활용 기능은 광산화성[40][41] 손상으로부터 광수용체를 보호하고 광수용체 세포가 수십 년의 유효 수명을 가질 수 있도록 합니다.
인버드
새의 망막은 혈관이 없기 때문에 이미지를 형성하기 위해 빛을 안전하게 통과시켜 더 나은 해상도를 제공합니다.그러므로, 새 망막은 사각지대나 광학 디스크에 위치한 "펙텐" 또는 펙텐 오큘리라고 불리는 특수 기관에 영양과 산소 공급을 의존한다는 것은 고려된 견해이다.이 기관은 혈관이 매우 풍부하고 유리체를 통한 확산에 의해 새 망막에 영양과 산소를 공급하는 것으로 생각됩니다.펙텐은 알칼리성 인산가수분해효소 활성과 브릿지 부분의 분극 세포가 풍부하게 함유되어 있어 둘 다 분비 [42]역할에 적합합니다.펙텐 세포는 어두운 멜라닌 과립으로 가득 차 있는데, 이것은 펙텐에 떨어지는 유광의 흡수와 함께 이 기관을 따뜻하게 유지하도록 이론화되었습니다.이것은 펙텐의 대사율을 향상시키고,[43] 따라서 빛에 노출되는 오랜 시간 동안 망막의 엄격한 에너지 요구 사항을 충족시키기 위해 더 영양가 있는 분자를 수출하는 것으로 간주됩니다.
질병의 바이오메트릭 식별 및 진단
내부 망막 혈관 네트워크의 분기 및 기타 물리적 특성은 [44]개인마다 다르다고 알려져 있으며, 이러한 개인 차이는 생체 인식 및 질병의 조기 발견을 위해 사용되어 왔다.혈관 분기 매핑은 생체 [45]인식의 기본 단계 중 하나입니다.이러한 망막 혈관 구조의 분석 결과는 DRIVE 데이터 [47]세트로부터 얻은 망막 안저 영상의 혈관 분리의 지상 진실 데이터에[46] 대해 평가할 수 있다.또한 DRIVE 데이터 세트의 혈관 클래스도 [48]확인되었으며 이러한 분기의 정확한 추출을 위한 자동화된 방법도 사용할 [49]수 있습니다.망막 혈액순환의 변화는 노화와 대기 [51]오염에 노출되면서[50] 나타나고 고혈압과 아테롬성 동맥경화증 [52][53][54]같은 심혈관 질환을 나타낼 수 있다.시신경 디스크 근처의 동맥과 정맥의 등가 폭을 결정하는 것도 심혈관 [55]위험을 식별하기 위해 널리 사용되는 기법이다.
기능.
망막은 망막의 광수용체 세포인 막대와 원추체 색소의 패턴화된 들뜸에서 시작하여 광학 이미지를 신경 자극으로 변환합니다.들뜸은 신경계와 뇌의 여러 부분이 동시에 작용하여 뇌의 외부 환경을 표현합니다.
원뿔은 밝은 빛에 반응하여 일광 조명 중에 고해상도 색각을 조정합니다(포토픽 비전이라고도 함).로드 응답은 일광 레벨에서 포화되며 패턴 시력에 영향을 주지 않습니다.그러나, 막대는 어두운 빛에 반응하여 매우 낮은 조명 수준(스코토픽 비전이라고 함)에서 저해상도 단색 시야를 조정한다.대부분의 사무실 환경에서 조도는 이 두 수준 사이에 있으며 이를 중간 시야라고 합니다.중간광 레벨에서는 로드와 원뿔이 모두 패턴 정보를 적극적으로 기여하고 있습니다.이러한 상황에서 로드 정보가 시력을 패턴화하는 데 어떤 기여를 하는지 불분명합니다.
다양한 파장의 빛에 대한 원뿔의 반응을 스펙트럼 감도라고 합니다.정상적인 인간의 시각에서, 원뿔의 스펙트럼 감도는 종종 파란색, 녹색, 빨간색이라고 불리는 세 가지 하위 유형 중 하나로 분류되지만, 더 정확하게는 짧은, 중간, 긴 파장 민감 원뿔 하위 유형으로 알려져 있습니다.원추형 아형이 하나 이상 부족하여 색각 결핍이나 다양한 색맹을 일으킨다.이 사람들은 특정 색상의 물체에 눈이 멀지는 않지만, 정상적인 시력을 가진 사람들이 구별할 수 있는 색깔을 구별할 수 없다.인간은 이 삼색시력을 가지고 있는 반면, 대부분의 다른 포유류는 붉은 색소를 가진 원추체가 없기 때문에 이색시력이 떨어진다.하지만, 어떤 동물들은 네 가지 스펙트럼 아형을 가지고 있다. 예를 들어, 송어는 인간과 유사한 짧고 중간이며 긴 아형에 자외선 서브그룹을 추가한다.어떤 물고기들은 빛의 편광에도 민감합니다.
광수용체에서는 빛에 대한 노출이 일련의 단계적 변화로 막을 과분극화한다.외부 세포 세그먼트에는 포토 피그먼트가 포함되어 있습니다.세포 내에서 고리형 구아노신 일인산(cGMP)의 정상 수준은 Na+ 채널을 열어두고, 따라서 휴지 상태에서 세포는 탈분극된다.광자는 수용체 단백질에 결합된 망막이 망막 경망막으로 이성질화되도록 한다.이로 인해 수용체가 여러 개의 G-단백질을 활성화하게 됩니다.이에 따라 단백질의 Ga-subunit이 포스포디에스테라아제(PDE6)를 활성화하여 cGMP를 분해하여 Na+ 고리형 뉴클레오티드 게이트 이온 채널(CNG)을 닫게 된다.따라서 세포는 과분극된다.방출되는 신경전달물질의 양은 밝은 빛에서 감소하며 빛의 수준이 떨어짐에 따라 증가한다.실제 광색소는 밝은 빛에서 표백되고 화학 작용으로 대체되기 때문에 밝은 빛에서 어두운 빛으로 전환될 때 눈이 최대 감도에 도달하는 데 최대 30분이 걸릴 수 있습니다.
이렇게 빛에 의해 흥분될 때, 감광체는 쌍극 세포에 비례적인 반응을 보내 망막 신경절 세포에 신호를 보냅니다.광수용체들은 또한 수평 세포와 아마크린 세포에 의해 가교되어 있으며, 이것은 신경 신호가 서로 섞이고 결합되는 신경 세포에 도달하기 전에 시냅스 신호를 수정한다.망막의 신경 세포 중, 망막 신경절 세포와 소수의 아마크린 세포만이 활동 전위를 생성한다.
망막 신경절 세포에는 세포의 수용 영역에 따라 두 가지 유형의 반응이 있습니다.망막 신경절 세포의 수용 영역은 빛이 세포의 발화에 한 가지 영향을 미치는 중앙의 대략적인 원형 영역과 빛이 반대 영향을 미치는 고리 모양으로 구성되어 있습니다.ON 셀에서는 수용장 중앙의 광강도 증가가 발화 속도를 증가시킨다.OFF 세포에서는 감소시킵니다.선형 모델에서 이 응답 프로파일은 가우시안 차이에 의해 잘 설명되며 에지 검출 알고리즘의 기초가 된다.이 단순한 차이를 넘어 신경절 세포는 색채 감도와 공간적 합의 유형에 의해서도 구별된다.선형 공간적 합성을 나타내는 세포는 X세포(파세포, P 또는 미드겟 신경절 세포라고도 함), 비선형 합성을 나타내는 세포는 Y세포(마그노셀라, M 또는 파라솔 망막 신경절 세포라고도 함)이며, X세포와 Y세포(고양이 망막 내), P세포와 M세포(영장 망막 내)의 대응관계는 Y세포이다.예전처럼 간단하지 않아요
시각 신호가 뇌로 전달될 때, 시각 경로, 망막은 시간적(관자놀이에 가장 가까운) 반쪽과 비적(코에 가장 가까운) 반으로 수직 분할됩니다.코 반쪽에서 나온 축삭은 측두엽으로 통과하기 전에 다른 쪽 눈의 측두엽 반쪽에서 축삭과 결합하기 위해 시신에서 뇌를 가로지른다.
1억 3천만 개 이상의 망막 수용체가 있지만, 시신경에는 약 120만 개의 섬유(축)만 있습니다.그래서 망막 내에서 다량의 전처리가 이루어진다.Fovea는 가장 정확한 정보를 생성합니다.시야의 약 0.01%(시각의 2° 미만)를 차지함에도 불구하고 시신경의 축삭의 약 10%는 공에 할애된다.공막의 해상도 한계는 약 10,000포인트로 결정되었습니다.정보 용량은 컬러를 포함하지 않는 경우 500,000비트/초(비트에 대한 자세한 내용은 정보 이론 참조) 또는 [56]컬러를 포함한 약 600,000비트/초로 추정됩니다.
공간 부호화
망막이 이미지를 나타내는 신경 자극을 뇌에 보낼 때, 시각 신경의 제한된 용량에 맞도록 그 자극을 공간적으로 부호화(압축)한다.신경절 세포보다 광수용체 세포가 100배 더 많기 때문에 압박이 필요하다.이것은 양극성 세포와 신경절 세포에 의해 구현되는 "중심-주변 구조"에 의해 수행되는 "상관성"에 의해 이루어진다.
망막에는 중심과 비중심 두 가지 유형의 중심-주변 구조가 있다.중심에는 양의 가중 중심과 음의 가중 서라운드가 있습니다.오프센터(Off-Centre)는 정반대입니다.양의 가중치는 일반적으로 흥분성 가중치, 음의 가중치는 억제성 가중치라고 알려져 있다.
이러한 중심-주변 구조는 조직 샘플을 염색하고 망막의 해부도를 조사해서는 볼 수 없다는 점에서 물리적으로 명백하지 않다.중심-주변 구조는 양극 세포와 신경절 세포 사이의 연결 강도에 의존한다는 점에서 논리적(즉, 수학적으로 추상적)이다.세포 간 연결 강도는 양극성 세포와 신경절 세포 사이의 시냅스에 내장된 이온 채널의 수와 종류에 의해 발생하는 것으로 알려져 있다.
중심-주변 구조는 컴퓨터 프로그래머가 디지털 사진에서 가장자리를 추출하거나 강화하기 위해 사용하는 가장자리 감지 알고리즘과 수학적으로 동등하다.따라서, 망막은 시야 내에서 물체의 가장자리를 강화하기 위해 이미지를 나타내는 자극에 대한 작업을 수행합니다.예를 들어, 개, 고양이, 자동차의 그림에서 가장 많은 정보를 담고 있는 것은 이러한 물체의 가장자리입니다.뇌에서 더 높은 기능이 개나 고양이와 같은 물체를 추출하고 분류하기 위해 망막은 장면 내의 다양한 물체를 분리하는 첫 번째 단계이다.
예를 들어, 다음 매트릭스는 에지 검출을 구현하는 컴퓨터 알고리즘의 핵심입니다.이 매트릭스는 중심-주변 구조에 해당하는 컴퓨터이다.이 예에서 이 매트릭스 내의 각 상자(원소)는 하나의 광수용체에 연결됩니다.중앙의 광수용체는 처리 중인 전류 수용체입니다.중앙 감광체에 +1 중량 계수를 곱한다.주변 감광체는 중심에서 "가장 가까운 이웃"이며 -1/8 값을 곱한다.이들 9개 요소의 합계가 최종적으로 계산됩니다.이 합계는 영상의 모든 감광체에 대해 행의 끝으로 왼쪽으로 이동한 다음 다음 라인으로 이동함으로써 반복됩니다.
| -1/8 | -1/8 | -1/8 |
| -1/8 | +1 | -1/8 |
| -1/8 | -1/8 | -1/8 |
이 행렬의 총합은 9개의 감광체로부터의 모든 입력이 같은 값일 경우 0이 됩니다.제로 결과는 이 작은 패치 내에서 이미지가 균일(변경 없음)했음을 나타냅니다.음수 또는 양의 합계는 9개의 광수용체로 구성된 이 작은 패치 내에서 이미지가 변화(변화)했음을 의미합니다.
위의 매트릭스는 망막 내부에서 실제로 일어나는 일에 대한 근사치일 뿐이다.차이점은 다음과 같습니다.
- 위의 예를 "균형"이라고 합니다.균형이라는 용어는 음수 가중치의 합이 양수 가중치의 합과 같으므로 음수 가중치가 완벽하게 상쇄된다는 것을 의미합니다.망막 신경절 세포는 거의 완벽한 균형을 이루지 못한다.
- 망막의 중심-주변 구조가 원형인 반면 테이블은 정사각형이다.
- 뉴런은 신경세포 축삭을 따라 이동하는 스파이크 트레인에서 작동한다.컴퓨터는 기본적으로 각 입력 픽셀에서 일정한 단일 부동 소수점 숫자로 작동합니다.(컴퓨터 픽셀은 기본적으로 생물학적 광수용체와 동일합니다.)
- 망막은 컴퓨터가 각 픽셀에서 한 번에 하나씩 작동하는 동안 이 모든 계산을 병렬로 수행합니다.망막은 컴퓨터처럼 반복적인 합계와 이동을 하지 않는다.
- 마지막으로, 수평 세포와 아마크린 세포는 이 과정에서 중요한 역할을 하지만, 여기에는 나타나지 않습니다.
다음은 입력 이미지의 예와 에지 탐지가 이미지를 수정하는 방법입니다.
영상이 중심-주변 구조에 의해 공간적으로 부호화되면 신호는 시신경을 따라 시신경을 통해(신경절 세포의 축삭을 통해) LGN(측방 일반핵)으로 전송됩니다.현재 LGN의 정확한 기능은 알려지지 않았습니다.그런 다음 LGN의 출력은 뇌 뒤쪽으로 보내진다.특히, LGN의 출력은 V1 1차 시각 피질에 "방사선"됩니다.
신호 흐름 단순화:광수용체 → 양극성 → 신경절 → 키아스름 → LGN → V1 피질
임상적 의의
망막에 영향을 미칠 수 있는 유전 및 후천적인 질병이나 질환이 많이 있습니다.그 중 몇 가지는 다음과 같습니다.
- 색소성 망막염은 망막에 영향을 미쳐 야간 시력과 말초 시력 상실을 일으키는 유전병이다.
- 황반변성은 황반 내 세포의 죽음이나 손상으로 인해 중심 시력을 잃는 것이 특징인 질병 그룹을 말한다.
- 콘로드디스트로피(CORD)는 망막의 원추체 및/또는 막대의 열화에 의해 시력 손실이 발생하는 많은 질병을 기술한다.
- 망막 분리에서는 망막이 안구 뒤쪽에서 분리된다.점화기는 시대에 뒤떨어진 치료법이다.망막 박리라는 용어는 망막 색소 [57]상피에서 신경감각망막의 분리를 설명하기 위해 사용된다.망막 박리를 고정하기 위한 몇 가지 현대적인 치료 방법이 있습니다: 공압망막, 강막 버클, 저온 요법, 레이저 광응고 및 파스판 유리 적출술.
- 고혈압과 당뇨병은 망막을 공급하는 작은 혈관에 손상을 입혀 고혈압성 망막증과 당뇨병성 망막증으로 이어질 수 있다.
- 망막아세포종은 망막의 암이다.
- 개의 망막 질환에는 망막 이형성증, 진행성 망막 위축, 갑작스러운 후천성 망막 변성이 포함된다.
- 망막지방혈증은 망막이 하얗게 보이는 것으로, 지방단백질 리파아제 결핍으로 지질침착에 의해 발생할 수 있다.
- 망막 박리신경망막은 때때로 색소상피에서 분리된다.어떤 경우, 그러한 이탈의 원인은 신경망막과 색소상피 사이에 액체나 혈액이 모일 수 있도록 하는 안구의 손상이다.박리는 때때로 유리액 속의 미세한 콜라겐 섬유소의 수축에 의해 발생하는데, 이것은 망막의 영역을 지구 [21]내부로 끌어당긴다.
- 야맹증:야맹증은 심각한 비타민 A가 결핍된 사람에게서 발생한다.그 이유는 비타민 A가 없으면 형성될 수 있는 망막과 로돕신의 양이 심각하게 줄어들기 때문이다.밤에 이용할 수 있는 빛의 양이 너무 적어서 비타민 A가 부족한 [16]사람들에게 적절한 시력을 허락하지 않기 때문에 이러한 상태를 야맹증이라고 합니다.
또한 망막 검사를 통해 발견된 이상이 신경학적 [58]질병과 전신적 질병을 모두 발견할 수 있다는 점에서 망막은 뇌와 몸으로 들어가는 "창"으로 묘사되어 왔다.
진단.
망막에 영향을 미치는 질병과 장애를 진단하기 위해 많은 다른 기구들을 사용할 수 있다.안과 내시경 검사와 안저 촬영은 오랫동안 망막을 검사하는 데 사용되어 왔다.최근 적응광학이 살아있는 인간의 망막에서 각각의 막대기와 원추체를 촬영하는데 사용되었고, 스코틀랜드에 있는 한 회사는 의사들이 [59]환자에게 불편함 없이 망막 전체를 관찰할 수 있게 해주는 기술을 개발하였다.
전기망막도는 특정 질환의 영향을 받는 망막의 전기적 활동을 비침습적으로 측정하는 데 사용됩니다.현재 널리 보급되고 있는 비교적 새로운 기술은 광학 간섭 단층 촬영(OCT)입니다.이 비침습적 기술을 사용하면 망막 미세 구조의 3D 볼륨 또는 고해상도 단면 단층 사진을 조직학적 품질로 얻을 수 있습니다.망막 혈관 분석은 망막의 작은 동맥과 정맥을 검사하는 비침습적 방법으로, 인체 내 다른 곳의 작은 혈관의 형태와 기능에 대한 결론을 도출할 수 있습니다.그것은 심혈관[60] 질환의 예측요인으로 확립되었고,[61] 2019년에 발표된 연구에 따르면 알츠하이머병의 조기 발견에 잠재력이 있는 것으로 보인다.
치료
치료는 질병이나 장애의 성격에 따라 달라진다.
일반적인 치료 방식
다음은 망막 질환에 대한 일반적인 관리 방식입니다.
- 항VEGF 또는 코르티코스테로이드제와 같은 체내 약물
- 유리 요정 수술
- 영양제의 사용
- 망막질환의 전신위험인자 수정
일반적이지 않은 치료 방식
희귀하거나 희귀한 망막 질환 치료 방법 |
|---|
| 망막유전자요법 유전자 치료는 광범위한 망막 질환을 치료할 수 있는 잠재적 방법으로서 유망하다.이것은 유전자를 망막의 일부에 이식하기 위해 비감염성 바이러스를 사용하는 것을 포함한다.재조합 adeno-associated 바이러스(rAAV)벡터는 이상적으로 망막 유전자 치료를 위해 적합한 렌더링 기능의 병원성의 부족, 최소한의 면역원성 그리고 능력적이고 효율적인 안정적으로postmitotic 세포 transduce 등을 포함한 다수 보유하고 있다.[62]rAAV 벡터들이 그들의 능력 effi를 중재하기 위해로 활용됩니다.망막 색소 상피(RPE), 광수용체 세포 및 망막 신경절 세포의 cient 전달.AAV 혈청형, 프로모터 및 안구내 주입 부위의 적절한 조합을 선택하여 각 세포 유형을 특정 대상으로 지정할 수 있습니다. 몇몇 임상시험에서는 이미 rAAV를 사용하여 Leber의 선천성 암모라시스를 치료함으로써 치료법이 안전하고 [63][64]효과적이었다는 긍정적인 결과가 보고되었다.심각한 부작용은 없었으며, 세 연구 모두에서 환자들은 다양한 방법으로 측정한 결과 시각 기능이 향상되었다.사용된 방법은 세 가지 시험 사이에 다양했지만 시각 예민성[64][65][66] 및 기능[65][66][67] 이동성과 같은 기능적 방법뿐만 아니라 빛에[63][68] 반응하는 동공의 능력 및 [69]기능적 MRI 개선과 같은 편향에 덜 민감한 객관적 측정도 포함했다.장기간에 걸쳐 개선세가 지속되었으며, [63][64]1.5년 이상 경과한 후에도 환자들은 계속 좋은 상태를 유지하고 있다. 망막의 독특한 구조와 상대적으로 면역력이 있는 환경이 이 [70]과정을 돕는다.혈망막 장벽을 형성하는 단단한 접합부는 혈중 공급으로부터 망막하 공간을 분리하여 미생물과 대부분의 면역 매개 손상으로부터 보호하고 벡터 매개 치료에 반응할 수 있는 가능성을 높입니다.고도로 구분된 눈의 해부학적 구조는 미세 수술 [71]기술을 사용하여 직접 시각화된 특정 조직에 치료 벡터 현탁액을 정확하게 전달할 수 있도록 지원합니다.망막의 보호환경에서 AAV 벡터는 단일 처리 후 망막색소상피(RPE), 광수용체 또는 신경절 세포에서 높은 수준의 트랜스젠 발현을 장기간 유지할 수 있다.또한 시력, 조영 민감도, 안저 자가 형광(FAF), 어둡게 적응된 시각 역치, 혈관 지름, 번데기 측정, 전자사진과 같은 비침습적 첨단 기술을 주입한 후 시각 기능 및 망막 구조 변화를 일상적이고 쉽게 모니터링할 수 있습니다.hy(ERG), 다초점 ERG 및 광학 코히렌스 단층 촬영(OCT).[72] 이 전략은 나이와 관련된 황반변성의 특징인 신혈관 질환, 당뇨병성 망막증, 그리고 미숙아 망막증을 포함하여 연구되어 온 많은 망막 질환에 대해 효과적이다.성숙한 망막에서의 혈관화 조절은 혈관내피성장인자(VEGF)와 같은 내인성 양성성장인자와 색소상피유래인자(PEDF)와 같은 혈관신생의 억제인자 사이의 균형을 포함하므로, rAAV 매개 PEDF, 안지오스타틴 및 용해성 VEGF 수용체 S-Flt의 발현을 포함한다.e 모든 항혈관신생 단백질은 동물 [73]모델에서 비정상적인 혈관 형성을 감소시키는 것으로 나타났다.특정 유전자 치료법이 망막디스트로피 환자의 중요한 부분을 치료하는데 쉽게 사용될 수 없기 때문에, 보다 일반적으로 적용 가능한 생존 요인 치료법을 개발하는 데 큰 관심이 있다.신경영양 인자는 기존 세포를 유지하고 손상된 눈 신경 집단을 회복하기 위해 발달하는 동안 신경 성장을 조절하는 능력을 가지고 있다.섬유아세포성장인자(FGF) 패밀리 및 GDNF와 같은 신경영양인자를 코드하는 AAV는 광수용체를 아포토시스로부터 보호하거나 세포사멸을 [73]늦추었다. 망막 장기이식은 시도되었지만 큰 성공을 거두지 못했다.MIT, Southern California, RWTH Aachen University 및 New South Wales University에서는 "인공 망막"이 개발 중입니다. 즉, 망막의 광수용체를 우회하고 디지털 카메라의 신호로 부착된 신경 세포를 직접 자극하는 이식입니다. |
역사
기원전 300년경, Herophilos는 시체 눈의 해부를 통해 망막을 확인했다.그는 거미줄과 닮아서 거미줄 층이라고 불렀고, 그물 모양과 비슷해서 거미줄 층이라고 불렀습니다.거미줄이라는 용어는 뇌의 층을 가리키기 위해 나왔고 망막이라는 용어는 [74]망막을 가리키기 위해 나왔다.
1011년과 1021년 사이에, 이븐 알-헤이담은 시력이 물체에서 눈으로 반사되는 빛에서 발생한다는 것을 증명하는 많은 실험을 발표했다.이것은 눈에 의해 방출되는 광선에서 시력이 발생한다는 방출 이론과 일치한다.하지만, 이븐 알-헤이담은 망막에서 형성된 이미지가 반전되었기 때문에 망막이 시력의 시작을 책임질 수 없다고 결정했다.대신에 그는 그것이 [75]렌즈 표면에서 시작되어야 한다고 결정했다.
1604년, 요하네스 케플러는 눈의 광학을 연구했고 망막이 시력이 시작되는 곳임에 틀림없다고 결정했다.그는 다른 과학자들에게 역망막 이미지와 세상을 [76]직립으로 보는 우리의 인식을 조화시키는 것을 맡겼다.
1894년, 산티아고 라몬 이 카할은 레티나 데 위르벨티에레(Retina der Wirbelthiere, 척추동물의 망막)[77]에서 망막 신경세포의 첫 주요 특징을 발표했다.
조지 왈드, 홀단 케퍼 하트라인, 라그나 그라니트는 망막에 [78]대한 과학적 연구로 1967년 노벨 생리의학상을 수상했다.
최근 펜실베니아 대학의 연구는 인간 망막의 대략적인 대역폭이 초당 8.75 메가비트인 반면 기니피그의 망막 전달 속도는 [79]초당 875 킬로비트라고 계산했습니다.
맥클라렌 & 피어슨 대학 런던과 런던의 무어필드 안과 병원의 동료들은 2006년에 공여 세포가 중요한 발달 [80]단계에 있다면 광수용체 세포가 마우스 망막에 성공적으로 이식될 수 있다는 것을 보여주었다.최근 더블린의 Ader와 동료들은 전자현미경을 사용하여 이식된 광수용체가 시냅스 연결을 [81]형성한다는 것을 보여주었다.
2012년, MIT의 세바스찬 승과 그의 연구실은 플레이어가 [82]망막의 뉴런을 추적하는 온라인 시티즌 과학 게임인 EyeWire를 출시했다.EyeWire 프로젝트의 목표는 알려진 광범위한 망막 세포들 내의 특정 세포 유형을 식별하고, 시력이 어떻게 [83][84]작용하는지를 결정하는 데 도움이 되는 망막의 뉴런들 사이의 연결을 매핑하는 것입니다.
기타 이미지
「 」를 참조해 주세요.
- 아데노 관련 바이러스 및 인간 망막 유전자 치료
- Charles Schepens – "현대 망막 수술의 아버지"
- 눈의 진화
- 이중망막
- 망막 스캔
- 고지단백혈증 아형과 관련된 황색종 변이체 목록
- 로돕신
- 시력의 지속성
레퍼런스
- ^ J, Krause William (2005). Krause's Essential Human Histology for Medical Students. Boca Raton, FL: Universal Publishers. ISBN 978-1-58112-468-2.
- ^ a b c d e f g 「감각적인 수신:인간 비전:인간의 눈의 구조와 기능" vol. 27, Encyclopédia Britannica, 1987
- ^ "Penn Researchers Calculate How Much the Eye Tells the Brain" (Press release). PENN Medicine. 26 July 2006. Archived from the original on 11 March 2013. Retrieved 22 April 2022.
- ^ a b Kolb, Helga (1995). "Simple Anatomy of the Retina". Webvision. PMID 21413391. Retrieved 1 January 2018.
- ^ Kolb, Helga. "Photoreceptors". Webvision. Retrieved 11 January 2018.
- ^ Franze K, Grosche J, Skatchkov SN, Schinkinger S, Foja C, Schild D, Uckermann O, Travis K, Reichenbach A, Guck J (2007). "Muller cells are living optical fibers in the vertebrate retina". Proc. Natl. Acad. Sci. U.S.A. 104 (20): 8287–8292. Bibcode:2007PNAS..104.8287F. doi:10.1073/pnas.0611180104. PMC 1895942. PMID 17485670.
- ^ Baker, Oliver (23 April 2010). "Focus: Eye Cells as Light Pipes". Physical Review Focus. Vol. 25, no. 15. doi:10.1103/physrevfocus.25.15.
- ^ a b Bringmann A, Syrbe S, Görner K, Kacza J, Francke M, Wiedemann P, Reichenbach A (2018). "The primate fovea: Structure, function and development". Prog Retin Eye Res. 66: 49–84. doi:10.1016/j.preteyeres.2018.03.006. PMID 29609042. S2CID 5045660.
- ^ Sperling, L.; Hubbard, R. (1 February 1975). "Squid retinochrome". The Journal of General Physiology. 65 (2): 235–251. doi:10.1085/jgp.65.2.235. ISSN 0022-1295. PMC 2214869. PMID 235007.
- ^ "How spiders see the world – Australian Museum". www.australian.museum. Archived from the original on 12 September 2017. Retrieved 5 December 2017.
- ^ Drazen, J. C.; Yeh, J.; Friedman, J.; Condon, N. (June 2011). "Metabolism and enzyme activities of hagfish from shallow and deep water of the Pacific Ocean". Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 159 (2): 182–187. doi:10.1016/j.cbpa.2011.02.018. PMID 21356325.
- ^ Foundations of Vision 2013년 12월 3일 Wayback Machine, Brian A.완델
- ^ '망막 튜닉'2007년 5월 18일 Wayback Machine Virginia - Maryland Regional College of Verginia - Maryland Regional Medicine에서 아카이브 완료
- ^ Goldberg AF, Moritz OL, Williams DS (2016). "Molecular basis for photoreceptor outer segment architecture". Prog Retin Eye Res. 55: 52–81. doi:10.1016/j.preteyeres.2016.05.003. PMC 5112118. PMID 27260426.
- ^ Arshavsky VY, Burns ME (2012). "Photoreceptor signaling: supporting vision across a wide range of light intensities". J Biol Chem. 287 (3): 1620–1626. doi:10.1074/jbc.R111.305243. PMC 3265842. PMID 22074925.
- ^ a b Guyton and Hall Physiology. p. 612.
- ^ Sparrow JR, Hicks D, Hamel CP (2010). "The retinal pigment epithelium in health and disease". Curr Mol Med. 10 (9): 802–823. doi:10.2174/156652410793937813. PMC 4120883. PMID 21091424.
- ^ Letelier J, Bovolenta P, Martínez-Morales JR (2017). "The pigmented epithelium, a bright partner against photoreceptor degeneration". J Neurogenet. 31 (4): 203–215. doi:10.1080/01677063.2017.1395876. PMID 29113536. S2CID 1351539.
- ^ Shepherd, Gordon (2004). The Synaptic Organization of the Brain. New York: Oxford University Press. pp. 217–225. ISBN 978-0-19-515956-1.
- ^ Romer, Alfred Sherwood; Parsons, Thomas S. (1977). The Vertebrate Body. Philadelphia, PA: Holt-Saunders International. p. 465. ISBN 978-0-03-910284-5.
- ^ a b Guyton and Hall Physiology. p. 609.
- ^ a b c Cuenca, Nicolás; Ortuño-Lizarán, Isabel; Pinilla, Isabel (March 2018). "Cellular Characterization of OCT and Outer Retinal Bands Using Specific Immunohistochemistry Markers and Clinical Implications" (PDF). Ophthalmology. 125 (3): 407–422. doi:10.1016/j.ophtha.2017.09.016. hdl:10045/74474. PMID 29037595.
- ^ a b c d e f g h i j k l m n o p q Staurenghi, Giovanni; Sadda, Srinivas; Chakravarthy, Usha; Spaide, Richard F. (2014). "Proposed Lexicon for Anatomic Landmarks in Normal Posterior Segment Spectral-Domain Optical Coherence Tomography". Ophthalmology. 121 (8): 1572–1578. doi:10.1016/j.ophtha.2014.02.023. PMID 24755005.
- ^ Meyer, Carsten H.; Saxena, Sandeep; Sadda, Srinivas R. (2017). Spectral domain optical coherence tomography in macular diseases. New Delhi: Springer. ISBN 978-8132236108. OCLC 964379175.
- ^ a b Hildebrand, Göran Darius; Fielder, Alistair R. (2011). Pediatric Retina. Springer, Berlin, Heidelberg. pp. 39–65. doi:10.1007/978-3-642-12041-1_2. ISBN 978-3642120404.
- ^ Turgut, Burak; University, Fırat; Medicine, School of; Ophthalmology, Department of; Elazig; Turkey (2017). "Past and Present Terminology for the Retinal and Choroidal Structures in Optical Coherence Tomography". European Ophthalmic Review. 11 (1): 59. doi:10.17925/eor.2017.11.01.59.
- ^ "Outer Retinal Layers as Predictors of Vision Loss". Review of Ophthalmology.
- ^ "The ABCs of OCT". Review of Optometry.
- ^ Sherman, J (June 2009). "Photoreceptor integrity line joins the nerve fiber layer as key to clinical diagnosis". Optometry. 80 (6): 277–278. doi:10.1016/j.optm.2008.12.006. PMID 19465337.
- ^ Boston, Marco A. Bonini Filho, MD, and Andre J. Witkin, MD. "Outer Retinal Layers as Predictors of Vision Loss". Retrieved 7 April 2018.
- ^ a b c Heavner, W; Pevny, L (1 December 2012). "Eye development and retinogenesis". Cold Spring Harbor Perspectives in Biology. 4 (12): a008391. doi:10.1101/cshperspect.a008391. PMC 3504437. PMID 23071378.
- ^ Halder, G; Callaerts, P; Gehring, WJ (24 March 1995). "Induction of ectopic eyes by targeted expression of the eyeless gene in Drosophila". Science. 267 (5205): 1788–1792. Bibcode:1995Sci...267.1788H. doi:10.1126/science.7892602. PMID 7892602.
- ^ Cepko, Connie (September 2014). "Intrinsically different retinal progenitor cells produce specific types of progeny". Nature Reviews Neuroscience. 15 (9): 615–627. doi:10.1038/nrn3767. ISSN 1471-003X. PMID 25096185. S2CID 15038502.
- ^ Hatakeyama, J; Kageyama, R (February 2004). "Retinal cell fate determination and bHLH factors". Seminars in Cell & Developmental Biology. 15 (1): 83–89. doi:10.1016/j.semcdb.2003.09.005. PMID 15036211.
- ^ a b Lo Giudice, Quentin; Leleu, Marion; La Manno, Gioele; Fabre, Pierre J. (1 September 2019). "Single-cell transcriptional logic of cell-fate specification and axon guidance in early-born retinal neurons". Development. 146 (17): dev178103. doi:10.1242/dev.178103. ISSN 0950-1991. PMID 31399471.
- ^ Remington, Lee Ann (2012). Clinical anatomy and physiology of the visual system (3rd ed.). St. Louis: Elsevier/Butterworth-Heinemann. ISBN 978-1-4377-1926-0. OCLC 745905738.
- ^ Yu, DY; Yu, PK; Cringle, SJ; Kang, MH; Su, EN (May 2014). "Functional and morphological characteristics of the retinal and choroidal vasculature". Progress in Retinal and Eye Research. 40: 53–93. doi:10.1016/j.preteyeres.2014.02.001. PMID 24583621. S2CID 21312546.
- ^ Kiel, Jeffrey W. Anatomy. Morgan & Claypool Life Sciences. Archived from the original on 5 December 2017. Retrieved 17 April 2017.
- ^ Strauss, Olaf. "The retinal pigment epithelium". Webvision. Retrieved 1 January 2018.
- ^ 망막광생물학
- ^ "Diagrammatic representation of disc shedding and phagosome retrieval into the pigment epithelial cell". Archived from the original on 21 September 2012. Retrieved 22 April 2022.
- ^ Bawa S.R.; YashRoy R.C. (1972). "Effect of dark and light adaptation on the retina and pecten of chicken". Experimental Eye Research. 13 (1): 92–97. doi:10.1016/0014-4835(72)90129-7. PMID 5060117. Archived from the original on 9 October 2014.
- ^ Bawa, S.R.; YashRoy, R.C. (1974). "Structure and function of vulture pecten". Cells Tissues Organs. 89 (3): 473–480. doi:10.1159/000144308. PMID 4428954. Archived from the original on 14 July 2015.
- ^ Sherman, T (1981). "On connecting large vessels to small – the meaning of murray law". Journal of General Physiology. 78 (4): 431–453. doi:10.1085/jgp.78.4.431. PMC 2228620. PMID 7288393.
- ^ Azzopardi G.; Petkov N. (2011). Detection of retinal vascular bifurcations by trainable V4-like filters, in Computer Analysis of Images and Patterns (CAIP), Seville (PDF). Lecture Notes in Computer Science. Vol. 6854. pp. 451–459. doi:10.1007/978-3-642-23672-3_55. ISBN 978-3-642-23671-6. Archived (PDF) from the original on 9 August 2017.
- ^ "Retinal fundus images – Ground truth of vascular bifurcations and crossovers". University of Groningen. Retrieved 20 April 2018.
- ^ "DRIVE: Digital Retinal Images for Vessel Extraction". Image Sciences Institute, Utrecht University. Retrieved 20 April 2018.
- ^ Qureshi, T. A.; Habib, M.; Hunter, A.; Al-Diri, B. (June 2013). A manually-labeled, artery/vein classified benchmark for the DRIVE dataset. Proceedings of the 26th IEEE International Symposium on Computer-Based Medical Systems. pp. 485–488. doi:10.1109/cbms.2013.6627847. ISBN 978-1-4799-1053-3. S2CID 7705121.
- ^ Qureshi, T. A.; Hunter, A.; Al-Diri, B. (June 2014). A Bayesian Framework for the Local Configuration of Retinal Junctions. 2014 IEEE Conference on Computer Vision and Pattern Recognition. pp. 3105–3110. CiteSeerX 10.1.1.1026.949. doi:10.1109/cvpr.2014.397. ISBN 978-1-4799-5118-5. S2CID 14654500.
- ^ Adar SD, Klein R, Klein BE, Szpiro AA, Cotch MF, Wong TY, et al. (2010). "Air Pollution and the microvasculature: a crosssectional assessment of in vivo retinal images in the population based multiethnic study of atherosclerosis (MESA)". PLOS Med. 7 (11): e1000372. doi:10.1371/journal.pmed.1000372. PMC 2994677. PMID 21152417.
- ^ Louwies, Tijs; Panis, Luc Int; Kicinski, Michal; Boever, Patrick De; Nawrot, Tim S. (2013). "Retinal Microvascular Responses to Short-Term Changes in Particulate Air Pollution in Healthy Adults". Environmental Health Perspectives. 121 (9): 1011–1016. doi:10.1289/ehp.1205721. PMC 3764070. PMID 23777785.
- ^ Tso, Mark O.M.; Jampol, Lee M. (1982). "Pathophysiology of Hypertensive Retinopathy". Ophthalmology. 89 (10): 1132–1145. doi:10.1016/s0161-6420(82)34663-1. PMID 7155524.
- ^ Chapman, N.; Dell'omo, G.; Sartini, M. S.; Witt, N.; Hughes, A.; Thom, S.; Pedrinelli, R. (1 August 2002). "Peripheral vascular disease is associated with abnormal arteriolar diameter relationships at bifurcations in the human retina". Clinical Science. 103 (2): 111–116. doi:10.1042/cs1030111. ISSN 0143-5221. PMID 12149100.
- ^ Patton, N.; Aslam, T.; MacGillivray, T.; Deary, I.; Dhillon, B.; Eikelboom, R.; Yogesan, K.; Constable, I. (2006). "Retinal image analysis: Concepts, applications and potential". Progress in Retinal and Eye Research. 25 (1): 99–127. doi:10.1016/j.preteyeres.2005.07.001. PMID 16154379. S2CID 7434103.
- ^ Wong TY, Knudtson MD, Klein R, Klein BE, Meuer SM, Hubbard LD (2004). "Computer assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: methodology, correlation between eyes, and effect of refractive errors". Ophthalmology. 111 (6): 1183–1190. doi:10.1016/j.ophtha.2003.09.039. PMID 15177969.
- ^ Chen, Janglin; Cranton, Wayne; Fihn, Mark (2016). Handbook of visual display technology (2nd ed.). Cham, Switzerland: Springer. ISBN 9783319143460. OCLC 962009228.
- ^ Retina (4th ed.). Philadelphia: Elsevier/Mosby. 2006. pp. 2013–2015. ISBN 978-0-323-02598-0. OCLC 62034580.
- ^ Frith, Peggy; Mehta, Arpan R (November 2021). "The retina as a window into the brain". The Lancet Neurology. 20 (11): 892. doi:10.1016/S1474-4422(21)00332-X. PMC 7611980. PMID 34687632.
- ^ '미래의 인제니아를 바라보다', 2007년 3월
- ^ Seidelmann, SB; et al. (1 November 2016). "Retinal Vessel Calibers in Predicting Long-Term Cardiovascular Outcomes". Circulation. 134 (18): 1328–1338. doi:10.1161/CIRCULATIONAHA.116.023425. PMC 5219936. PMID 27682886.
- ^ Querques, G; et al. (11 January 2019). "Functional and morphological changes of the retinal vessels in Alzheimer's disease and mild cognitive impairment". Scientific Reports. 9 (63): 63. Bibcode:2019NatSR...9...63Q. doi:10.1038/s41598-018-37271-6. PMC 6329813. PMID 30635610.
- ^ Dinculescu Astra; Glushakova Lyudmyla; Seok-Hong Min; Hauswirth William W (2005). "Adeno-associated virus-vectored gene therapy for retinal disease". Human Gene Therapy. 16 (6): 649–663. doi:10.1089/hum.2005.16.649. PMID 15960597.
- ^ a b c Cideciyan A. V.; Hauswirth W. W.; Aleman T. S.; Kaushal S.; Schwartz S. B.; Boye S. L.; Windsor E. A. M.; et al. (2009). "Human RPE65 gene therapy for Leber congenital amaurosis: persistence of early visual improvements and safety at 1 year". Human Gene Therapy. 20 (9): 999–1004. doi:10.1089/hum.2009.086. PMC 2829287. PMID 19583479.
- ^ a b c Simonelli F.; Maguire A. M.; Testa F.; Pierce E. A.; Mingozzi F.; Bennicelli J. L.; Rossi S.; et al. (2010). "Gene therapy for Leber's congenital amaurosis is safe and effective through 1.5 years after vector administration". Molecular Therapy. 18 (3): 643–650. doi:10.1038/mt.2009.277. PMC 2839440. PMID 19953081.
- ^ a b Maguire A. M.; Simonelli F.; Pierce E. A.; Pugh E. N.; Mingozzi F.; Bennicelli J.; Banfi S.; et al. (2008). "Safety and efficacy of gene transfer for Leber's congenital amaurosis". The New England Journal of Medicine. 358 (21): 2240–2248. doi:10.1056/NEJMoa0802315. PMC 2829748. PMID 18441370.
- ^ a b Maguire A. M.; High K. A.; Auricchio A.; Wright J. F.; Pierce E. A.; Testa F.; Mingozzi F.; et al. (2009). "Age-dependent effects of RPE65 gene therapy for Leber's congenital amaurosis: a phase 1 dose-escalation trial". Lancet. 374 (9701): 1597–1605. doi:10.1016/S0140-6736(09)61836-5. PMC 4492302. PMID 19854499.
- ^ Bainbridge J. W. B.; Smith A. J.; Barker S. S.; Robbie S.; Henderson R.; Balaggan K.; Viswanathan A.; et al. (2008). "Effect of gene therapy on visual function in Leber's congenital amaurosis" (PDF). The New England Journal of Medicine. 358 (21): 2231–2239. CiteSeerX 10.1.1.574.4003. doi:10.1056/NEJMoa0802268. hdl:10261/271174. PMID 18441371. Archived (PDF) from the original on 11 August 2017.
- ^ Hauswirth W. W.; Aleman T. S.; Kaushal S.; Cideciyan A. V.; Schwartz S. B.; Wang L.; Conlon T. J.; et al. (2008). "Treatment of Leber Congenital Amaurosis Due to RPE65Mutations by Ocular Subretinal Injection of Adeno-Associated Virus Gene Vector: Short-Term Results of a Phase I Trial". Human Gene Therapy. 19 (10): 979–990. doi:10.1089/hum.2008.107. PMC 2940541. PMID 18774912.
- ^ Ashtari M.; Cyckowski L. L.; Monroe J. F.; Marshall K. A.; Chung D. C.; Auricchio A.; Simonelli F.; et al. (2011). "The human visual cortex responds to gene therapy-mediated recovery of retinal function". The Journal of Clinical Investigation. 121 (6): 2160–2168. doi:10.1172/JCI57377. PMC 3104779. PMID 21606598.
- ^ Bennett J (2003). "Immune response following intraocular delivery of recombinant viral vectors". Gene Therapy. 10 (11): 977–982. doi:10.1038/sj.gt.3302030. PMID 12756418.
- ^ Curace Enrico M.; Auricchio Alberto (2008). "Versatility of AAV vectors for retinal gene transfer". Vision Research. 48 (3): 353–359. doi:10.1016/j.visres.2007.07.027. PMID 17923143. S2CID 9926758.
- ^ den Hollander, Anneke I.; Roepman, Ronald; Koenekoop, Robert K.; Cremers, Frans P.M. (2008). "Leber congenital amaurosis: Genes, proteins and disease mechanisms". Progress in Retinal and Eye Research. 27 (4): 391–419. doi:10.1016/j.preteyeres.2008.05.003. PMID 18632300. S2CID 30202286.
- ^ a b Rolling, F. (2004). "Recombinant AAV-mediated gene transfer to the retina: gene therapy perspectives". Gene Therapy. 11 (S1): S26–S32. doi:10.1038/sj.gt.3302366. ISSN 0969-7128. PMID 15454954.
- ^ 돕슨, J. F. (1925년)알렉산드리아의 영웅.왕립 의학회 의사록, 18, 19-32.https://doi.org/10.1177/003591572501801704
- ^ 사브라, A. I. (Ed.) (1011–1021/1989).Ibn Al-Haytham의 광학:제I-II권: 직시(A. I. Sabra, Trans)워버그 연구소.
- ^ 피시맨, R. S. (1973년)케플러의 망막 이미지 발견안과학문서보관소, 89(1), 59-61.https://doi.org/10.1001/archopht.1973.01000040061014
- ^ "Santiago Ramón y Cajal – Biographical". www.nobelprize.org. Archived from the original on 6 October 2015. Retrieved 20 October 2015.
- ^ "Nobelprize.org". nobelprize.org. Archived from the original on 30 June 2017. Retrieved 5 December 2017.
- ^ "Calculating the speed of sight". newscientist.com. Archived from the original on 31 May 2015. Retrieved 5 December 2017.
- ^ MacLaren, RE; Pearson, RA; MacNeil, A; et al. (November 2006). "Retinal repair by transplantation of photoreceptor precursors" (PDF). Nature. 444 (7116): 203–207. Bibcode:2006Natur.444..203M. doi:10.1038/nature05161. hdl:2027.42/62596. PMID 17093405. S2CID 4415311.
- ^ Bartsch, U.; Oriyakhel, W.; Kenna, P. F.; Linke, S.; Richard, G.; Petrowitz, B.; Humphries, P.; Farrar, G. J.; Ader, M. (2008). "Retinal cells integrate into the outer nuclear layer and differentiate into mature photoreceptors after subretinal transplantation into adult mice". Experimental Eye Research. 86 (4): 691–700. doi:10.1016/j.exer.2008.01.018. PMID 18329018.
- ^ "About: EyeWire". Archived from the original on 13 February 2012. Retrieved 26 March 2012.
- ^ "Retina << EyeWire". Archived from the original on 24 March 2012. Retrieved 27 March 2012.
- ^ "EyeWire". Archived from the original on 24 April 2012. Retrieved 27 March 2012.
추가 정보
- S. Ramon y Cajal, Histologie du Systéme Neurux de l'Homme et des Vertés, 파리, 1911.
- Rodieck RW (1965). "Quantitative analysis of cat retinal ganglion cell response to visual stimuli". Vision Res. 5 (11): 583–601. doi:10.1016/0042-6989(65)90033-7. PMID 5862581.
- Wandell, Brian A. (1995). Foundations of vision. Sunderland, Mass: Sinauer Associates. ISBN 978-0-87893-853-7.
- Wässle H, Boycott BB (1991). "Functional architecture of the mammalian retina". Physiol. Rev. 71 (2): 447–480. doi:10.1152/physrev.1991.71.2.447. PMID 2006220.
- Schulz HL, Goetz T, Kaschkoetoe J, Weber BH (2004). "The Retinome – Defining a reference transcriptome of the adult mammalian retina/retinal pigment epithelium". BMC Genomics (about a transcriptome for eye colour). 5 (1): 50. doi:10.1186/1471-2164-5-50. PMC 512282. PMID 15283859.
- Dowling, John (2007). "Retina". Scholarpedia. 2 (12): 3487. Bibcode:2007SchpJ...2.3487D. doi:10.4249/scholarpedia.3487.
외부 링크
- Histology of the Eye(눈의 조직학), William Krause, Deput에 의해 편집되었습니다.미주리 대학교 의과대학 병리학 해부학
- 아이, 브레인, 비전 – 온라인 책 – David Hubel
- Kolb, H., Fernandez, E. 및 Nelson.웹비전: 척추동물 망막의 신경 조직입니다.유타주 솔트레이크시티: 유타대학교 존 모란 아이센터.2014년 7월 22일 취득.
- 데모: 인공 Retina, MIT Technology Review, 2004년 9월.기술검토에서의 임플란트 연구 보고서
- 광수용체 이식 성공, MIT Technology Review, 2006년 11월.줄기세포가 시력을 회복하는 방법기술 리뷰
- 뉴사우스웨일스 대학교 바이오메디컬 엔지니어링 대학원 Australian Vision Prostesis Group
- 뷔르츠부르크 대학교 레티나 중앙, 유전학 및 인간 레티나 질병
- 망막층 이미지.미국 국립 의학 도서관 뉴로사이언스 제2판
- 제레미 나탄스의 세미나: "척추동물의 망막:구조, 기능 및 진화"
- Retina – 세포 중심 데이터베이스
- 조직 이미지: 07901loa – 보스턴 대학의 조직학 학습 시스템
- Medline Plus 백과사전: 002291