정지 상태
Stationary state| 에 대한 일련의 기사의 일부 |
| 양자역학 |
|---|
정지상태는 모든 관측가능성이 시간에 독립된 양자 상태를 말한다. (다른 에너지의 양자 중첩 대신) 에너지 운영자의 고유 벡터다. 에너지 고유벡터, 에너지 고유상태, 에너지 고유함수 또는 에너지 고유함수라고도 한다. 그것은 화학에서 원자 궤도 및 분자 궤도 개념과 매우 유사하며, 아래에 약간의 차이가 설명되어 있다.
소개
정지 상태를 정지상태라고 하는 것은 시스템이 시간이 흐를 때와 같은 상태에 머물러 있기 때문에 모든 관찰 가능한 방법으로 정지상태라고 한다. 단일 입자 해밀턴의 경우, 이것은 입자의 위치, 속도, 스핀 등에 대해 일정한 확률 분포를 갖는다는 [1]것을 의미한다. (입자의 환경도 정적인 것으로 가정하면, 즉, 해밀턴의 시간은 변하지 않는다.) 파동 기능 자체가 정지되어 있지 않음: 그것은 서 있는 파장을 형성하기 위해 그것의 전체적인 복잡한 위상 요소를 지속적으로 변화시킨다. 스탠딩파의 진동 주파수인 시간 플랑크의 상수는 플랑크-아인슈타인 관계에 따른 국가의 에너지다.
정지 상태는 시간 독립 슈뢰딩거 방정식에 대한 해결책인 양자 상태를 말한다.
어디에
이것은 고유값 방정식이다. {H}은(는) 벡터 공간의 선형 연산자, , ⟩ 은(는) {의 고유 벡터,E 의 고유값이다.
정지 상태 {\}을(를) 시간 의존적인 슈뢰딩거 방정식에 연결하면 다음과 같은 결과가 나온다.[2]
이(가) 시간 독립적이라고 가정하면 이 방정식은 언제든지 t를 유지한다. 따라서 }이가) 시간에 따라 어떻게 달라지는지를 설명하는 미분 방정식이다. 그 해결책은 다음과 같다.
따라서 정지상태는 전체적인 복잡한 위상계수와 함께 진동하는 입자파이며, 진동각주파수는 에너지를 로 나눈 것과 같다
정지 상태 특성
위와 같이 정지 상태는 수학적으로 일정하지 않다.
그러나 주의 모든 관측 가능한 성질은 사실상 시간에 따라 일정하다. 예를 들어, ( ) {\}이() 단순한 1차원 단분파 함수 (x , ){\을 나타내는 경우, 입자가 위치 x에 있을 확률은 다음과 같다.
시간 t와는 독립적이다.
하이젠베르크 그림은 양자역학의 대체 수학 공식으로, 정지 상태가 정말로 수학적으로 시간에 따라 일정하다.
위에서 언급한 바와 같이, 이 방정식들은 해밀턴인이 시간 독립적이라고 가정한다. 이는 단순히 시스템의 나머지가 고정되어 있고 정지되어 있을 때 정지 상태가 정지되어 있다는 것을 의미한다. 예를 들어 수소 원자의 1s 전자는 정지 상태에 있지만 수소 원자가 다른 원자와 반응하면 전자도 당연히 교란된다.
자연 붕괴
자발적인 붕괴는 정지 상태에 대한 문제를 복잡하게 만든다. 예를 들어 단순(비유동적) 양자역학에 따르면 수소 원자는 많은 정지 상태를 가지고 있는데, 1초, 2초, 2p 등 모두 정지상태다. 그러나 실제로는 지상 1초만이 진정으로 '역적'이다. 에너지 수준이 높은 전자는 자연적으로 하나 이상의 광자를 방출하여 지면 상태로 썩게 된다.[3] 이는 정지 상태가 변하지 않는 특성을 가져야 한다는 생각과는 상반되는 것으로 보인다.
비상대적 양자역학에 사용되는 해밀턴어는 양자장 이론에서 해밀턴과 근사치에 불과하다는 설명이다. 고에너지 전자 상태(2s, 2p, 3s 등)는 대략적인 해밀턴에 따른 정지 상태지만 진공 변동 때문에 진정한 해밀턴에 따른 정지 상태는 아니다. 반면에 1s 상태는 근사치나 진실한 해밀턴어 둘 다에 따르면 정말로 정지된 상태라고 할 수 있다.
화학에서의 "오르비탈"과 비교
궤도(궤도)는 일렉트로닉 원자나 분자의 정지 상태(또는 그 근사치)이다. 더 구체적으로 말하자면, 원자의 전자에 대한 원자 궤도 또는 분자의 전자에 대한 분자 궤도.[4]
단 하나의 전자(예: 원자 수소 또는2+ H)만 함유한 분자의 경우 궤도(궤도)는 분자의 총 정지 상태와 정확히 동일하다. 그러나 많은 전자 분자의 경우 궤도(궤도)는 총 정지 상태와는 완전히 다른데, 이것은 좀 더 복잡한 설명이 필요한 다입자 상태(예: 슬레이터 결정체)이다.[5] 특히 많은 전자 분자에서 궤도란 분자의 총 정지 상태가 아니라 분자 내 단일 전자의 정지 상태를 말한다. 이 궤도 개념은 우리가 해밀턴의 전자-전자 순간 반발 용어를 단순화 가정으로 무시하면, 우리는 많은 전자 분자의 총유전자를 각각의 휘인 개별 전자 정지 상태(또는 비트)와 별개의 기여로 분해할 수 있다는 근사치 하에서만 의미가 있다.ch는 1분의 1 근사치로 구한다. (운하게도 화학자와 물리학자들은 이 "단일 전자 근사치"를 자주 사용할 수 있다(그러나 항상은 아니다). 이러한 의미에서 많은 전자 시스템에서 궤도(Obtra)는 시스템 내 개별 전자의 정지 상태로 간주될 수 있다.
화학에서 분자 궤도의 계산은 일반적으로 Born-Openheimer 근사치를 가정하기도 한다.
참고 항목
참조
- ^ 코헨-탄누드지, 클로드, 버나드 디우, 프랑크 랄로어. Quantum Mechanics: 제1권. 헤르만, 1977. 페이지 32.
- ^ 콴타: 1974년 옥스퍼드 대학 출판부의 P.W. Atkins, P.W. Atkins, Oxford University Press, ISBN0-19-855493-1
- ^ 원자, 분자, 고체, 핵 및 입자의 양자물리학(2판), R. 아이즈버그, R. 레스닉, 존 와일리 & 선스, 1985년 ISBN 978-0-471-87373-0
- ^ 물리 화학, P.W. 앳킨스 옥스퍼드대 출판부, 1978년 ISBN 0-19-855148-7
- ^ Löwdin, Per-Olov (1955). "Quantum theory of many-particle systems. I. Physical interpretations by means of density matrices, natural spin-orbitals, and convergence problems in the method of configurational interaction". Physical Review. 97 (6): 1474–1489. Bibcode:1955PhRv...97.1474L. doi:10.1103/PhysRev.97.1474.
추가 읽기
- 정지 상태, 앨런 홀든, 1971년 옥스퍼드 대학교 출판부, ISBN 0-19-851121-3

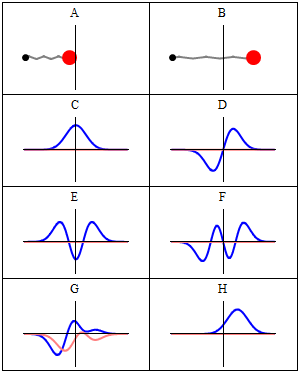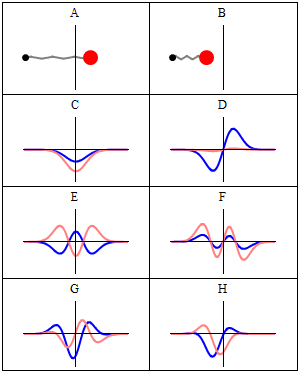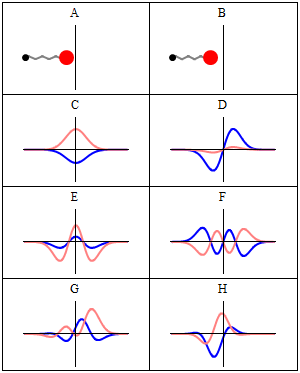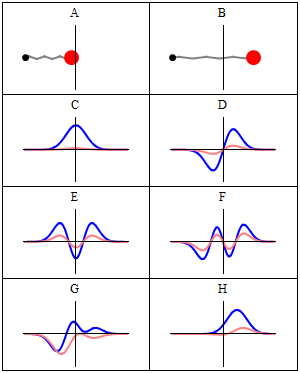

 , 이 방정식을 만족하면 정지 상태가 된다.
, 이 방정식을 만족하면 정지 상태가 된다. (는) 해밀턴식
(는) 해밀턴식  (는)
(는) 









