확산판브론치올염
Diffuse panbronchiolitis| 확산판브론치올염 | |
|---|---|
 | |
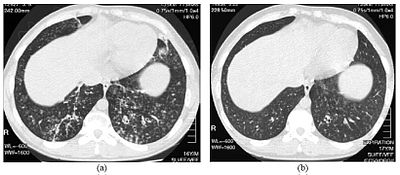
| 확산성 범브론치올염에 걸린 16세 소년의 가슴 하부의 고해상도 컴퓨터 단층촬영 영상 | |
| 전문 | 풀몬학 |
확산 범브론치올염(DPB)은 원인을 알 수 없는 염증성 폐질환이다.그것은 심하고 진행성인 기관지염의 형태로서 기관지염의 염증성 질환이다. 폐의 작은 공기 통로).확산이라는 용어는 병변이 양쪽 폐에 걸쳐 나타난다는 것을 의미하며, 범브론치올염은 호흡기 기관지(가스 교환과 관련된 것)의 모든 층에서 발견되는 염증을 말한다.DPB는 말기 기관지염의 심한 염증과 결절과 같은 병변, 만성 축농증, 가래 생성과 함께 심한 기침 등을 유발한다.
이 질병은 주로 동아시아 혈통에서 발견되는 여러 유전자에 의해 DPB를 일으키는 박테리아나 바이러스에 대한 민감성, 즉 면역체계 내성이 부족할 때 발생하는 것으로 생각된다.일본인의 발생률이 가장 높으며 한국인이 그 뒤를 잇고 있다.DPB는 남성에게서 더 자주 발생하며 보통 40세 전후에 시작한다.1960년대 초 뚜렷한 신종 질환으로 인정받았고 1969년 공식적으로 확산 범브론치올염으로 명명됐다.
만약 치료하지 않고 내버려두면, DPB는 기관지확장, 기관지확장, 기관지확장, 기관지 통로의 점액공급을 포함하는 되돌릴 수 없는 폐 질환으로 발전한다.에리트로마이신 등 마크로라이드 항생제로 DPB를 매일 치료하면 증상이 완화되고 생존시간이 늘어나지만 현재 알려진 치료법은 없다.DPB의 궁극적인 결과는 호흡기 장애와 심장 질환일 수 있다.
분류
"브론치올염"이란 용어는 일반적으로 기관지에 염증이 생기는 것을 말한다.[1]DPB는 '제1기 기관지염'의 일종으로 분류되는데, 이는 기관지염의 근본적인 원인이 기관지염에서 비롯되거나 기관지염에 국한된다는 것을 의미한다.[2][3]DPB와 함께 1차 기관지염의 추가적인 형태로는 기관지염, 모낭 기관지염, 호흡기 기관지염, 광물질 분진 기도 질환, 기타 여러 가지가 있다.[2]DPB와 달리 '1차'로 여겨지지 않는 기관지염은 만성 기관지염과 같은 더 큰 기도의 질병과 연관될 것이다.[2][3]
징후 및 증상
DPB의 증상은 만성 부비동염(염증성 파라나산염), 헉헉거림, 균열(폐 속의 가래와 분비물 등 장애물에 의해 발생하는 자극성 소리), 호흡곤란(호흡곤란), 가래(기침식 가래)을 많이 내는 심한 기침 등이다.가래에 고름이 있을 수도 있고, 영향을 받은 사람은 열이 있을 수도 있다.DPB 진행의 대표적인 징후로는 기관지 통로의 확장(대량화)과 저산소혈증(혈중 산소 농도가 낮음)이 있다.DPB를 치료하지 않고 방치하면 기관지확장증이 발생하는데, 기관지확장증은 기관지확장벽의 팽창과 두꺼워짐, 호흡기와 말기 기관지염에 대한 염증 손상, 폐에 점액이 고인 것이 특징이다.[4][5]DPB는 진행성 호흡부전, 과마니아(혈중 이산화탄소 수치의 증가)와 연관되어 있으며, 결국 폐고혈압(폐정맥과 동맥의 고혈압)과 코르 펄모날(심장의 우심실의 탈질 또는 "우심부전")을 일으킬 수 있다.[6][7]
원인
DPB는 특발성 질환으로 정확한 생리적, 환경적 또는 병원성 원인을 알 수 없다.그러나 그 병원성(질병이 작용하는 방식)과 관련된 몇 가지 요인은 의심받고 있다.[4]
주요 조직적합성 복합체(MHC)는 면역 체계와 연관된 대부분의 척추동물에서 발견되는 큰 유전체 부위다.인간의 6번 염색체에 위치한다.인간에서 MHC의 하위집합은 박테리아나 바이러스 같은 병원체에 대한 적응 면역의 일부로서 항원 발현 시스템을 제어하는 인간 백혈구 항원(HLA)이다.인간 세포가 병원체에 감염되었을 때, 그들 중 일부는 병원체의 단백질 일부를 그들의 표면에 나타낼 수 있다; 이것을 "항생체 표시"라고 부른다.감염된 세포는 세포독성 T세포의 표적이 되고, 이 표적은 감염된 세포를 죽여서 몸에서 제거될 수 있다.[8]
DPB 감수성에 대한 유전적 소인은 동아시아 혈통 사람들에게 공통적으로 나타나는 두 개의 HLA 하플로타입형(쌍체 염색체들 사이의 뉴클레오티드 또는 유전자 서열 차이, 공통 민족성이나 특성들 사이에서 발생할 가능성이 더 높은 것)으로 국부화되었다.HLA-B54는 일본어의 DPB와 연관되어 있으며, HLA-A11은 한국어의 DPB와 연관되어 있다.[9]클래스 I HLA의 이 영역 내에 있는 여러 유전자가 질병에 대한 민감도를 증가시킴으로써 DPB에 책임이 있다고 여겨진다.[7][10]DPB 유전자를 찾는 과정에서 일본과 한국 개인의 HLA 프로파일에서 공통적인 유전적 배경과 유사성이 고려됐다.[10]HLA-B와[11] HLA-A[12] 사이의 어딘가에 위치한 의심스러운 질병-감각 유전자의 돌연변이가 HLA-B54와 HLA-A11을 모두 운반하는 조상 염색체에서 발생했다는 주장이 제기되었다.또한, 질병 위치(염색체 상의 위치) 주변에서 일어나는 여러 유전적 재조합 사건으로 인해 일본어의 HLA-B54, 한국인의 HLA-A11과 연관되었을 가능성도 있다.추가 연구 결과, DPB 감수성 유전자가 6p21.3 염색체의 HLA-B 위치 근처에 위치한다는 결론을 내렸다.이 지역 내에서는 유전적 원인 규명이 계속되고 있다.[9][10]
HLA에 속하는 많은 유전자들이 정체불명의 상태로 남아 있기 때문에 위치 복제(특정 유전자의 염색체 위 위치만 알려졌을 때 특정 유전자를 식별하기 위해 사용되는 방법)는 점액성 유전자가 DPB와 연관되어 있다는 것을 결정하기 위해 사용되어 왔다.또한 DPB 수용성 영역에서 확인된 HLA 유전자에 의한 질병도 조사되었다.이 중 하나인 맨 림프구 증후군 I(BLS I)는 만성 축농증, 기관지 염증 및 결절, H. 인플루언서의 존재 등 감염자 중에서 DPB와 많은 유사성을 보인다.또한 DPB와 마찬가지로 BLS I는 에리트로마이신 요법에 대해 증상의 분해능을 보여줌으로써 호의적으로 반응한다.이 두 질병의 유사성, 동일한 치료방식과 일치하는 성공성, 그리고 BLS I를 담당하는 유전자가 HLA의 DPB 유발 영역 내에 위치한다는 사실은 DPB를 담당하는 유전자의 성립을 좁게 한다.[9]독성 가스를 흡입하고 담배를 피우는 것과 같은 환경적 요인은 DPB에 작용하지 않는 것으로 믿어지고 있으며, 미확인 박테리아나 바이러스와 같은 알려지지 않은 환경적 및 기타 비유전적 원인도 배제되지 않고 있다.[4][6][7]
진행성 다체제 폐질환인 낭포성 섬유증(CF)은 DPB의 유전적 원인을 찾는 과정에서 검토됐다.이것은 여러 가지 이유에서입니다.CF는 DPB와 마찬가지로 심각한 폐염, 풍부한 점액 생산, 감염을 유발하며, 한 지리적 집단의 백인 사이에서 희귀한 유전적 우위성을 보여준다. 반면 DPB는 동아시아인들 사이에서 지배적인 반면, CF는 주로 유럽 혈통의 개인들에게 영향을 미친다.어떤 유전자도 DPB의 원인으로 연루되지 않았지만, 특정 유전자의 돌연변이(유럽인에서 일어날 가능성이 훨씬 더 높음)는 CF를 유발한다.CF를 일으키는 유전자의 이러한 돌연변이는 DPB의 인자는 아니지만, 이 유전자의 고유한 다형성(분열)이 어느 한 질환의 영향을 받지 않는 많은 아시아인에게서 일어나는 것으로 알려져 있다.어떤 돌연변이 상태에서도 이 유전자가 DPB에 기여할 수 있을지는 조사되고 있다.[4][9]
병리학
염증은 인체 면역반응의 정상적인 부분으로, 중성미자(염증을 일으키는 백혈구)를 포함한 백혈구(백혈구)가 모이고, 항암(특정 세포에서 방출되는 단백질, 다른 세포의 반응을 활성화하거나 유도하는 것)이 세균이 있는 신체 어느 곳에나 축적된다.일리 또는 바이러스 감염이 발생한다.염증은 박테리아와 바이러스의 활동을 방해하고, 이를 몸에서 제거하는 역할을 한다.DPB에서는 해모필루스 인플루엔자a, 녹농균과 같은 박테리아가 염증세포를 기관지 조직으로 확산시킬 수 있다.그러나 DPB와 함께 두 박테리아 모두 존재하지 않을 때, 아직 알 수 없는 이유로 염증이 계속된다.[4][5]어느 경우든 DPB 내 염증은 너무 심해서 기관지 벽에 염증세포를 포함한 결절이 형성될 수 있다.[4][13]기도에 염증이 생기고 염증이 생기면 가래로 기침을 해야 하는 과잉 점액도 생긴다.[4][6]염증, 결절 발달, 감염, 점액, 잦은 기침의 조합은 DPB의 호흡곤란 증상에 기여한다.[4][5]
P. 에어로기노사와 H. 인플루언서의 유무에 상관없이 DPB에 염증이 지속된다는 사실은 DPB 병원체의 몇 가지 메커니즘을 결정하는 수단을 제공한다.[5]로이코트리엔은 필수 지방산으로 만들어진 신호 분자로, 기도에서 염증 세포의 증식과 과다한 점액 생성을 유발하여 많은 폐질환에서 역할을 한다.[14]DPB와 다른 폐질환에서 중성미자 관련 염증의 주요 중재자는 백혈구 B4로, 화학적 축을 통한 중성미 증식(일부 세포의 특정 분자 방향 또는 멀어지는 움직임)을 전문으로 한다.[4][9]
DPB 내 염증도 케모카인 MIP-1알파 및 CD8+ T세포에 관여하여 발생한다.호흡기에서 발견되는 항균 펩타이드 계열인 베타데펜신은 P. 에어로기노사 등 병원체가 있을 때 DPB에 추가 염증을 일으키는 역할을 한다.인간 T-림프코방성 바이러스인 인간 T-림프코방성 바이러스 I형은 T 도우미 세포를 감염시키고 DPB와 관련된 알려져 있거나 알려지지 않은 병원균의 존재를 인식함에 있어 그 효과를 변화시킴으로써 DPB 병원균을 수정한다.[4][9]
진단
DPB의 진단을 위해서는 폐 조직과 기관지 조직의 분석이 필요하며, 폐 조직 생검이 필요할 수 있고, 폐에 대해 보다 선호하는 고해상도 컴퓨터 단층촬영(HRCT) 스캔이 필요하다.[7]진단기준에는 말기 내 결절로 나타나는 호흡기 기관지 및 폐조직 병변의 모든 층에 심한 염증이 있고 양쪽 폐에는 호흡기 기관지 질환이 있다.[4]DPB의 결절은 폐의 X선에 보면 불투명한 덩어리로 나타나며, 폐 기능 검사(PFT)로 평가되는 기도폐쇄를 유발할 수 있다.[6]폐 X선은 또한 DPB의 또 다른 표시인 기관지 통로의 확장이 나타날 수 있다.HRCT 스캔은 종종 점액이 있는 일부 기관지 통로의 막힘 현상을 보여주는데, 이것을 "나무 삽입" 패턴이라고 한다.[7]호흡곤란의 또 다른 징후인 저산소혈증은 동맥혈가스라는 혈액검사를 이용해 혈액의 산소와 이산화탄소 함량을 측정해 나타난다.DPB에서 관찰된 다른 발견으로는 폐 라이닝에서 림프구(감염과 싸우는 백혈구), 중성미자, 거품성 히스테리구(대식세포)의 증식이 있다.H. 인플루엔자a, P. 에어로기노사 등의 박테리아도 검출이 가능하며, 후자는 질병이 진행됨에 따라 더욱 두드러지게 된다.[4][5]혈액의 백혈구, 박테리아 및 기타 세포 함량은 완전한 혈액수(CBC)를 취함으로써 측정할 수 있다.IgG 및 IgA(면역글로불린 종류)의 증가된 수준과 함께 류마티스 인자(자율면역성 지표)의 존재도 볼 수 있다.혈액 속에 항체가 존재하는 것에 대응하여 적혈구가 뭉쳐 있는 혈구혈소판도 또한 발생할 수 있다.glution)도 발생할 수 있다.중성미자, 베타-디펜신, 백혈구, 케모킨은 평가를 위해 DPB를 투여한 개인의 기관지 기도에서 제거된 후 주입된 기관지형 라바지액에서도 검출될 수 있다.[4][9]
차등진단
일부 폐쇄성 폐질환의 차등진단(중복기능이 있는 질환 간 정확한 진단)에서는 DPB를 종종 고려한다.많은 DPB 증상들은 천식, 만성 기관지염, 폐기종과 같은 다른 폐쇄성 폐질환에서 발견되는 증상들과 유사하다.이러한 질환에서는 헐떡거림, 가래 생성과 함께 기침, 호흡곤란이 흔한 증상이며 폐 기능 검사에서 폐쇄성 호흡기 기능 장애가 발견된다.[6]낭포성 섬유증은 DPB와 마찬가지로 심각한 폐염증, 과도한 점액 생성, 감염을 유발하지만, DPB는 CF처럼 췌장이나 전해질에 장애를 일으키지 않기 때문에 두 질환은 서로 다르며 아마도 관련이 없을 것이다.[4][9]DPB는 양쪽 폐의 기관지에 결절로 나타나는 X선에 나타나는 병변, 호흡 기관지의 모든 조직층에 염증, 동아시아 혈통을 가진 개인들 사이에서 더 높은 유병률로 구별된다.[4]
DPB와 기관지염 지주는 일차 기관지염의 두 가지 형태다.[2]두 질환의 특정한 겹치는 특징에는 종종 고름이 가득한 가래가 많은 강한 기침, 낮은 기관지와 기관지 지역의 폐 X선에서 볼 수 있는 결절, 그리고 만성 축농증이 있다.DPB에서 결절은 호흡기 기관지에 더 많이 제한되는 반면 OB에서는 3차 기관지에서 2차 기관지에 이르는 막조직 기관지(기관지의 초기 비카틸라긴성 부분)에서 종종 발견된다.OB는 세계적으로 유행하는 기관지질병인 반면 DPB는 주로 일본에서 더 국지적으로 유행하고 있다.[2][6]최근 몇 년 동안 DPB를 임상적으로 인식하기 전에는 기관지확장증, COPD, IPF, phisis miliaris, sarcoidosis 또는 치경세포암으로 오진하는 경우가 많았다.[15]
치료
에리트로마이신 같은 마크로롤라이드 항생제는 장기간에 걸쳐 규칙적으로 복용하면 DPB에 효과적인 치료법이다.[16][17][18]클라리트로마이신(Clarithromycin)이나 록시트로마이신(Roxithromycin)도 흔히 쓰인다.[19]DPB 및 이와 유사한 폐질환에서 마크로리드가 성공적으로 나타난 것은 면역항암제(면역반응 조절)를 통해 특정 증상을 관리하는 데서 비롯되는데,[17] 항생제를 저용량으로 복용하면 얻을 수 있다.치료는 2-3년 동안 매일[7] 에리트로마이신을 구강 투여하는 것으로 구성되는데, 이는 DPB의 효과를 획기적으로 향상시키는 것으로 나타난 연장된 기간이다.이는 여러 질병 관련 완화 기준 중 DPB 치료를 받고 있는 개인이 BAL 액에서 정상 중성미자 수치가 검출되고 혈중 가스(혈중 산소와 이산화탄소의 양을 측정하는 동맥혈검사) 판독 결과 혈중 활성산소가 정상 범위 내에 있는 것으로 나타났을 때 명백하다..[16][17][20] 이러한 경우 에리트로마이신 치료로부터 일시적인 휴식을 허용하는 것이 제안되었다. 마크로라이드 저항성 P. 에어로기노사의 형성을 줄이기 위해서.[16]그러나 DPB 증상은 대개 다시 나타나므로 치료를 재개해야 할 것이다.매우 효과적이지만 에리트로마이신은 특히 마크로라이드 저항성 P 에어로기노사가 있거나 이전에 치료되지 않은 DPB가 호흡기 장애가 발생할 정도로 진행되었다면 이 병에 걸린 모든 개인에게 성공했다고 증명되지는 않을 수 있다.[17][20]
DPB에서 에리트로마이신 요법으로, 적혈구 증식뿐만 아니라 림프구 활동과 기도의 방해 점액 및 물 분비물의 억제를 통해 기관지 염증과 손상을 크게 감소시킨다.[16]마크로리드의 항생제 효과는 DPB의 염증 감소에 대한 유익한 효과와 관련이 없다.[20]이는 감염과 싸우기에는 치료 복용량이 너무 적기 때문에 분명하며, 마크로라이드 저항성 P. 에어로기노사가 발생하는 DPB의 경우 에리트로마이신 요법은 여전히 염증을 감소시킨다.[16]
에리트로마이신과 다른 매크롤라이드에 의한 염증 억제에는 많은 요소들이 관련되어 있다.이들은 특히 중성미자 증식을 억제하는 데 효과적이며, 인터루킨 8과 이들을 유인하는 백혈병 B4의 능력을 감소시킨다.[21]매크롤라이드는 또한 중성미자가 기관지 조직 라이닝에 달라붙게 하는 접착 분자의 효율을 떨어뜨린다.기도의 점액 생산은 DPB와 다른 호흡기 질환의 질병성과 사망률의 주요 원인이다.에리트로마이신 요법으로 인한 DPB의 염증 감소도 과도한 점액 생산을 억제하는 데 도움이 된다.[21]
예후
치료되지 않은 DPB는 기관지확장, 호흡부전, 사망으로 이어진다.1983년의 저널 보고서에 따르면 처리되지 않은 DPB는 5년 생존율이 62.1%인 반면 10년 생존율은 33.2%[6]로 나타났다.에리트로마이신 치료로, DPB를 가진 개인은 이제 증상 관리, 진행 지연, P. 에어로기노사 같은 관련 감염 예방으로 기대 수명이 훨씬 길어졌다.[20]치료된 DPB의 10년 생존율은 약 90%이다.[4]약 2년 후에 간혹 일어나는 치료법이 현저하게 개선되는 DPB의 경우, 치료는 한동안 종료할 수 있도록 허용되어 왔다.그러나 이 기간 동안 치료를 중단할 수 있는 개인들은 면밀하게 관찰된다.DPB가 재발한 것으로 입증된 만큼 일단 질병 증상이 다시 나타나기 시작하면 에리트로마이신 요법을 즉각 재개해야 한다.치료할 때 예후가 좋아졌음에도 불구하고, DPB는 현재 알려진 치료법이 없다.[4][9]
역학
DPB는 인구 10만명당 11명으로 일본인들 사이에서 가장 높은 유병률을 보이고 있다.[4]이 [22]병에 걸린 한국인, 중국인,[23] 태국인들도[24] 보고되었다.동아시아인들 사이에 유전적 소인이 제시된다.[9]이 병은 남성에서 더 흔하며,[25] 남성 대 여성 비율이 1.4 대 2:1(또는 남성 5 대 여성 3 정도)이다.[4]이 병의 평균 발병은 40세 전후로, 흡연이 원인이라고는 생각되지 않지만, 감염자의 3분의 2가 비흡연자다.[7]HLA-Bw54의 존재는 확산 범브론치올염 위험을 13.3배 증가시킨다.[26]
유럽과 미주에서는 비교적 적은 수의 DPB 사례가 아시아 이민자와 거주자뿐만 아니라 비 아시아계 조상의 개인에게도 보고되었다.[27][28][29]서구에서 오진이 발생한 것은 아시아 국가들에 비해 이 병의 인지도가 떨어졌기 때문이다.서쪽에 살고 있는 많은 아시아인들과 비교해 볼 때, DPB의 영향을 받는 것으로 생각되는 소수의 아시아인들은 비유전적 요인이 그 원인에 어느 정도 영향을 미칠 수 있다는 것을 암시한다.서양의 아시아인들에게서 볼 수 있는 이러한 희귀성은 부분적으로 오진과 관련이 있을 수도 있다.[7][30]
역사
1960년대 초, 일본의 의사들에 의해 비교적 새로운 만성 폐질환이 관찰되고 묘사되고 있었다.1969년에는 만성 기관지염, 폐기종, 폐염, 기타 염증이 있는 폐쇄성 폐질환과 구별하기 위해 'diffuse panbronchiolitis'라는 명칭이 도입되었다.[31]1978년과 1980년 사이에 일본 후생성이 시작한 전국적인 조사 결과, 1,000건 이상의 DPB 발생가능성이 밝혀졌으며, 역사적으로 82건이 확인되었다.1980년대까지 국제적으로 폐의 뚜렷한 병으로 인정받았다.[4][6]
1980년대 이전에는 특히 P. 에어로지노사에 의한 초감염(현재 발생하는 감염 외에 새로운 바이러스나 박테리아 감염의 출현)의 경우 DPB의 예후나 예상 결과가 좋지 않았다.[13]DPB는 일반화된 항생제 치료와 산소 치료가 증상 관리 노력에 일상적으로 사용되기 전까지 사망률이 매우 높았다.1985년경 항생제 에리트로마이신을 이용한 장기 치료가 DPB 관리 기준이 되면서 예후가 크게 개선되었다.[20]1990년, DPB와 HLA의 협회는 처음에 주장되었다.[9]
참조
- ^ Visscher DW, Myers JL (2006). "Bronchiolitis: the pathologist's perspective" (Free full text). Proceedings of the American Thoracic Society. 3 (1): 41–7. doi:10.1513/pats.200512-124JH. PMID 16493150.
- ^ a b c d e Ryu JH, Myers JL, Swensen SJ (December 2003). "Bronchiolar disorders" (Free full text). American Journal of Respiratory and Critical Care Medicine. 168 (11): 1277–92. doi:10.1164/rccm.200301-053SO. PMID 14644923.
- ^ a b Ryu JH (March 2006). "Classification and approach to bronchiolar diseases". Current Opinion in Pulmonary Medicine. 12 (2): 145–51. doi:10.1097/01.mcp.0000208455.80725.2a. PMID 16456385. S2CID 23668839.
- ^ a b c d e f g h i j k l m n o p q r s t Poletti V, Casoni G, Chilosi M, Zompatori M (October 2006). "Diffuse panbronchiolitis". The European Respiratory Journal. 28 (4): 862–71. doi:10.1183/09031936.06.00131805. PMID 17012632.
- ^ a b c d e Yanagihara K, Kadoto J, Kohno S (2001). "Diffuse panbronchiolitis--pathophysiology and treatment mechanisms". International Journal of Antimicrobial Agents. 18 Suppl 1: S83-7. doi:10.1016/s0924-8579(01)00403-4. PMID 11574201.
- ^ a b c d e f g h Homma H, Yamanaka A, Tanimoto S, Tamura M, Chijimatsu Y, Kira S, Izumi T (January 1983). "Diffuse panbronchiolitis. A disease of the transitional zone of the lung". Chest. 83 (1): 63–9. doi:10.1378/chest.83.1.63. PMID 6848335.
- ^ a b c d e f g h Anthony M, Singham S, Soans B, Tyler G (October 2009). "Diffuse panbronchiolitis: not just an Asian disease: Australian case series and review of the literature". Biomedical Imaging and Intervention Journal. 5 (4): e19. doi:10.2349/biij.5.4.e19. PMC 3097723. PMID 21610988.
- ^ Morris AG, Hewitt C, Young S (1994). The major histocompatibility complex: its genes and their roles in antigen presentation. Vol. 15. Pergamon.
- ^ a b c d e f g h i j k Keicho N, Hijikata M (May 2011). "Genetic predisposition to diffuse panbronchiolitis". Respirology. 16 (4): 581–8. doi:10.1111/j.1440-1843.2011.01946.x. PMID 21303426.
- ^ a b c 온라인 멘델리안 상속인 (OMIM): 판브론치올염, 디퓨즈 - 604809 회수 2011년 11월 11일
- ^ 온라인 멘델리아 유산 인 맨: 인간 백혈구 항원 B - 142830 2011년 9월 21일 회수되었다.
- ^ 온라인 멘델리아 유산 인 맨: 인간 백혈구 항원 A - 142800 2011년 9월 21일 회수.
- ^ a b Azuma A, Kudoh S (May 2006). "Diffuse panbronchiolitis in East Asia". Respirology. 11 (3): 249–61. doi:10.1111/j.1440-1843.2006.00845.x. PMID 16635082. S2CID 24559334.
- ^ Busse WW (June 1998). "Leukotrienes and inflammation" (Free full text). American Journal of Respiratory and Critical Care Medicine. 157 (6 Pt 1): S210-3. doi:10.1164/ajrccm.157.6.mar-1. PMID 9620941.
- ^ Li H, Zhou Y, Fan F, Zhang Y, Li X, Yu H, et al. (August 2011). "Effect of azithromycin on patients with diffuse panbronchiolitis: retrospective study of 51 cases". Internal Medicine. 50 (16): 1663–9. doi:10.2169/internalmedicine.50.4727. PMID 21841323.
- ^ a b c d e Kanoh S, Rubin BK (July 2010). "Mechanisms of action and clinical application of macrolides as immunomodulatory medications". Clinical Microbiology Reviews (Free full text). 23 (3): 590–615. doi:10.1128/CMR.00078-09. PMC 2901655. PMID 20610825.
- ^ a b c d López-Boado YS, Rubin BK (June 2008). "Macrolides as immunomodulatory medications for the therapy of chronic lung diseases". Current Opinion in Pharmacology. 8 (3): 286–91. doi:10.1016/j.coph.2008.01.010. PMID 18339582.
- ^ Lin X, Lu J, Yang M, Dong BR, Wu HM (January 2015). "Macrolides for diffuse panbronchiolitis". The Cochrane Database of Systematic Reviews. 1 (1): CD007716. doi:10.1002/14651858.CD007716.pub4. PMC 6464977. PMID 25618845.
- ^ Keicho N, Kudoh S (2002). "Diffuse panbronchiolitis: role of macrolides in therapy". American Journal of Respiratory Medicine. 1 (2): 119–31. doi:10.1007/BF03256601. PMID 14720066. S2CID 39880028.
- ^ a b c d e Schultz MJ (July 2004). "Macrolide activities beyond their antimicrobial effects: macrolides in diffuse panbronchiolitis and cystic fibrosis" (Free full text). The Journal of Antimicrobial Chemotherapy. 54 (1): 21–8. doi:10.1093/jac/dkh309. PMID 15190022.
- ^ a b Tamaoki J, Kadota J, Takizawa H (November 2004). "Clinical implications of the immunomodulatory effects of macrolides". The American Journal of Medicine. 117 Suppl 9A (9): 5S–11S. doi:10.1016/j.amjmed.2004.07.023. PMID 15586558.
- ^ Kim YW, Han SK, Shim YS, Kim KY, Han YC, Seo JW, Im JG (May 1992). "The first report of diffuse panbronchiolitis in Korea: five case reports". Internal Medicine. 31 (5): 695–701. doi:10.2169/internalmedicine.31.695. PMID 1504438.
- ^ Chen Y, Kang J, Li S (January 2005). "Diffuse panbronchiolitis in China". Respirology. 10 (1): 70–5. doi:10.1111/j.1440-1843.2005.00622.x. PMID 15691241. S2CID 37365518.
- ^ Chantarotorn S, Palwatwichai A, Vattanathum A, Tantamacharik D (August 1999). "Diffuse panbronchiolitis, the first case reports in Thailand". Journal of the Medical Association of Thailand = Chotmaihet Thangphaet. 82 (8): 833–8. PMID 10511794.
- ^ Høiby N (June 1994). "Diffuse panbronchiolitis and cystic fibrosis: East meets West". Thorax. 49 (6): 531–2. doi:10.1136/thx.49.6.531. PMC 474936. PMID 8016786.
- ^ Lazarus SC (2005). Murray and Nadel's Textbook of Respiratory Medicine (4th ed.). WB Saunders. p. 1300. ISBN 978-0-7216-0327-8.
- ^ Fitzgerald JE, King TE, Lynch DA, Tuder RM, Schwarz MI (August 1996). "Diffuse panbronchiolitis in the United States". American Journal of Respiratory and Critical Care Medicine. 154 (2 Pt 1): 497–503. doi:10.1164/ajrccm.154.2.8756828. PMID 8756828.
- ^ Martinez JA, Guimarães SM, Ferreira RG, Pereira CA (March 2000). "Diffuse panbronchiolitis in Latin America". The American Journal of the Medical Sciences. 319 (3): 183–5. doi:10.1097/00000441-200003000-00008. PMID 10746829.
- ^ Sandrini A, Balter MS, Chapman KR (2003). "Diffuse panbronchiolitis in a Caucasian man in Canada". Canadian Respiratory Journal. 10 (8): 449–51. doi:10.1155/2003/786531. PMID 14679410.
- ^ Brugiere O, Milleron B, Antoine M, Carette MF, Philippe C, Mayaud C (October 1996). "Diffuse panbronchiolitis in an Asian immigrant". Thorax. 51 (10): 1065–7. doi:10.1136/thx.51.10.1065. PMC 472677. PMID 8977613.
- ^ Yamanaka A, Saiki S, Tamura S, Saito K (March 1969). "[Problems in chronic obstructive bronchial diseases, with special reference to diffuse panbronchiolitis]". Naika. Internal Medicine (in Japanese). 23 (3): 442–51. PMID 5783341.