위장관성모세포종양
Gastrointestinal stromal tumor| 위장관성모세포종양 | |
|---|---|
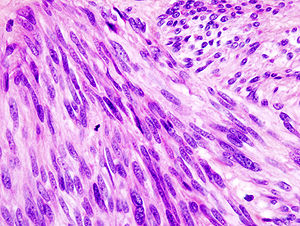 | |
| 위장의 위장성 기형성 종양의 조직병리학적 이미지. 헤마톡실린-에오신 얼룩. | |
| 전문 | 종양학 |
| 차등진단 | 엑토픽 췌장[1] |
위장성 기형성 종양(GIST)은 위장관의 가장 흔한 중피성 종양이다. GISTs는 Cajal의 매끄러운 근육박동조율기 중간세포 또는 유사한 세포에서 발생한다.[2] 그것들은 KIT유전자(85%),[2] PDGFRA유전자([2]10%), BRAF키나아제(레어)의 돌연변이에 의해 행동이 움직이는 종양으로 정의된다.[2] GIST의 95%는 KIT(CD117)에 긍정적으로 착색된다.[2][3] 대부분(66%)은 위장에서 발생하며 위 GIST는 다른 곳에서 발견된 종양보다 악성 잠재력이 낮다.[3]
분류
GIST는 1983년 진단용어로 도입되었다.[2]: 1060 1990년대 후반까지만 해도 위장관의 비피막성 종양은 '가스트롬성 종양'으로 많이 불렸다. 조직병리학자들은 우리가 현재 분자적으로 다른 것으로 알고 있는 유형을 구체적으로 구별할 수 없었다. 이후 CD34, 이후 CD117은 다양한 유형을 구별할 수 있는 마커로 식별되었다.[citation needed] 또한, 특정 치료법이 없는 경우, 진단 분류는 예후와 치료에 제한적인 영향만 미쳤다.
GIST 생물학에 대한 이해는 GIST의 분자 기반, [2]: 1065 특히 c-KIT의 식별에 따라 크게 달라졌다. 역사적으로 GIST의 분자적 정의 이전과 그 이후 짧은 시간 동안 문학평론에서는 GIST의 70~80%가 양성이라고 단언했다.[4][5][6] GIST에 대한 분자기준의 식별은 이전에 GIST로 간주되었던 많은 종양을 배제하는 결과를 가져왔고, 또한 다른 종류의 사르코마 및 미분화 암으로 분류되었던 훨씬 더 많은 수의 종양을 통합시켰다.[2]: 1065 예를 들어, 위와 소장의 일부 종양(평활근의 악성종양)에 대한 이전의 진단은 면역항화학적 얼룩에 기초하여 GISTs로 재분류될 것이다. 모든 GIST 종양은 현재 악성 전위를 가진 것으로 간주되고 있으며, 어떤 GIST 종양도 명확하게 "베니그"[7]로 분류할 수 없다. 따라서 모든 GIST는 AJCC(7판)/UICC에서 암 스테이징이 가능하다.[8] 그럼에도 불구하고 GIST마다 원산지, 크기 및 유사수치의 수에 따라 재발 또는 전이 경향에 대한 위험 평가가 다르다.
정의의 변화로 인해 현 시대에는 2000년 이전의 진료 경로가 대체로 비정보적이다.[2]
징후 및 증상
GIST는 삼키는 데 문제가 있거나 위장 출혈 또는 전이(주로 간에서)가 나타날 수 있다. 종양의 바깥쪽 성장 패턴 때문에 장폐쇄는 드물다. 종종 막연한 복통이나 불편함이 있었던 이력이 있고, 진단이 내려질 무렵에는 종양이 오히려 커지게 되었다.
병리학
GISTs는 결합조직의 종양이다. 즉, 사르코마: 대부분의 위장종양과는 달리, 그것들은 비피통적이다. 위에서는 약 70%가, 소장에서 20%, 식도에서 10% 미만이 발생한다. 작은 종양은 특히 세포 분열 속도가 느린 경우 일반적으로 양성이다. GIST 종양은 일반적으로 간(경우 28%) 및/또는 큰 오멘텀, 작은 오멘텀 또는 메센테리(경우 30%)로 전이된다. 전이가 덜 흔한 부위는 폐, 피하조직, 림프절, 뼈 등이다.[9]
GISTs는 일반적으로 장의 자율신경계의 일부인 Cajal(ICC)의 중간세포에서 발생하는 것으로 생각된다.[3] 그들은 운동성을 조절하는 페이스메이커 기능을 한다.
유전학
대부분의 GIST는 산발적이다. 유전적 가족 또는 특발성 다종증후군의 일부로 5% 미만이 발생한다. 여기에는 주파수 내림차순으로 신경섬유증 레클링하우젠(NF-1) 카니의 3종(Gastric GIST, 폐 콘드로마 및 외부 아드레날린 파라강글리아종), c-Kit/PDGFRA의 세균라인 기능상실 돌연변이, 카니스트라타키스 증후군이 포함된다.[10] 카니-스트라타키스 증후군은 유전성 GIST와 파라강글리아종의 유전자로, SDHS, SDHC, SDHB를 포함하는 미토콘드리아 종양 억제기 유전자 경로의 세균선 돌연변이에 의해 발생한다.[11]
c-KIT 돌연변이
약 85%의 GIST는 비정상적인 c-KIT 경로와 연관되어 있다. c-KIT는 줄기세포 인자(scf)라고 불리는 성장 인자를 위해 투과형 수용체를 암호화하는 유전자다. 비정상적인 c-KIT 경로(85%)는 유전자 자체의 돌연변이에 의해 가장 흔하게 발생한다. c-KIT 관련 GIST의 더 작은 부분집합은 면역글로팅에 의해 발견되는 KIT 효소 경로의 구성 활성과 관련이 있다.[2]: 1062 c-KIT 제품/CD117은 ICC와 많은 수의 다른 세포, 주로 골수 세포, 돛대 세포, 멜라노사이트 및 기타 여러 세포에 표현된다. 그러나 내장에서 CD117에 양성인 질량 얼룩은 ICC 세포에서 발생하는 GIST일 가능성이 높다.
c-KIT 분자는 긴 세포외 영역, 투과된 부분, 세포내 부분으로 구성된다. 돌연변이는 일반적으로 세포내 부분(exon 11)을 인코딩하는 DNA에서 발생하는데, 이 부위는 다른 효소를 활성화하는 티로신 키나제 역할을 한다. 돌연변이는 scf에 의한 활성화와 무관하게 c-KIT 기능을 만들어 세포분할율이 높고 유전학적 불안정성을 초래할 수 있다. c-KIT 돌연변이를 가진 세포가 GIST로 발전하기 위해서는 추가적인 돌연변이가 "필요"될 가능성이 높지만, c-KIT 돌연변이는 아마도 이 과정의 첫 단계일 것이다.
c-KIT 유전자의 11, 9와 드물게 13과 17의 변이가 GIST에서 발생하는 것으로 알려져 있다. c-KIT의 tyrosine kinase 기능은 아래에 설명된 바와 같이 GIST의 치료에서 중요하다.
- c-KIT exon 17의 KIT-D816V 포인트 돌연변이는 타이로신 키나아제 억제제인 이마티닙 메실레이트 같은 표적 치료제에 대한 내성을 담당한다.
- KIT-p.D419del (exon 8) - 이전에 야생형 종양으로 여겨졌던 위장성 기형 종양의 하위 집합은 KIT exon 8 (p.D419del)에서 체 활성 돌연변이를 동반한다.[12]
PDGFRA 돌연변이
와일드타입(즉, 돌연변이가 없는) c키트를 가진 대부분의 GIST 세포는 관련 타이로신 키나아제인 PDGFR-α(플레이트 유도 성장인자 수용체 알파)에 돌연변이를 가진다. c-kit와 PDGFrA의 돌연변이는 상호 배타적이다[4][5].[dead link]
야생형종양
적은 수의 GIST가 c-kit 또는 PDGFR-α 이상과 관련이 있는 것으로 보인다.[2]: 1062 위장성 기형 종양(GIST)의 약 10~15%가 KIT의 모든 핫스팟과 혈소판 유도성장인자 수용체 알파(PDGFRA)(wt-GIST)에서 야생형 서열을 운반한다. 이 종양들은 현재 KIT 유전자의 9번, 11번, 13번, 17번 전자와 PDGFRA 유전자의 12번, 14번, 18번 전자에 돌연변이가 없는 것으로 정의된다.[12]
진단
CT 스캔을 수행하는 경우가 많다(방사선학 섹션 참조).
확정 진단은 조직검사를 통해 이루어지며, 조직검사는 내시경적으로, CT나 초음파 유도나 수술시 또는 수술시 경피적으로 획득할 수 있다. 생검 샘플은 병리학 의사가 현미경으로 조사할 것이다. 병리학자는 조직병리학(GIST 70~80%, 상피성 측면 20~30%)의 특성을 파악하기 위해 조직병리학을 검사한다. 더 작은 종양은 대개 장벽의 근육질 프로프리아 층에 국한될 수 있다. 큰 것은 주로 장벽에서 바깥쪽으로, 혈액 공급과 내면의 네크로스(die)를 능가하는 지점까지 자라 결국 장강과 소통하게 될지도 모르는 충치를 형성한다.
유사한 종양의 다른 원인과 달리 GIST가 의심될 경우, 병리학자는 면역항체(분자 CD117[c-kit]라고도 함—아래 참조)를 사용할 수 있다. 전체 GIST의 95%는 CD117 양성(다른 가능한 마커에는 CD34, DOG-1, 데스민, 비멘틴이 포함된다)이다. CD117 긍정을 보여주는 다른 세포들은 돛대 세포들이다.
CD117 얼룩이 음성이고 종양이 GIST라는 의혹이 남으면 새로운 항체 DOG-1(GIST에 발견)을 사용할 수 있다. 또한 Kit와 PDGFRA의 시퀀싱을 사용하여 진단을 증명할 수 있다.
이미징
방사선 촬영의 목적은 병변의 위치를 파악하고 침입의 징후를 평가하며 전이를 검출하는 것이다. GIST의 특징은 종양의 크기와 기원 기관에 따라 다르다. 지름은 몇 밀리미터에서 30센티미터 이상까지 다양하다. 종양이 크면 보통 우발적으로 발견되는 것과 대조적으로 증상을 유발하는데, 이는 더 작고 예후가 더 좋은 경향이 있다.[4][13] 큰 종양은 악성 행동을 보이는 경향이 있지만 작은 GIST도 임상적으로 공격적인 행동을 보일 수 있다.[14]
일반 방사선 촬영은 GIST의 평가에 큰 도움이 되지 않는다. 이상이 보이면 인접한 장기에 종양 질량 효과가 나타나 간접적인 신호가 된다. 복부 엑스레이에서 위 GIST는 위 공기 그림자의 모양을 바꾸는 방사선 부피 덩어리로 나타날 수 있다. 장내 GIST는 장의 루프를 대신할 수 있고 더 큰 종양이 장을 방해할 수 있으며 필름은 폐쇄적인 패턴을 보일 것이다. 만약 공동체가 존재한다면, 일반 방사선사진은 종양 내의 공기 모음을 보여줄 것이다.[15] 석회화는 GIST의 특이한 특징이지만 만약 존재한다면 평이한 영화에서도 볼 수 있다.
복부민원이 있는 환자를 평가하기 위해 바륨 형광 투시 검사와 CT가 주로 사용된다. 바륨 제비 이미지는 GIST 사례의 80%에서 이상을 보여준다.[14] 그러나 일부 GIST는 전적으로 장의 내강 바깥에 위치할 수 있으며 바륨 제비로는 감상할 수 없을 것이다. 바륨 제비가 비정상인 경우에도 바륨 제비만으로는 복부 충치 등 복부 장기를 평가할 수 없기 때문에 MRI나 CT 촬영이 뒤따라야 한다. CT 스캔에서 환자의 87%에서 이상이 나타날 수 있으며, 구강과 정맥 대비를 모두 사용하여 검사해야 한다.[14] 영상 연구 중 MRI는 조직 대비가 가장 뛰어나, GI 트랙(내부 질량) 내에서 질량을 식별하는 데 도움이 된다. 병변 혈관을 평가하기 위해서는 정맥 조영제가 필요하다.
GIST 평가에서 선호되는 영상 촬영 양식은 CT와 MRI이며,[16]: 20–21 선택한 상황에서는 내시경 초음파다. CT의 장점으로는 근방의 장기침입, 승천, 전이 등의 증거를 증명할 수 있는 능력이 있다. MRI가 여러 평면에서 영상을 만들어 내는 능력은 장기를 (종양이 매우 크면 어려운) 유래 기관으로 판단하는 데 도움이 돼 진단을 용이하게 한다.
소형 GIST
GIST는 근육질 프로프리아(내강관상으로 점막과 수막까지 더 깊다)라는 장층에서 발생하기 때문에, 작은 GIST 영상에서는 대개 장벽 안쪽에 있는 하위절개 과정이나 덩어리를 제안한다. 바륨 제비 연구에서, 이러한 GIST는 가장 일반적으로 다른 경내 질량에서 볼 수 있듯이, 주변의 장벽과 직각 또는 둔각으로 형성되는 매끄러운 경계를 가지고 있다. 점막 표면은 일반적으로 GIST의 50%에 존재하는 궤양 부위를 제외하고는 대체로 온전하다. 궤양에는 바륨이 가득 차서 황소의 눈이나 표적 병변이 나타난다. 대조적으로 강화된 CT와 대조적으로, 작은 GIST는 균일한 감쇠가 있는 부드럽고 날카롭게 정의된 교내 질량으로 간주된다.
대형 GIST
종양이 자라면서 장 바깥에서 투영되거나 장 안에서 투영될 수 있지만, 종양의 대부분이 복강으로 투영될 정도로 가장 일반적으로 발육적으로 성장한다. 종양이 혈액 공급량을 초과하면 내적으로 괴사하여 출혈과 충동으로 중심 액체가 가득 찬 충치를 만들어 결국 궤양에 걸리고 장의 내강으로 의사소통할 수 있다. 이 경우 바륨 제비는 이러한 영역 내에 공기, 공기 유체 수준 또는 구강 조영제 축적을 보일 수 있다.[14][17] 점막 궤양도 있을 수 있다. 강화된 CT 영상과는 대조적으로, 큰 GIST는 출혈, 괴사, 낭종 등을 둘러싸고 있는 살아있는 종양 세포의 영역으로 인해 이기종 질량으로 나타나는데, 방사선학적으로 감쇠 중심이 낮은 주변 강화 패턴으로 보인다.[13] MRI 연구에서는 괴사와 출혈 정도가 신호 강도 패턴에 영향을 미친다. 종양 내 출혈 부위는 출혈이 발생한 지 얼마나 됐는지에 따라 신호 강도가 달라진다. 종양의 고체는 일반적으로 T1-가중 영상에서 낮은 신호 강도로, T2-가중 영상에서 높은 신호 강도로, 가돌리늄 투여 후 강화된다. 괴사성 종양의 영역 내에 가스가 있을 경우 신호 강도 공극이 존재한다.[15][18][19]
악성코드의 특징
악성종양은 국소침입과 전이가 특징이며, 보통 간, 귀음, 복막에 나타난다. 그러나 뼈, 늑골, 폐, 복막으로의 전이 사례가 관찰되었다. 위선두종이나 위/소장 림프종과 구별하여 악성 림프선병증(<10%)은 흔하지 않으며, 따라서 영상촬영은 대개 림프절 확대 부재를 보여준다.[13] 전이가 없는 경우 악성코드를 암시하는 다른 방사선 특징으로는 크기(>5 cm), 조영제 투여 후 이질적인 강화 및 궤양 등이 있다.[4][13][20] 또한, (적어도 낮은 악성 잠재력과 구별하여) 명백하게 악성인 행위는 위종양에서 덜 흔하게 나타나며, 행동 양성의 비율은 3-5:1이다.[4] 방사선 악성 특징이 있다고 하더라도 이러한 발견은 다른 종양도 나타낼 수 있으므로 면역화학적으로 최종 진단을 내려야 한다.
관리
국소적이고 절제 가능한 성인 GIST의 경우 해부학적으로 생리학적으로 실현 가능하다면 수술이 가장 중요한 선택 치료법이다.[16]: 69 수술은 잠재적으로 치료할 수 있지만 주의 깊게 선택된 상황에서는 작은 종양에서 조심스러운 기다림이 고려될 수 있다.[21] 수술 후 보조적 치료가 권장될 수 있다.[22] 림프절 전이 드물며, 일반적으로 림프절의 일상적인 제거는 필요하지 않다. 망원경과 전문 기구를 이용한 최소 침습성 복강경 수술은 큰 절개 없이 이들 종양 제거에 효과가 있는 것으로 나타났다.[23] 종양 크기에 대한 정확한 외과적 적응증의 임상적 문제는 논란의 여지가 있다. 적절한 복강경 수술의 결정은 종양의 크기, 위치, 성장 패턴에 의해 영향을 받는다.[24]
방사선치료는 역사적으로 효과가 없었으며 GIST는[25]: 1122 대부분의 화학요법 약물에 반응하지 않으며 5% 미만의 [2]: 1065 응답률을 보였다.[25]: 1122 그러나 GIST에서는 임상적 유익성을 위해 이마티닙, 수니티닙, 레고라페니브 등 3가지 약물이 확인되었다.
초기에 bcr-abl 억제에 기초한 만성 골수성 백혈병용으로 시판된 경구 투여 의약품인 이마티닙(Glivec/Gleevec)은 또한 C-kit tyrosine kinase 돌연변이와 D842V 이외의 PDGFRA 돌연변이를 모두 억제하며 여러 상황에서 GIST를 치료하는데 유용하다. 이마티닙은 선택된 네오아드주반트 설정에 사용되어 왔다.[26][16]: 23 보조요법 설정에서는 GIST 종양의 대다수가 수술로 치료되며 보조요법이 필요하지 않다.[27] [28] 이것의 예외는 종양의 해부학적 위치가 수술이 기술적으로 어렵거나 복잡하다는 것을 의미하는 것이다. 예를 들어 직장 GIST는 복부 절제술과 영구적인 기공을 포함하여 완전한 절제를 달성하기 위해 종종 급진적인 수술을 요구한다. 이러한 상황에서, 네오아드주반트 이마티닙의 사용은 종양의 크기와 유사성 활동을 크게 감소시킬 수 있으며, 덜 급진적인 괄약근 보존 수술을 허용할 수 있다.[26]
GIST 종양의 상당 부분은 여러 검증된 위험 계층화 계획에 의해 추정한 바와 같이 재발 위험이 높으며, 보조 치료에도 고려할 수 있다.[28][29] 이러한 환경에서 이미티닙의 가능한 사용에 대한 결정을 뒷받침하는 선택기준은 종양 크기, 유사율, GIST 환자의 재발 위험을 예측하기 위해 위치 등 병리학적 요인에 기초한 위험 평가를 포함한다. 유사수치 <5/50 HPF>의 종양 <2 cm>는 크고 공격적인 종양보다 재발 위험이 낮은 것으로 나타났다. GISTs의 외과적 절제술에 이어 이미티닙을 이용한 보조 치료는 고위험군에서 질병 재발 위험을 감소시킨다.[citation needed] 선별된 고위험 부대 상황에서는 이미티닙을 3년간 권장한다.[30]
이마티닙은 2002년 2월 1일 미국 FDA로부터 전이성 및 분리 불가능한 GIST로 승인을 받았다. 이미티닙 치료에 이어 고도질환 환자의 2년 생존율이 75~80%로 높아졌다.[31]
이미타니브에 대한 저항이 발생할 경우 다중 타이로신 키나제 억제제 선니티닙(Sutent로 판매)을 고려할 수 있다.[16]: 26 and 31 [32]
이미티닙과 수니티닙의 효과는 유전자형에 따라 달라진다.[33] cKIT-와 PDGFRA-mutation 음의 GIST 종양은 보통 신경섬유화증-1 관련 야생형 GIST와 마찬가지로 이미티닙으로[11] 치료하는 데 내성이 있다.[28] PDGFRA-mutation의 특정 하위 유형인 D842V도 이미티닙에 무감각하다.[28][34] 최근 PDGFRA가 GIST를 변이시킨 사례에서 아바프리티닙은 FDA의 승인을 받았다.[35] 이제 아바프리티닙에 대한 실제 세계 데이터도 제공된다(Dr Sameer Rastogi et [36]al)
Regorafenib(스티바르가)는 2013년 수술로 제거할 수 없고 이미티닙(Gleevec)과 선티닙(Sutent)에 더 이상 반응하지 않는 선진 GIST에 대해 FDA 승인을 받았다.[37]
역학
GIST는 인구 100만명당 10~20명꼴로 발생한다. 새로운 실험실 방법이 GIST를 진단하는 데 훨씬 더 민감하기 때문에 실제 발생률은 더 높을 수 있다.[citation needed] 미국에서 GIST의 추정 발병률은 연간 약 5000건이다.[2]: 1063 이로써 GIST는 70여 종의 암을 구성하는 육종의 가장 흔한 형태가 되었다.
대부분의 GIST는 50~70세에 존재한다. 대부분의 연령 스펙트럼에서 GIST의 발병률은 남성과 여성에서 유사하다.[25]: 1122
성인 GIST는 40세 이전에 드물다. 소아 GIST는 생물학적으로 구별되는 것으로 간주된다.[38] 다른 연령대의 GIST와 달리 소아 GIST는 여학생이나 젊은 여성에게 더 흔하다. 이들은 KIT와 PDGFRA에서 모두 발기부전 활성 Tyrosine kinase 돌연변이가 없는 것으로 보인다.[39] 소아 GIST는 성인 GIST와는 다르게 취급된다. 일반적으로 받아들여지는 소아 GIST의 정의는 18세 이하에 진단되는 종양이지만,[38] '소아형' GIST는 성인에게서 볼 수 있어 위험도 평가, 림프절 절제술의 역할, 치료 선택 등에 영향을 미친다.[40]
인용구
- ^ Yuan, Z; Chen, J; Zheng, Q; Huang, XY; Yang, Z; Tang, J (7 August 2009). "Heterotopic pancreas in the gastrointestinal tract". World Journal of Gastroenterology. 15 (29): 3701–3. doi:10.3748/wjg.15.3701. PMC 2721251. PMID 19653355.
- ^ a b c d e f g h i j k l m Demetri, G. (2011). "Gastrointestinal Stromal Tumor". In DeVita, L; Lawrence, TS; Rosenberg, SA (eds.). DeVita, Hellman, and Rosenberg's Cancer: Principles and Practice of Oncology (9th ed.). ISBN 978-1-4511-0545-2.
- ^ a b c Miettinen M, Lasota J (2006). "Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis". Arch Pathol Lab Med. 130 (10): 1466–78. doi:10.5858/2006-130-1466-GSTROM. PMID 17090188.
- ^ a b c d Burkill GJ, Badran M, Al-Muderis O, Meirion Thomas J, Judson IR, Fisher C, Moskovic EC (2003). "Malignant gastrointestinal stromal tumor: distribution, imaging features, and pattern of metastatic spread". Radiology. 226 (2): 527–32. doi:10.1148/radiol.2262011880. PMID 12563150.
- ^ Nishida T, Hirota S (2000). "Biological and clinical review of stromal tumors in the gastrointestinal tract". Histol Histopathol. 15 (4): 1293–301. PMID 11005253.
- ^ Miettinen M, Lasota J (2001). "Gastrointestinal stromal tumors--definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis". Virchows Arch. 438 (1): 1–12. doi:10.1007/s004280000338. PMID 11213830. S2CID 7598241.
- ^ Raut, Chandrajit; Dematteo, Ronald (March 2008). "Evidence-Guided Surgical Management of GIST: Beyond a Simple Case of Benign and Malignant". Ann. Surg. Oncol. 15 (5): 1542–1543. doi:10.1245/s10434-008-9817-1. S2CID 12586147.
- ^ AJCC 설명서
- ^ Parab, Trisha M.; DeRogatis, Michael J.; Boaz, Alexander M.; Grasso, Salvatore A.; Issack, Paul S.; Duarte, David A.; Urayeneza, Olivier; Vahdat, Saloomeh; Qiao, Jian-Hua; Hinika, Gudata S. (February 2019). "Gastrointestinal stromal tumors: a comprehensive review". Journal of Gastrointestinal Oncology. 10 (1): 144–154. doi:10.21037/jgo.2018.08.20. PMC 6351301. PMID 30788170.
- ^ Agaimy A, Hartmann A (2010). "Hereditary and non-hereditary syndromic gastointestinal stromal tumours". Pathologe (in German). 31 (6): 430–7. doi:10.1007/s00292-010-1354-6. PMID 20848108. S2CID 9295361.
- ^ a b Stratakis CA, Carney JA (Jul 2009). "The triad of paragangliomas, gastric stromal tumours and pulmonary chondromas (Carney triad), and the dyad of paragangliomas and gastric stromal sarcomas (Carney-Stratakis syndrome): molecular genetics and clinical implications". J Intern Med. 266 (1): 43–52. doi:10.1111/j.1365-2796.2009.02110.x. PMC 3129547. PMID 19522824.
- ^ a b Huss, S; Künstlinger, H; Wardelmann, E; Kleine, M. A.; Binot, E; Merkelbach-Bruse, S; Rüdiger, T; Mittler, J; Hartmann, W; Büttner, R; Schildhaus, H. U. (2013). "A subset of gastrointestinal stromal tumors previously regarded as wild-type tumors carries somatic activating mutations in KIT exon 8 (p.D419del)". Modern Pathology. 26 (7): 1004–12. doi:10.1038/modpathol.2013.47. PMC 3701292. PMID 23599150.
- ^ a b c d Hersh MR, Choi J, Garrett C, Clark R (2005). "Imaging Gastrointestinal Stromal Tumors". Cancer Control. 12 (2): 111–115. doi:10.1177/107327480501200206. PMID 15855894. S2CID 26071847.
- ^ a b c d Pidhorecky I, Cheney RT, Kraybill WG, Gibbs JF (2000). "Gastrointestinal stromal tumors: current diagnosis, biologic behavior, and management". Ann Surg Oncol. 7 (9): 705–12. doi:10.1007/s10434-000-0705-6. PMID 11034250. S2CID 663887.
- ^ a b Shojaku H, Futatsuya R, Seto H, et al. (1997). "Malignant gastrointestinal stromal tumor of the small intestine: radiologic-pathologic correlation". Radiat Med. 15 (3): 189–92. PMID 9278378.
- ^ a b c d NCCN Oncology Soft Tissue Sarcomas, 버전 3.2012. 전국 종합 암 네트워크.[1]
- ^ Lehnert T (1998). "Gastrointestinal sarcoma (GIST)--a review of surgical management". Ann Chir Gynaecol. 87 (4): 297–305. PMID 9891770.
- ^ Levine MS, Buck JL, Pantongrag-Brown L, et al. (1996). "Leiomyosarcoma of the esophagus: radiographic findings in 10 patients". AJR Am J Roentgenol. 167 (1): 27–32. doi:10.2214/ajr.167.1.8659399. PMID 8659399.
- ^ Tervahartiala P, Halavaara J (1998). "Radiology of GIST. Gastrointestinal stromal tumours". Ann Chir Gynaecol. 87 (4): 291–2. PMID 9891768.
- ^ Ulusan S, Koc Z, Kayaselcuk F (2008). "Gastrointestinal stromal tumours: CT findings". Br J Radiol. 81 (968): 618–623. doi:10.1259/bjr/90134736. PMID 18628330.
- ^ Casali PG, Blay JY (2010). "Gastrointestinal stromal tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 21 (suppl 5): v98–v102. doi:10.1093/annonc/mdq208. PMID 20555113.[2]
- ^ Bamboat ZM (2012). "Updates on the management of gastrointestinal stromal tumors". Surg Oncol Clin N Am. 21 (2): 301–16. doi:10.1016/j.soc.2011.12.004. PMC 3386646. PMID 22365521.
- ^ Nguyen SQ, Divino CM, Wang JL, Dikman SH (May 2006). "Laparoscopic management of gastrointestinal stromal tumors". Surg Endosc. 20 (5): 713–6. doi:10.1007/s00464-005-0435-8. PMID 16502196. S2CID 12838290.
- ^ Lee, Chung-Ho; Hyun, Myung-Han; Kwon, Ye-Ji; Cho, Sung-Il; Park, Sung-Soo (2012). "Deciding Laparoscopic Approaches for Wedge Resection in Gastric Submucosal Tumors: A Suggestive Flow Chart Using Three Major Determinants". Journal of the American College of Surgeons. 215 (6): 831–840. doi:10.1016/j.jamcollsurg.2012.07.009. PMID 22951033.
- ^ a b c Kantarjian, HM; Wolff, RA; Koller, CA. (2011). The MD Anderson Manual of Medical Oncology (2nd ed.). McGraw-Hill. ISBN 978-0-07-170106-8.
- ^ a b Wilkinson MJ, Fitzgerald JE, Strauss DC, Hayes AJ, Thomas JM, Messiou C, Fisher C, Benson C, Tekkis PP, Judson I (August 2015). "Surgical treatment of gastrointestinal stromal tumour of the rectum in the era of imatinib". Br J Surg. 102 (8): 965–71. doi:10.1002/bjs.9818. PMID 25970743. S2CID 2810885.
- ^ Joensuu, Heikki (2012-06-01). "Adjuvant treatment of GIST: patient selection and treatment strategies". Nature Reviews. Clinical Oncology. 9 (6): 351–358. doi:10.1038/nrclinonc.2012.74. ISSN 1759-4782. PMID 22525709. S2CID 12733166.
- ^ a b c d Joensuu, Heikki (2012-10-22). "Adjuvant therapy for high-risk gastrointestinal stromal tumour: considerations for optimal management". Drugs. 72 (15): 1953–1963. doi:10.2165/11635590-000000000-00000. ISSN 0012-6667. PMID 22994537. S2CID 43794982.
- ^ Reichardt P, Blay JY, Boukovinas I, et al. (2012). "Adjuvant therapy in primary GIST: state-of-the-art". Annals of Oncology. 23 (11): 2776–2781. doi:10.1093/annonc/mds198. PMID 22831984.
- ^ Cohen MH, Johnson JR, Justice R, Pazdur R (2012). "Approval summary: imatinib mesylate for one or three years in the adjuvant treatment of gastrointestinal stromal tumors. U.S. Food and Drug Administration, Silver Spring, MD 20993-0002, USA". Oncologist. 17 (7): 992–997. doi:10.1634/theoncologist.2012-0109. PMC 3399657. PMID 22643537.
- ^ Patel Shreyaskumar R; Wong Patrick (2009). "The Efficacy of Imatinib in Unresectable/Metastatic Gastrointestinal Stromal Tumors". US Oncology. 5 (1): 61–4. doi:10.17925/ohr.2009.05.1.61. S2CID 78453531.
- ^ Okuno, S (14 Sep 2011). "The Use of Tyrosine Kinase Inhibitors for Gastrointestinal Stromal Tumors (GIST)". Contemporary Oncology.
- ^ "News: Genetic Variations in GI Tumors Determine Which Medications Are Efficacious". Genetic Engineering & Biotechnology News. 13 Nov 2008.
- ^ ASCO-SEP 3차 에드
- ^ "FDA approves avapritinib for gastrointestinal stromal tumor with a rare mutation". FDA. 9 January 2020.
- ^ 고도위장관성모세포종양 아바프리티닙: 인도의 사우라브 베르마, 로히트 레디, 쉐라가루 하누만타파 찬드라셰카, 샤밈 아흐메드 샤밈, 사르탁 트립캐시, 사메르 라스토기 미래과학 OA https://www.future-science.com/doi/10.2144/fsoa-2020-0178
- ^ 파즈두르, 리처드 Regorafenib에 대한 FDA 승인. 국립 암 연구소.[3]
- ^ a b Pappo AS, Janeway KA (Feb 2009). "Pediatric gastrointestinal stromal tumors". Hematol Oncol Clin North Am. 23 (1): 15–34. doi:10.1016/j.hoc.2008.11.005. PMID 19248968.
- ^ Kelly L, Bryan K, Kim SY, Janeway KA, Killian JK, Schildhaus HU, Miettinen M, Helman L, Meltzer PS, van de Rijn M, Debiec-Rychter M, O'Sullivan M (2013). "Post-Transcriptional Dysregulation by miRNAs Is Implicated in the Pathogenesis of Gastrointestinal Stromal Tumor [GIST]". PLOS ONE. 8 (5): e64102. Bibcode:2013PLoSO...864102K. doi:10.1371/journal.pone.0064102. PMC 3663836. PMID 23717541.
- ^ Rege TA, Wagner AJ, Corless CL, Heinrich MC, Hornick JL (Apr 2011). ""Pediatric-type" gastrointestinal stromal tumors in adults: distinctive histology predicts genotype and clinical behavior". Am J Surg Pathol. 35 (4): 495–504. doi:10.1097/PAS.0b013e31820e5f7d. PMID 21358303. S2CID 40111082.
일반 출처
- de Silva CM, Reid R (2003). "Gastrointestinal stromal tumors (GIST): C-kit mutations, CD117 expression, differential diagnosis and targeted cancer therapy with Imatinib" (PDF). Pathol Oncol Res. 9 (1): 13–9. doi:10.1007/BF03033708. PMID 12704441. S2CID 3814815.
- Kitamura Y, Hirota S, Nishida T (Apr 2003). "Gastrointestinal stromal tumors (GIST): a model for molecule-based diagnosis and treatment of solid tumors". Cancer Sci. 94 (4): 315–20. doi:10.1111/j.1349-7006.2003.tb01439.x. PMID 12824897. S2CID 31070671.
외부 링크
- GIST 암 영국
- GIST ESUN에서의 수술 질문(2006년 8월 15일)
- SPAEN(사육종 환자 EuroNet) - Euro Network of Sarcommon, GIST 및 Desmoid 환자 옹호 그룹
- GIST Support International
- 라이프 래프트 그룹 국제 GIST 옹호 기구
- 미국 암학회 환자 안내서 GIST 종양.
- 암.넷:위장관성 기형종양






