3C급 프로테아제
3C-like protease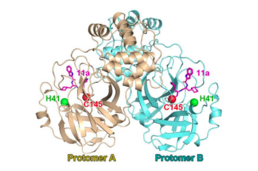 | |||||||||
| 식별자 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| EC 번호 | 3.4.22.69 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
| 펩티다아제 C30, 코로나바이러스 내분비효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호 | 펩티다아제_C30 | ||||||||
| Pfam | PF05409 | ||||||||
| 인터프로 | IPR008740 | ||||||||
| 프로사이트 | PS51442 | ||||||||
| 메롭스 | C30 | ||||||||
| SCOP2 | d1q2wb1 / SCOPe / SUPFAM | ||||||||
| |||||||||
공식적으로 C30 엔도펙티다아제 또는 3-키모트립신 같은 프로테아제로 알려진 3C 유사 프로테아제(3CLpro) 또는 주 프로테아제(Mpro)[2]는 코로나비루스에서 발견되는 주요 프로테아제다.그것은 11개의 보존된 장소에서 코로나바이러스 다단백질을 분쇄한다.그것은 시스틴 프로테아제이고 PA 종족의 일원이다.활성 부지에 시스테인-히스타인 촉매 다이아드를 가지고 있으며 Gln–(Ser/Ala/Gly) 펩타이드 결합을 절단한다.
효소 위원회는 이 가문을 사스 코로나바이러스 주단백질효소(Mpro; EC 3.4.22.69)라고 부른다.3CL 프로테아제는 코로나바이러스 비구조 단백질 5(nsp5)에 해당한다.통칭의 "3C"는 피코나비루스에서 발견되는 동음이의 단백질인 3C 프로테아제(3Cpro)를 가리킨다.
함수
3C 유사 프로테아제는 P1 위치의 글루타민과 P1 위치의 작은 아미노산(세린, 알라닌 또는 글리신) 사이의 펩타이드 결합을 촉매로 분해할 수 있다.예를 들어 사스 코로나바이러스 3CLPro는 다음과 같은 펩타이드 성분을 자가 정제할 수 있다.[3][4][5]
TSAVLQ-SGFRK-NH2와 SGVTFQ-GKFKK는 사스 3C 유사 단백질 분해효소의 두 가지 자가 제거 부위에 해당하는 두 개의 펩타이드다.
프로테아제는 코로나바이러스 복제효소 다단백질(P0C6U8)의 처리에 중요하다.코로나비루스의 주 프로테아제로 비구조 단백질 5(nsp5)에 해당한다.[6]그것은 11개의 보존된 장소에서 코로나바이러스 다단백질을 분쇄한다.3CL 프로테아제는 활성 부지에 시스테인-히스타인 촉매 다이아드가 있다.[4]시스테인의 유황은 핵소재의 역할을 하고 히스티딘의 이미다졸 링은 일반적인 염기로서 작용한다.[7]
| 포지션 | 기질 선호도 |
|---|---|
| P5 | 강력한 선호 없음 |
| P4 | 소수성 잔류물 |
| P3 | 양전하 잔류물 |
| P2 | 높은 친수성 및 베타 분지의 부재 |
| P1 | 글루타민 |
| P1' | 소잔잔류물 |
| P2' | 소잔잔류물 |
| P3' | 강력한 선호 없음 |
명명법
Alternative names provided by the EC include 3CLpro, 3C-like protease, coronavirus 3C-like protease, Mpro, SARS 3C-like protease, SARS coronavirus 3CL protease, SARS coronavirus main peptidase, SARS coronavirus main protease, SARS-CoV 3CLpro enzyme, SARS-CoV main protease, SARS-CoV Mpro and severe acute respiratory syndrome coronavirus main protease.
치료 대상으로서
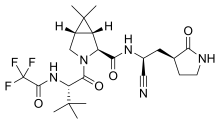
프로테아제 3CLPro는 바이러스성 RNA에서 번역되는 다단백질 처리에 필수적인 역할을 하기 때문에 코로나바이러스 감염의 잠재적 약물 대상이다.[11][12]비필수 사스-CoV-2 프로테아제 3CLPro의 X선 구조와 α-케토아미드 억제제가 있는 복합체는 사스-CoV-2 감염 치료를 위한 α-케토아미드 억제제[13] 설계의 근거를 제공한다.[14][15][16][17][18]
CLPro-1, GC376, 루핀트리버, 루포트렐비르, PF-07321332, AG7404를 포함하여 3CLPro 및 동음이의 3Cpro를 대상으로 하는 다수의 프로테아제 억제제가 개발되고 있다.[19][20][21][22][1]정맥주사 pf-07304814(lufotrelvir)는 2020년 9월 임상시험에 들어갔다.[23]구강활성화 후속제 PF-07321332는 리토나비르와 결합제로 임상 2상/III상을 진행 중이며, 2021년 11월 COVID-19 증상 발생 후 3일 이내에 투여하면 입원이 89% 감소하는 등 결과를 발표했다.[24]2억 3천 5백만 개의 분자를 대상으로 한 초경량 가상 선별 캠페인은 여러 코로나비루스의 주요 프로테아제를 대상으로 한 새로운 광폭 억제제를 식별할 수 있었다.[25]
기타 3C(유사한) 보호제
3C 유사 프로테아제(3C(L)pro)는 (+)ssRNA 바이러스에서 광범위하게 발견된다.모두 키모트립신처럼 접힌(PA 클랜)을 가진 시스틴 프로테아제(cysteine proteases)로 촉매변환기(dymotrypsin)나 삼합기를 사용한다.그들은 기질 특이성과 억제제 효과에 대해 몇 가지 일반적인 유사점을 공유한다.그들은 다음에서 발견된 바이러스의 계열에 해당하는 시퀀스 유사성에 의해 하위 패밀리로 구분된다.[26]
- 이 항목은 코로나바이러스 3CLpro 입니다.
- 피코르나비르과는 피코르나바이러스 3Cpro(EC 3.4.22.28; InterPro: IPR000199; MEROPS C03)를 가지고 있다.이것이 가장 일찍 공부한 가족이다.예를 들면 소아마비 바이러스와 라이노바이러스에서 발견되는 것(둘 다 엔토바이러스의 속이다)이 있다.
- 칼리시비르과에는 3CLpro(InterPro: IPR001665; MEROPS C37)이 있다.예를 들면 노워크 바이러스에서 발견된 것이 있다.
추가 멤버는 포티비르과와 비코로나비르과 니도비르목에서 알려져 있다.[27]
참고 항목
참조
- ^ a b c Dai W, Zhang B, Jiang XM, Su H, Li J, Zhao Y, et al. (June 2020). "Structure-based design of antiviral drug candidates targeting the SARS-CoV-2 main protease". Science. 368 (6497): 1331–1335. Bibcode:2020Sci...368.1331D. doi:10.1126/science.abb4489. PMC 7179937. PMID 32321856.
- ^ Ahmad B, Batool M, Ain QU, Kim MS, Choi S (August 2021). "Exploring the Binding Mechanism of PF-07321332 SARS-CoV-2 Protease Inhibitor through Molecular Dynamics and Binding Free Energy Simulations". International Journal of Molecular Sciences. 22 (17): 9124. doi:10.3390/ijms22179124. PMC 8430524. PMID 34502033.
- ^ Goetz DH, Choe Y, Hansell E, Chen YT, McDowell M, Jonsson CB, Roush WR, McKerrow J, Craik CS (July 2007). "Substrate specificity profiling and identification of a new class of inhibitor for the major protease of the SARS coronavirus". Biochemistry. 46 (30): 8744–52. doi:10.1021/bi0621415. PMID 17605471.
- ^ a b Fan K, Wei P, Feng Q, Chen S, Huang C, Ma L, Lai B, Pei J, Liu Y, Chen J, Lai L (January 2004). "Biosynthesis, purification, and substrate specificity of severe acute respiratory syndrome coronavirus 3C-like proteinase". The Journal of Biological Chemistry. 279 (3): 1637–42. doi:10.1074/jbc.m310875200. PMC 7980035. PMID 14561748.
- ^ Akaji K, Konno H, Onozuka M, Makino A, Saito H, Nosaka K (November 2008). "Evaluation of peptide-aldehyde inhibitors using R188I mutant of SARS 3CL protease as a proteolysis-resistant mutant". Bioorganic & Medicinal Chemistry. 16 (21): 9400–8. doi:10.1016/j.bmc.2008.09.057. PMC 7126698. PMID 18845442.
- ^ Fehr AR, Perlman S (2015). "Coronaviruses: an overview of their replication and pathogenesis". In Maier HJ, Bickerton E, Britton P (eds.). Coronaviruses. Methods in Molecular Biology. Vol. 1282. Springer. pp. 1–23. doi:10.1007/978-1-4939-2438-7_1. ISBN 978-1-4939-2438-7. PMC 4369385. PMID 25720466.
See section: Virion Structure.
- ^ Ryu YB, Park SJ, Kim YM, Lee JY, Seo WD, Chang JS, et al. (March 2010). "SARS-CoV 3CLpro inhibitory effects of quinone-methide triterpenes from Tripterygium regelii". Bioorganic & Medicinal Chemistry Letters. 20 (6): 1873–6. doi:10.1016/j.bmcl.2010.01.152. ISSN 0960-894X. PMC 7127101. PMID 20167482.
- ^ Chuck CP, Chow HF, Wan DC, Wong KB (2011). "Profiling of substrate specificities of 3C-like proteases from group 1, 2a, 2b, and 3 coronaviruses". PLoS One. 6 (11): e27228. doi:10.1371/journal.pone.0027228. PMC 3206940. PMID 22073294.
- ^ Vandyck K, Deval J (August 2021). "Considerations for the discovery and development of 3-chymotrypsin-like cysteine protease inhibitors targeting SARS-CoV-2 infection". Curr Opin Virol. 49: 36–40. doi:10.1016/j.coviro.2021.04.006. PMC 8075814. PMID 34029993.
- ^ "Pfizer begins dosing in Phase II/III trial of antiviral drug for Covid-19". Clinical Trials Arena. 2 September 2021.
- ^ Hilgenfeld R (July 2014). "From SARS to MERS: crystallographic studies on coronaviral proteases enable antiviral drug design". FEBS Journal. 281 (18): 4085–4096. doi:10.1111/febs.12936. PMID 25039866.
- ^ Ullrich S, Nitsche C (July 2020). "The SARS-CoV-2 main protease as a drug target". Bioorganic & Medicinal Chemistry Letters. 30 (17): 127377. doi:10.1016/j.bmcl.2020.127377. PMID 32738988.
- ^ Ocain TD, Rich DH (February 1992). "alpha-Keto amide inhibitors of aminopeptidases". Journal of Medicinal Chemistry. 35 (3): 451–6. doi:10.1021/jm00081a005. PMID 1738140.
- ^ Anand K, Ziebuhr J, Wadhwani P, Mesters JR, Hilgenfeld R (June 2003). "Coronavirus main proteinase (3CLpro) structure: basis for design of anti-SARS drugs". Science. 300 (5626): 1763–7. Bibcode:2003Sci...300.1763A. doi:10.1126/science.1085658. PMID 12746549.
- ^ Pacifico S, Ferretti V, Albanese V, Fantinati A, Gallerani E, Nicoli F, et al. (July 2019). "Synthesis and Biological Activity of Peptide α-Ketoamide Derivatives as Proteasome Inhibitors". ACS Medicinal Chemistry Letters. 10 (7): 1086–1092. doi:10.1021/acsmedchemlett.9b00233. PMC 6627721. PMID 31312413.
- ^ Kusov Y, Tan J, Alvarez E, Enjuanes L, Hilgenfeld R (October 2015). "A G-quadruplex-binding macrodomain within the "SARS-unique domain" is essential for the activity of the SARS-coronavirus replication-transcription complex". Virology. 484: 313–22. doi:10.1016/j.virol.2015.06.016. PMC 4567502. PMID 26149721.
- ^ Zhang L, Lin D, Kusov Y, Nian Y, Ma Q, Wang J, et al. (February 2020). "α-Ketoamides as Broad-Spectrum Inhibitors of Coronavirus and Enterovirus Replication: Structure-Based Design, Synthesis, and Activity Assessment". Journal of Medicinal Chemistry. 63 (9): 4562–4578. doi:10.1021/acs.jmedchem.9b01828. PMC 7098070. PMID 32045235.
- ^ Zhang L, Lin D, Sun X, Curth U, Drosten C, Sauerhering L, et al. (March 2020). "Crystal structure of SARS-CoV-2 main protease provides a basis for design of improved α-ketoamide inhibitors". Science. 368 (6489): 409–412. Bibcode:2020Sci...368..409Z. doi:10.1126/science.abb3405. PMC 7164518. PMID 32198291.
- ^ Tian D, Liu Y, Liang C, Xin L, Xie X, Zhang D, Wan M, Li H, Fu X, Liu H, Cao W (May 2021). "An update review of emerging small-molecule therapeutic options for COVID-19". Biomedicine & Pharmacotherapy. 137: 111313. doi:10.1016/j.biopha.2021.111313. PMC 7857046. PMID 33556871.
- ^ Morse JS, Lalonde T, Xu S, Liu WR (March 2020). "Learning from the Past: Possible Urgent Prevention and Treatment Options for Severe Acute Respiratory Infections Caused by 2019-nCoV". ChemBioChem. 21 (5): 730–738. doi:10.1002/cbic.202000047. PMC 7162020. PMID 32022370.
- ^ Liu C, Zhou Q, Li Y, Garner LV, Watkins SP, Carter LJ, et al. (March 2020). "Research and Development on Therapeutic Agents and Vaccines for COVID-19 and Related Human Coronavirus Diseases". ACS Central Science. 6 (3): 315–331. doi:10.1021/acscentsci.0c00272. PMC 7094090. PMID 32226821.
- ^ Ramajayam R, Tan KP, Liang PH (October 2011). "Recent development of 3C and 3CL protease inhibitors for anti-coronavirus and anti-picornavirus drug discovery". Biochemical Society Transactions. 39 (5): 1371–5. doi:10.1042/BST0391371. PMID 21936817.
- ^ "First-In-Human Study To Evaluate Safety, Tolerability, And Pharmacokinetics Following Single Ascending And Multiple Ascending Doses of PF-07304814 In Hospitalized Participants With COVID-19". Clinical Trials. 24 June 2021. Retrieved 3 July 2021.
- ^ "Pfizer's Novel COVID-19 Oral Antiviral Treatment Candidate Reduced Risk Of Hospitalization Or Death By 89% In Interim Analysis Of Phase 2/3 EPIC-HR Study". Pfizer Inc. 5 November 2021.
- ^ Luttens A, Gullberg H, Abdurakhmanov E, Vo DD, Akaberi D, Talibov VO, et al. (February 2022). "Ultralarge Virtual Screening Identifies SARS-CoV-2 Main Protease Inhibitors with Broad-Spectrum Activity against Coronaviruses". J Am Chem Soc. 144 (7): 2905–2920. doi:10.1021/jacs.1c08402. ISSN 0002-7863. PMC 8848513. PMID 35142215.
- ^ Kim Y, Lovell S, Tiew KC, Mandadapu SR, Alliston KR, Battaile KP, et al. (November 2012). "Broad-spectrum antivirals against 3C or 3C-like proteases of picornaviruses, noroviruses, and coronaviruses". Journal of Virology. 86 (21): 11754–62. doi:10.1128/JVI.01348-12. PMC 3486288. PMID 22915796.
- ^ Ziebuhr J, Bayer S, Cowley JA, Gorbalenya AE (January 2003). "The 3C-like proteinase of an invertebrate nidovirus links coronavirus and potyvirus homologs". Journal of Virology. 77 (2): 1415–26. doi:10.1128/jvi.77.2.1415-1426.2003. PMC 140795. PMID 12502857.
추가 읽기
- Chuck CP, Chow HF, Wan DC, Wong KB (2 November 2011). "Profiling of substrate specificities of 3C-like proteases from group 1, 2a, 2b, and 3 coronaviruses". PLOS ONE. 6 (11): e27228. Bibcode:2011PLoSO...627228C. doi:10.1371/journal.pone.0027228. PMC 3206940. PMID 22073294.
외부 링크
- 미국 국립 의학 도서관의 사스+코로나바이러스+메인+단백질효소(MSH)
- 인터프로, 코로나바이러스에서의 펩티다아제 C30/C16: IPR013016.MEROPS C16은 "papain-like" PL-PRO이다.