한계영역 B세포림프종
Marginal zone B-cell lymphoma| 한계영역 B세포림프종 | |
|---|---|
| 기타 이름 | 한계영역 림프구(MZL) |
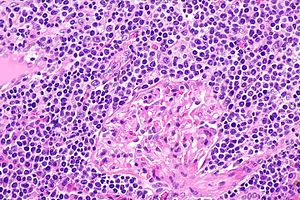 | |
| EMZL 침투 신장 조직 | |
| 종류들 | 외측근 림프종, 비장근경근 림프종, 노달근경근 림프종. |
한계영역 B-세포 림프종은 한계영역 B-세포의 악성 변형에서 유래된 이질적인 림프군이다.[1]한계영역 B세포는 감염제나 손상된 조직 등이 제시한 항원에 IgM항체 면역반응을 빠르게 탑재해 정상적으로 기능하는 선천적 림프세포다.[2]이들은 B세포 라인의 림프구로서 2차 림프액낭에서 발생하여 성숙된 다음 점막 관련 림프조직(즉, MOT), 비장 또는 림프절의 한계 영역으로 이동한다.점막 관련 림프조직은 위장, 입, 비강, 인두, 갑상선, 유방, 폐, 침샘, 눈, 피부, 인간의 비장 등 신체의 여러 가지 하위절개막 부위에서 발견되는 작은 농도의 림프조직의 확산계통이다.[3]
2016년 세계보건기구(WHO)는 MZL을 3가지 유형으로 분류했다.EMZLs(Extranodal marriple zone limpomas)는 외부 조직에서 발달하는 MZLs이다.대부분의 EMZL은 MOLT에서 발달하며 점막 관련 림프조직의 외측 MZL 또는 더 간단히 MOLT 림프라고 불린다.비장 한계영역 림프(SMZLs)는 초기에 비장, 골수, 혈액에 국한되는 MZLs이다.[1]NMZ(Nodal marble zone limpomas)는 초기에 림프절, 골수, 혈액에 국한된 MZLs이다.[1]이 모든 MZL은 악성 B세포와 관련되지만, 이들이 관여하는 조직뿐만 아니라 병리학, 임상 발표, 예후, 치료법에서도 차이가 있다.[1][4]
MZL은 모든 비호지킨 림프종의 5-17%를 나타내며, 외부, 비장, 노달 형태는 전체 MZL의 50-70%, ~20%, ~10%를 차지한다.[5]3가지 MZL 하위유형은 노년층(65~68세)에서 더 자주 발생하며, 증상이 없는 사람들에서 초기에 주의력 있는 대기전략으로 치료될 수 있는 나태성 질환이다.단, NMZL은 다른 하위[1] 유형보다 다소 장기간의 결과가 좋지 않으며, MZL 하위 유형 중 어떤 것도 특히 큰 B세포 림프종을 확산시키는 보다 공격적인 림프종으로 낮은 비율에서 진행될 수 있다.[6]MZL의 가장 두드러진 특징 중 하나는 감염이나[7] 자가면역질환을 동반하는 만성 염증에 의해 면역체계의 지속적인 시뮬레이션과 연관되는 사례가 많다는 점이다.[8]특정 감염성 병원체와 관련된 MZL 사례는 이러한 감염을 유발하거나 관련되는 병원체를 대상으로 하는 치료를 통해 치료할 수 있다.[7]
외측근 림프종
EMZLs are a form of MZL in which malignant marginal zone B-cells initially infiltrate MALT tissues of the stomach (50-70% of all EMZL) or, less frequently, the esophagus, small intestine, large intestine, rectum, conjunctiva of the eye, nasal passages, pharynx, lung bronchi, vulva, vagina, skin, breast, thymus gland, meninges (i.e. membranes) that뇌와 척수, 또는 다른 장기를 감싼다.[7][9]이러한 EMZL은 관련 기관에 기초하여 하위 유형으로 분류된다.예를 들어 위장의 EMZL은 1차 위 EMZL이라고 불린다. 이러한 EMZL은 하위유형에 관계없이 유사한 병태생리학(즉 질병을 일으키는 질서 없는 생리학적 과정)과 조직병리학(즉, 병든 조직의 미세한 특징)을 공유한다.그러나 하위유형은 표시, 진행, 심각도, 치료, 선동요인에 따라 차이가 있다.다음 두 섹션은 모든 EMZL 하위 유형에서 발견되는 공통 병리생리학적 및 조직병리학적 특징을 설명한다.각 EMZL 하위 유형별 특성은 이 두 절에 따른다.[citation needed]
병리학
EMZL의 발달에 수반되는 수많은 요인들이 나타난다. 소수의 경우, 특히 백혈병, 또는 Sjögren 증후군, Lupus erythematosus와 같은 다양한 자가면역질환의 가족력이 있는 환자들에게서 이 병의 빈도가 증가한다.유전적, 공유 환경 및 아직 확인되지 않은 다른 요인들은 EMZL 개발의 이러한 증가된 위험의 기초가 될 수 있다.[10] 많은 EMZL 사례의 시작에 있어 또 다른 주요 요인은 만성 감염이나 자가면역 반응에 의한 만성 염증이다.만성 염증은 B세포가 면역글로불린 헤비 체인 위치를 재조정하도록 자극하여, 그들은 상처받은 문제들에 의해 제시된 부자연스러운 항원을 인식하는 B세포 수용체들과/또는 염증의 근간을 이루는 전염성 물질들을 인코딩한다.이러한 재배열로 인해 B세포는 한계 B세포의 특징을 취하고 과도하게 증식함으로써 비정상적인 항원에 반응하게 된다.[11]결과적으로, 이러한 B세포는 단계적 패션 염색체 이상, 유전자 돌연변이, 그리고/또는 규제되지 않은 유전자를 점진적으로 획득하여 그들이 악성 상태가 되는 원인이 된다.특정 EMZL 하위유형에서 발생 빈도와 함께 EMZL에서 발견된 획득 유전체 이상에는 다음이 포함된다.[citation needed]
- 염색체 번역: 1) 위치 21에서 염색체 11의 긴(또는 "q") 팔과 18번 염색체의 q 팔을 위치 21에서 (t (11;18) (q21;q21) 번역으로 표기)하는 번역은 위 24%, 폐 38%, 그리고 드물게 다른 EMZL 하위유형에서 발생한다.이 번역은 API2 유전자의 일부를 MALT1 유전자의 일부와 함께 배치하여 API2-Malt1 융합 단백질을 인코딩하는 융합 유전자를 생성한다.이 치메릭 단백질은 전사 인자 NF-164B의 지속적인 활성화를 촉진한다.NF-κB는 세포의 생존, 사이토카인 생성 및 기타 잠재적으로 악성적인 행동을 증가시키는 다양한 유전자의 발현을 조절한다.2) t(14;18) (q32;q21)번역은 안경의 아드넥사 7%, 폐의 6%, 그리고 EMZL의 다른 경우에는 거의 발생하지 않는다.그것은 Malte1의 과도한 억압을 유발한다.이 단백질은 세포 생존을 연장하기 위해 프로그램된 세포 사멸을 간접적으로 억제하고 또한 NF-114B의 활성화를 촉진한다.3) t(1;14)(p22;q32) ("p"는 위장의 약 4%를 의미하며, EMZL의 다른 경우에서 전혀 일어나지 않는다.이 번역은 BCL10 유전자의 과도한 억압을 유발한다.Bcl10 단백질은 NF-118B의 활성화에 기여한다.4) EMZL의 희귀한 경우에 t(3;14)(p13;q32)번역이 발생하며 FOXP1 유전자의 과도한 억압을 유발한다고 생각된다.FoxP1 protein stimulates production of transcription factors such as PRDM1, IRF4, and XBP1 which promote the maturation of B-cells to plasma cells. 5) Three translocations, t(1;14)(p21;q32), t(5;14)(q34;q32), t(9;14)(p24;q32), and t(X;14)(p11.4;q32), occur in rare cases of EMZL but their effects on promoting malignancy are unknown.[12]
- Gene inactivations and mutations: 1) Inactivation or the TNFAIP3 gene due to its deletion on chromosome 6 about position 23 (i.e. a 6q23 deletion) or its mutation occur mainly in ocular adnexa, salivary gland, and thyroid gland EMZL. TNFAIP3 inactivation generally takes place in cases which do not have any of the above chromosome translocations.이 유전자의 제품인 종양 괴사 인자, 알파 유도 단백질 3, NF-κB의 활성화를 저해하는 기능. 2) MYD88 유전자의 기능상 변화는 안광성 아드네자 EMZL 사례의 약 5%에서 발생한다.이 유전자의 산물인 골수분화 1차 반응 88은 STAT3와 AP1 전사 인자와 더불어 NF-118B를 지속적으로 활성화시킨다.[12]3) EMZL에서 NOGH1 (모든 경우의 8%)과 NOGH2 (모든 경우의 8%) 유전자의 돌연변이가 발생한다.이들 유전자의 산물은 세포표면 수용체 단백질로, 세포핵에 결합하면 세포핵으로 이동하며 B세포의 발달, 증식, 생존, 이주를 조절하는 유전자의 활성화에 기여한다.[13]
많은 EMZL 하위유형은 악성발달에 기여할 수 있는 감염제 또는 자가면역질환과 연관되어 있다.다음 표에서는 이러한 EMZL 하위 유형, 관련 조직, EMZL 하위 유형의 발달을 뒷받침할 수 있는 감염제/자율면역 질환, 이러한 감염제/자율면역 질환을 악성종양과 연결하는 증거 강도, 관련 EMZL 하위 유형과 관련된 사례의 발생률(예: 백분율)을 보고한다.그것은 전염성 물질/자율면역 질환과 EMZL 하위 유형의 신가소성 B세포에 의해 발현된 일부 치메릭 유전자들이다.[citation needed]
| 서브타입 | 관련 조직 | 감염제 또는 자가면역질환자[7] | 증거 강도 | 발생[7][14] | 발현된 치메릭 유전자(사례의 백분율)[14] | |
|---|---|---|---|---|---|---|
| 1차 위 EMZL | 뱃속 | 헬리코박터 파일로리 | 확정의[7][15] | ~80% | BIRC3-MALT1(23%), IGH-FOXP1(3%), IGH-BCL-10(2%), IGH-MALT1(1%) | |
| 1차 위 EMZL | 뱃속 | 헬리코박터헤일마니센수라토 | 그럴[7][14] 것 같다 | <1% | 헬리코박터균에[16] 사용되는 항생제와 유사하다. | |
| 1차 침샘 EMZL | 침샘과 열상샘 | 쇠그렌 증후군 | 확정의[7][17] | ~4.3% | IGH-MALT1(6%), BIRC3-MALT1(2%), IGH-BCL-10(1%) | |
| 1차 갑상선 EMZL | 갑상선 | 하시모토 갑상선염 | 확정의[7][17] | ~0.5% | IH-FOXP1(50%) 및 BIRC3-MALLT1(9%) | |
| 1차 안광자 EMZL | 안광 아데넥사(즉, 궤도, 결막, 눈꺼풀) | 클라미디아 시타시 | 외설적인[7][18] | 10-50% | IGH-FOXP1(20%), IGH-MALT1 16%), BIRC3-MALT1(7%) | |
| 1차 피하 EMZL | 가죽을 벗기다 | 보렐리아 버그도페리 | 외설적인[18] | 가변적 | IGH-FOXP1(10%), IGH-MALT1(7%), BIRC3-MALT1(4%) | |
| 1차 소내장 EMZL | 소장 | 캄필로박터제주니 | 낮은[18][3] | 가변적 | BIRC3-MALT1(19%) 및 IGH-BCL10(7%) | |
| 1차 폐 EMZL | 폐를 끼치다 | 아크로모박터균류 | 낮은[19][20] | <50% | BIRC3-MALT1(45%), IGH-BCL10(8%), IGH-MALT1(7%) |
조직병리학
EMZL 병변의 조직병리학(즉, 현미경) 검사는 전형적으로 모호하게 결절되거나 확산된 세포 패턴을 보여준다.이러한 병변의 악성 세포는 다양한 비율로 소-중간 림프구, 구심성 B세포, 구심성 B세포, 단세포성 B세포, 혈장세포성 B세포 및/또는 큰 B세포의 형태론을 가지고 있다.큰 B세포가 다른 낮은 등급의 악성 형태학과의 세포로부터 분명히 분리되어 있는 눈에 띄는 시트를 형성할 때, 그 질병은 큰 B세포 림프종을 확산시키면서 훨씬 더 공격적인 악성종양으로 변화하고 있을 수 있다.이러한 변형은 EMZL의 원래 진단 후 4~5년 후 중위수에서 환자의 약 18%에서 발생한다.[21] 이 병변의 면역항진법 또는 신소성 대형 B세포는 CD20을 표현하지만 CD3 표면막 B 세포표지자 단백질은 표현하지 않는다는 것을 보여준다.세포는 거의 항상 BCL2를 표현하며 MNDA(사례의 약 70%), CD23(사례의 약 33%) 및 CD5(사례의 약 20%) 표식 단백질을 표현할 수 있지만 사이클린 D1 표식 단백질,[21] T세포 표식기, CD10 또는 BCL6은 표현하지 않는다.[1]
아형, 진단, 치료, 예후
관련 장기에 기반한 다양한 EMZL 하위 유형이 있다.이러한 아형은 거의 모두 해당 장기의 점막 관련 림프조직에서 발생하며 흔히 해당 장기의 MOLT 림프종(예: 위 MOLT 림프종)으로 불린다.그러나 이러한 림프종은 영향을 받는 기관의 1차 EMZL(예: 1차 위 EMZL)이라고도 한다.두 용어가 모두 이 하위 유형에 사용되지만, EMZL 하위 유형이 처음에 개발되었으며 표시된 조직으로 제한될 수 있음을 나타내기 위해 1차(관련 기관) EMZL이 선호된다.그러나, 약 30%의 경우는 주로 림프절과 드물게 골수인 다른 부위로 전파된다.이러한 아형의 악성 B세포도 혈액 내에서 순환할 수 있지만 이는 매우 드문 일이다.EMZL의 하위유형이나 다른 조직으로의 전파에 관계없이, 이러한 림프종의 예후는 일반적으로 86%[14][6]에서 95% 사이의 5년 전체 생존기로 좋다.
1차위
1차 위 EMZL은 1차 위 MOLT 림프종이라고도 불리며, 더 흔히 위 MOLT 림프종이라고 불리며, 보통 다른 GI 트랙 및/또는 비 GI 트랙 사이트를 포함하는 나태성 질환이다.일반적으로 병의[22] 초기 단계에서 나타나는 환자들은 기침, 배변, 철결핍 빈혈 등으로 나타나는 메스꺼움, 구토, 소화불량, 상복통, 위출혈 등의 다양한 증상을 보인다.드물게 열이나 야근과 같은 위나 B 증상이 있는 환자는 드물다.만성 헬리코박터균 감염자가 있는 개인도 구토증이 있을 수 있다.[23]상부 GI관의 병변에[15] 대한 내시경 검사 및 조직검사, 내시경 기반 초음파[22] 검사에서는 위장의 화로성 항륨에서 가장 많이 나타나는 병변이 나타나는데, 이러한 병변은 표면 점막 에로스, 얕은 궤양, 결절, 확대된 융단, 위벽의 두꺼움이다.[15]1차 위 MOLT 병변의 조직병리학 및 이러한 병변의 악성세포에 의해 표현되는 표식 단백질과 유전체 이상 등은 조직병리학 섹션에 제시되어 있다.1차 위 EMZL은 사례의 80%이상의 헬리코박터균에 의한 위 감염이나 <1%이상의 헬리코박터헤일마니감수라토>에 의한 위 감염과 관련이 있다.[14]위 헬리코박터 파일로리가 위 EMZL의 원인임을 나타내는 징후로는 양성 요소 호흡 검사, 환자의 대변에서 병원체의 항원을 검출하는 양성 대변 검사, 생체조직 표본에서 양성 요소효소 검사, 병원체에 대해 지시된 특정 항체를 사용한 양성 혈청 또는 전혈 검사 등이 있다.생체조직의 조직 배양액에서 병원체의 성장.[24]헬리코박터 힐만니 센슈 라토는 최소 11종의 헬리코박터 종을 지정하는데, 이 중 5종은 인간의 위를 감염시키는 것으로 알려져 있다.이러한 종에 의한 감염에서 요소 호흡검사가 양성반응이 덜하고, 그들에 대해 지시된 항체가 일반적으로 이용가능하지 않으며, 문화적으로 성장하기 어렵기 때문에 헬리코박터 힐만니 센수 라토가 인간의 위질환에 책임이 있다고 판단하기는 더욱 어려웠다.따라서 헬리코박터 힐만니 센슈 라토의 진단은 특별한 은색 얼룩 방법을 사용하여 조직이나 분변 물질에서 유기체를 역사적으로 검출하고 유기체 DNA 및/또는 유기체 23SRNA에 있는 특정 유전자(예: 요소효소 A, 요소효소 B, 열충격단백 60 및/또는 자이드 서브유닛 B)를 염기서열 분석하는 데 달려 있다.[16]'지역화(즉, Ann Arbor stage I 및 II) 헬리코박터 파일로리 양성 1차 위상 EMZL은 여러 가지 다른 헬리코박터 파일로리 박멸 프로토콜 중 하나를 사용한다.이러한 프로토콜에는 양성자-펌프 억제제(예: 오메프라졸 또는 란소프라졸[25])와 여러 가지 다른 항생제 조합 중 하나(예: 클라리트로마이신 + 아목시실린 또는 레보플록사신 + 니타작산화물 + 독시사이클린)가 포함된다.[15]정확한 약물 요법은 개별적인 경우에서 이러한 항생제에 대한 병원체의 내성이 알려져 있거나 의심되는 것을 기준으로 선택된다.요법은 7~14일 동안 제공되며 4주 이내에 요소 호흡 또는 대변 항원 검사에 의해 병원체의 존재 여부를 검사하여 후속 조치를 취한다.초기 섭생법이 병원균을 박멸하지 못할 경우 3, 4가지 약물을 조합하여 두 번째 요법으로 환자를 치료한다(예: 양성자-펌프 억제제 + 비스무트 서브시티트 + 테트라사이클린 + 메트로니다졸).[15]병원체 박멸은 70~95%의 사례에서 성공적이다.최근에는 순차적 치료요법(즉, 양성자-펌프 억제제 + 아목시실린에 이어 양성자-펌프 억제제 + 클라리트로마이신 + 티니다졸)을 보고하여 90% 이상의 사례에서 병원균을 박멸하고 있다.[15]t(11;18) 또는 t(1;14) 염색체 변환을 억제하여 각각 BICC3-MALT1 또는 IGH-BCL10 치메릭 단백질을 표현하는 병변을 가진 환자들은 헬리코박터 파일로리 박멸 프로토콜에 내성이 있는 발병률이 증가한다.[14]병원체 박멸을 경험한 환자의 약 50-80%는 3-28개월 이내에 림프종에 대한 완화와 장기 임상적 조절이 발달한다.위와 주변(즉, 근위) 림프절에 대한 방사선 치료법을 성공적으로 치료하기 위해 사용하였다: a) 인용된 약물 프로토콜에 의해 병원체가 근절되지 않은 국부 헬리코박터균 양성 1차 위 EZML, b) 국부 헬리코박터균 음성 1차 위상 EZML, 그리고 c) 헬리코박동자균성 1차 위상 EZML 사례.노인이나 연약한 환자의 오리 양성 및 음성 EZML 환자전신(예: 앤아버 3기 및 IV) 1차 위 EMZL 증세가 없는 환자는 주의깊게 기다림 또는 면역치료제인 리툭시맙(4주 동안 제공)과 함께 6~12개월 동안 제공된 클로로람부실(clorambucil)을 혼합하여 치료를 받았으며, 이들 환자의 58%가 진행 없는 생존율을 달성했다.5년전에연약한 단계 3/IV 환자들은 리툭시맙 또는 사이클로인산아미드만으로 성공적으로 치료되었다.[1]헬리코박터 힐만니 센슈 라토의 치료는 훨씬 적은 연구에 의존하지만, 일반적으로 헬리코박터 파일로리의 치료에 사용되는 권고사항을 따른다.[16]
1차 소내장
1차 소내장 MZL, 1차 소내장 MLAT 림프종이라고도 하며, 일반적으로 대장통증, 설사, 그리고 고도 질환 징후 및 흡수의 증상(예: 체중 감소, 영양실조, 빈혈), 소내장 장애, 복강 내 유체(즉 복강 내 유체) 및/또는 용액 확대 등의 증상이 나타난다.mph 노드, 비장 및/또는 간.[26]일반적으로 진행성 질환이지만 초기 초기 소내장 MZL 환자는 자발적이고 완전한 재입원을 할 수 있다.[7]이전에는 지중해 림프종이라고 불렸거나 알파 헤비 체인 질환(IgA/αHCD)의 한 종류로 여겨졌던 면역역화성 소내장 질환은 변종이며, 지금까지 소내장 MZL의 가장 흔한 형태였다.[27][26]이 변종은 지중해 분지의 나라들, 특히 중동의 나라들에서 풍토적이다. 비록 이 질병의 사례가 전 세계적으로 발견되었지만 항상 중동에서 온 이민자들에게는 발견되지 않았다.[26]면역항진성 소내장질환은 전체 GI 촉각 림프종의 약 30%를 구성하며, 주로 사회경제적 지위가 낮은 20~30세 개인에게 고통을 주며, 식인성 세균인 캄필로박터제주니에 의한 감염과 관련이 있다.캠필로박터제주니 관련 질병은 인간 백혈구 항원 AI19, B12, A9 등을 표현하는 개인이나 혈액형 B형인 사람에게 더 많이 나타난다.이 개인은 유전적으로 그 질병에 걸리기 쉽다고 제안된다.[18]이러한 경우 소변성 장 병변의 면역억제법은 캄필로박터 제주니의 존재를 일반적으로 감지하고 항생제에 반응할 것으로 예측한다.그러나, 이 박테리아가 면역 억제제 작은 장 질환의 실제 원인인지는 확실하지 않다:[26] 그것은 단지 그 병에 걸린 사람들의 내장을 식민지화 시킬 뿐이고, 아직 밝혀지지 않은 항생제에 민감한 박테리아나 비균 병원균, 예를 들어 기생충은 그 질병의 발달을 뒷받침한다.[26]
1차 소내장 EMZL 사례에서 이중 풍선 장내시경 및 캡슐 내시경 검사에서 광범위한 점막 에로스와/또는 덜 흔하게 용종, 결절, 질량 및/또는 흉터가 나타난다.[22]이러한 병변은 각각 약 63, 17, 8%의 경우 십이지장, 제주금 또는 장막으로 국소화되거나, 약 17%의 경우 1개 이상의 작은 장내 부위가 관여한다.[26]병변은 임파구, 비정형 플라즈마 세포, 그리고 덜 흔하게는 EMZL에 전형적인 표지자 단백질(예: CD20, CD79a)을 발현하는 센트로사이티 세포와 함께 장내 라미나 프로프리아에[18] 침투하는 센트로사이티와 같은 세포로 구성되어 있다.[26] 캄필로박터쥬니는 면역력에 의해 이러한 병변에서 검출된다.이 질환을 앓고 있는 환자들은 일반적으로 혈액에 IgA 헤비 체인의 조각 결정 가능한 부위로 구성된 단핵항체가 존재하여 단핵감염증을 증거로서 가지고 있다.이상 IgA 단백질은 IgA의 헤비 체인 파편에 대해 지시된 항체를 이용한 면역화에 의해 환자의 세라에서 검출된다.[26]
1차 소내장 EMZL 치료는 장 장애 및 고도로 국소화된 질병을 치료하기 위한 수술 및/또는 방사선 치료를 포함한 증상들의 영양 지원 및 제어에 초점을 맞추었다.그러나 연구결과에 따르면 이 질환을 앓고 있는 개인, 특히 면역항암제 소장의 질환 형태는 테트라사이클린, 메트로니다졸 또는 테트라사이클린 + 암피실린과 같은 광범위한 항생제로 치료한 후 전반적인 반응률이 90%에 이르는 것으로 나타났다.[3]대부분의 경우 이러한 반응은 지속적이다.이에 따라 초기 질환 치료에 항생제 치료가 권장된다.항생제 치료에 대한 내화성 환자들은 화학요법으로 치료되었다(즉, CHOP 또는 SOP와 유사한 방법) 테트라사이클린으로 장기간 유지 관리되었다.이 치료법은 5년 전체의 생존율이 70%에 이른다.수술과 방사선치료는 질병에 대한 치료법이 아니기 때문에, 내화성 질환 및/또는 재발성 질환에 대해서는 고선량 화학요법과 자가 줄기세포 이식이 권장되고 있다.[2]
콜록탈 EMZLs
대장이나 직장과 관련된 ENZL은 극히 드물다.이 ENZL 아형 중 하나로 진단된 사람은 73건을 대상으로 한 2019년 검토에서 중위연령이 62세(범위 26~72세)로, 주로 여성(66%), 1차 종양이 직장(사례 74%), 우대장(13.6%), 횡대장(4.1%), 지그모이드 대장(8.2%)에 위치했다.이 사람들 중 30%는 다발성 종양을 가지고 있었고, 그 중 40%는 대장과 직장의 바깥에 있는 위장관에 있었다.이들 개인은 초기에 국소수술 19건 중 18건, 보다 광범위한 수술 절제술, 13건 중 12건 화학요법, 방사선치료(5건 중 4건, 15건 중 12건의 헬리코박터 파일로리 박멸을 위한 항생제 치료로 치료 및 완전한 재치료를 받았다.두 사람은 치료를 받지 못했는데 이들 중 한 명은 자발적인 완쾌를 겪었다.완치되지 않은 8건은 2차 치료가 필요했고 3건은 완치 실패였다.[28]다음 절에서는 이 두 가지 EMZL 하위 유형을 추가로 설명한다.
일차대장균
1차 대장 EMZL은 1차 대장 MALT 림프종이라고도 불리며, 대개 질병의 초기 단계에서 하부 GI관 출혈(예: 타리 배변 및/또는 철결핍 빈혈)의 증거와 함께 나타나며, 일반적으로 아랫배에 통증이 덜하며, 장 천공이나 난독이 있는 경우는 드물다.내시경 검사를 통해 단일 용종이나 드물게 여러 개의 용종, 점막 궤양 또는 점막 결절이 나타나는 경우가 가장 많다.진단은 EMZL의 전형적인 조직학을 보여주는 병변 생검(예: 단세포 및/또는 플라스마 세포의 형태학적 특징을 보일 수 있는 중소형 림프구로 구성된 확산 침투)에 대해 전달된다.이러한 병변의 림프구는 EMZL 병변의 전형적인 B세포 표지자(예: CD19 및 CD79a)를 표현한다.이 림프종에 대한 최고의 치료법이 논의되고 있다.외과적 절제술, 내시경적 절제술, 방사선치료, 화학요법 등이 채용되었다.항암화학요법에 따른 수술(클로로암부실 또는 리투시맙과 결합한 미톡산트론 + 클로로암부실 + 프레드니손 또는 사이클로인산아미드 + 빈크리스틴 + 프레드니손)은 이 질환에 대한 1차 치료법으로 간주되어 왔다.최근에는 리툭시맙이 단일 에이전트로서만 1차 대장내 MOLT 림프종 치료에도 성공한 것으로 나타났다.마지막으로 1차 대장 EMZL의 희귀한 경우는 헬리코박터 파일로리 항생제 요법을 사용하여 완전히 해결되었다.[9]
1차 직장
더 흔히 직장의 MALT 림프종이라고 불리는 1차 직장 EMZL은 대개 항문 출혈 및/또는 대변에 피가 있는 질병의 초기 단계에 나타난다.내시경 검사에서 직장 용종, 직장 질량 또는 덜 흔한 직장 궤양이 나타난다.[9]이 림프종의 몇몇 사례들은 자연적으로 퇴행하는 것으로 보고되었다.[29]검사 결과 국소성 질환(즉, 1단계 또는 2단계)이 있는 경우는 90% 이상이다.림프종의 병변은 반응성 림프성 모낭이 구심성 또는 단세포성 B세포와 침투한 것이 특징이다(후자 세포는 플라즈마 세포의 특징을 나타낼 수 있다).이러한 병변의 악성 세포는 t(11;18) 변환을 포함할 수 있으므로 API2-MALT1 치메릭 단백질(사례의 11%)을 표현할 수 있다.케이스스트의 22-45%는 헬리코박터 파일로리 GI 트랙터 감염과 관련이 있다.[30]이 질병의 치료에는 방사선치료, 외과적 절제, 내시경 점막절제술, 다양한 화학요법, 항생제 기반 헬리코박터균 박멸 등이 있다.현재 권장되고 있는 표준 항생제 요법을 이용한 헬리코박터 파일로리 양성 환자에 대한 박멸치료는 19건 중 12건에서 완전한 반응을 보여 적절한 치료법으로 평가되고 있다.국소성 질환에 대한 외과적 절제술은 개별 사례에서 장기 생존을 달성했다.[30]다만 국소성 질환에 대한 방사선치료는 19건[30] 중 16건에서 5년 무질병, 전체 생존율이 각각 76%, 96%로 나타났으며 헬리코박터균 양성 1차 직장 EMZL을 앓고 있는 환자들에게 선호되는 치료법으로 제시되고 있다.[9]
1차 식도
식도의 1차 EMZL은 식도의 MOLT 림프종이라고도 하며, 대부분의 경우는 일본에서 보고되는 등 극히 드물다.식도 부위의 이물감 및/또는 삼키는 것이 어려운 증상을 나타낸다.내시경 검사, 내시경 검사, 흉부 CT 스캔을 통해 다양한 크기의[31] 단독 식도 질량 또는 보다 일반적으로 식도의 선형 중심 움푹 들어간 부분이나 능선을 발견할 수 있다.[32]2017년 리뷰에서는 식도 EMZL 환자 18명 중 6명이 헬리코박터 파일로리 동시 감염증세를 보였다.식도 EMZL에 있는 병변의 조직병리학은 CD10이 아닌 CD20을 표현하는 구심세포와 단세포와 작은 림프구의 존재를 보여주는 EMZL의 전형이다.[31]식도 EMZL의 치료는 내시경 절제, 외과적 절제, 방사선 치료, 내시경 절제 및 방사선 치료, 또는 화학요법으로 구성되었다.대부분의 환자들은 이러한 개입에 대해 완전한 반응을 보인다.그러나 치료 후속 시간이 짧아서(6~35개월) 이러한 반응의 장기적 효능은 알 수 없다.식도의 헬리코박터 파일로리 관련 EMZL을 치료하기 위한 체계적인 항생제 기반 퇴치 요법은 최근 발병 사례가 보노프라잔 + 아목시실린 + 클라리트로마이신으로 1주일 동안 치료될 때까지 보고되지[31] 않았다.그 환자는 요소 호흡 테스트를 통해 박테리아를 제거하는 증거를 보여주었지만, 그럼에도 불구하고 림프종의 진행을 증명했다.[33]
1차안상아드넥사
1차 안광자 EZML(안광자의 1차 EMZL, 1차 안광자 MOLT 림프종 또는 안경의 1차 안광자 임파종이라고도 함)은 주로 노년층 환자(중간 65세)에서 발생한다.개인은 가축, 주로 소와 돼지에 노출되거나 이러한 동물의 고기로 작업한 오랜 이력이 있어 질병에 걸리기 쉽다; 자가면역 질환, 특히 자가면역 갑상선 질환, 그리고 감염, 특히 야생 조류, 농장을 감염시키는 전염성 세포내 세균인 클람도펠리아 psitaci.말, 그리고 인간들.인간에게 있어 호흡기 경직증과 눈병, 특히 만성 결막염을 유발한다.[34]클램미도펠리아 pittaci는 이탈리아, 오스트리아, 독일, 한국에서 가장 높은 발병률을 보이는 1차 안광자 EMZL 환자 47~80%의 병변에서 검출됐다.영국과 중국 남부에서 훨씬 더 낮은 검출률이 보고되고 있는 반면 미국과 일본으로부터 이 유기체에 대한 증거는 거의 또는 전혀 없었다.[14]위 헬리코박터균 감염 또는 C형 간염 바이러스 감염이 1차 안광성애드넥사 EZZ와 관련이 있는 것으로 보고되었다.ML은 각각 약 33%, 2-36%로, 드물게 헤르페스 심플렉스 바이러스 1, 헤르페스 심플렉스 2, 아데노바이러스 8, 아데노바이러스 19, 클라미디아 트라코마티스 또는 클라미도필라 아포투스 감염과도 연관이 있다.이러한 감염과 1차 안광자 EZML의 개발 및/또는 진행에 대한 관계는 불분명하다.[34]
일반적으로 한쪽 눈이 수반되는 결막(경우 중 25%)이나 장내(경우 중 75%) 병변이 있는 환자는 양쪽 눈이 모두 수반된다.결막병변은 보통 안구의 바깥층을 덮는 연어 적색 패치로 나타나며, 장내 병변은 흔히 외피탈모(눈이 튀어나온 경우)로 나타나며(경우 27%) 눈에 잘 띄는 안구질량(19%), 안검하수(눈꺼풀 처짐) 및/또는 덜 흔한 복시(예: 이중 시력)로 나타나며, 궤도 이동성이 저하된다.시브 찢기 및/또는 궤도 결절.[34]결막질환자는 증상이 없을 수 있다.[35]1차 안광자 MZL 환자 중 가변비율이 하시모토 갑상선염, s그렌 증후군 또는 IgG4 관련 질병으로 동시에 고통을 받을 수 있다.일부 연구에서는 위장의 헬리코박터균 감염(사망 45%)이나 다른 조직에서의 EMZL(사망 25%)과도 연관이 있다는 사실도 밝혀냈다.1차 안광자 EMZL의 병변은 EMZL의 대표적인 것으로, CD20, CD791, PAZ5 및/또는 CD10 또는 사이클린 D1 단백질이 아닌 많은 구심성 B세포, 모노세포와/또는 작은 림프구를 포함한다.[36]MALT1 유전자의 과대 발현으로 이어지는 t(1:14)(p22:q320 염색체 변환, 삼분법 3, 삼분법 18, 염색체 6의 긴 팔의 위치 23에서의 삭제도 일차 안광자 EMZL에서 흔히 발견된다.[34]
그 병을 치료하려면 더 많은 연구가 필요하다.2)15명의 환자들에서 CHOP 약물 요법과 화학 요법 재발 없이 5에서 9, 지역 재발이며, 2환자들에 foll의 55개월 후에 체계적인 재발에 사면된 것이 국부적인 병 환자:1)방사선 치료의 경우 52-93%의 5년systemic-free( 아니지만local-free)재발율 90%에 완전한 반응 달성했다.악-up. 3)33명에 클로와 화학 요법 26명의 환자에서 추적 조사의 24개월 후 4)rituximab과 면역 요법 완전한 반응을 거둔 하나는 단기에 더 오래 후속 periods[36]에 다소 더 좋은 결과 결막 병 환자에서 발생하는 좀 더 학습을 요구하기 쉬운 성적을 올렸다.;[34]d)독시사이클린 항생제 치료는 각각 67%, 55%의 무장애 생존율, 5년 무진행 61%[36]의 무장애 생존율을 달성했다.전신적 관여를 가진 환자에 대해 일반적으로 인정된 선택 치료는 리툭시맙과 결합되는 다양한 화학요법을 사용한다.클로로암부실, CHIP요법, 리툭시맙으로 치료된 대부분의 환자에서 완전한 반응이 관찰되었지만 재발률이 높았다(예: ~ 33%).[34]
원피부
1차 피하 EMZL 또는 1차 피하 MALT 림프종(피부 관련 림프조직 림프종이라고도 함)은 일반적으로 팔 및/또는 트렁크에 위치한 단일 또는 여러 개의 작은 교황 또는 격자로 나타난다.역사학적으로 이러한 병변은 수많은 T세포 림프구와 혼합된 혈장세포 또는 단세포와 같은 형태학을 가진 작은 B세포의 혼합물을 포함하는 반응성 생식선 중심부로 구성된다.[37]이러한 병변의 B세포는 EMZL에서 흔히 볼 수 있는 B세포 표지를 표현한다.[38]라임병의 원인물질인 보렐리아 버그도페리의 DNA는 독일, 이탈리아, 일본, 터키 환자의[39] 10%~42%에서 검출됐지만 스페인, 핀란드, 네덜란드, 미국 환자는 검출되지 않았다.[40]이 병은 거의 항상 나태한 과정을 가지고 있지만, 대개 피부에 국한되는 반복적인 재발의 대상이 된다.드물게 1차 피부 EMZL은 다른 조직으로 전파되어 전신 질환이 된다.[40]1차 피부 EMZL의 치료는 질병의 나태한 행동을 고려할 때 보수적이었다.보렐리아 부르도페리 양성 질환에서는 항생제 치료제(세팔로스포린 또는 테트라시클린의 화학물질을 1차 항생제 선택으로 간주함)가 고려되어야[7] 하지만, 이 조치는 박테리아가 그 질병과 연관되지 않은 미국과 같은 지역에서는 덜 적용 가능하다.[38]항생제 치료가 선택이 아니거나 실패한 보렐리아 부르도페리 음성 질환의 치료는 병변의 정도에 따라 달라진다.단일 병변 치료로는 수술적 절제술, 병변에 인터페론-알파 또는 리툭시맙을 직접 주사하는 방법, 국부적 외부 빔 방사선 치료 등이 있다.이들 치료 후 5년, 10년 후 무병률이 각각 57%, 43%로 나타났다.전염병에서는 주의 깊은 기다림, 정맥주사 리툭시맙, 화학요법이 사용되었다.정맥 리툭시맙은 항암치료를 받지 않은 환자에게서 85%의 완치율을 달성하며 정맥 리툭시맙을 사용하거나 사용하지 않은 클로로암부실 항암치료는 사건 없는 생존시간이 현저히 개선되었으며, B 증상(열, 야근, 체중감소 등), 높은 수치의 환자에게는 SOFF 항암치료가 권장된다.혈청 젖산 탈수소효소 또는 더 공격적인 단계로 진행된 질병.[7]
1차폐
1차 폐 EMZL(또는 1차 폐 MOLT 림프종)은 희귀한 질환이지만 그럼에도 불구하고 폐에서 발생하는 모든 림프종의 최대 80%를 차지한다.이 림프종이 발병하는 원인은 불분명하다.한 연구에서 124명의 환자 중 57명의 아크로모박터균이 폐병변에서 DNA를 증명했다고 밝혔다.[41]아크로모박터실록시단스는 낭포성 섬유증 환자의 폐에서 일상적으로 격리되는 베타프로테오박테리아로, 바이러스성은 낮지만 항생제에 대한 내성이 매우 강하다.[7]1차 폐 EMZL은 대개 50~60세 환자를 괴롭힌다. 거의 50%의 경우, 관련 없는 이유로 시행된 흉부 엑스레이나 CT 스캔에 이상이 있는 증상이 없는 사람에게서 그 질병이 진단된다.[41]증상이 있는 환자들은 대개 가슴통증, 호흡곤란, 그리고/또는 호흡기 감염이 재발한 이력이 있다.[14]흉부 엑스레이와 CT 스캔을 보면 대개 양치성 치경 치경량이 <5 cm>이다.더 심한 폐손상(예: 식전, 흉막유출 또는 경미한 림프종증)은 <10%의 경우>에서 발생한다.더 진행된 질환을 가진 환자들은 골수 관여(사례의 13-30%), 관여 또는 위, 눈, 귀, 코, 목과 같은 폐 밖의 다른 부위(사례의 25-35%)를 가질 수 있으며, 특히 공격적인 질환의 경우는 드물지만 발열, 야근, 체중 감소와 같은 전신 B 증상을 보일 수 있다.단핵감마병증(즉, 혈중 단핵감마글로불린 과다량)은 20-60%의 사례에서 발견되며, 특히 혈장세포와 같은 외모를 가진 림프구를 포함하는 조직 병변을 가진 개인에게서 발생한다.1차 폐림프종의 병변은 동체 기도의 점막에 있으며 바늘 생검, 기관지 조직 검사, 대뇌 조직 검사 및/또는 동체 분변 라바지에 의해 진단된다.진단과 일치하는 검사 결과에는 EMZL에서 발견되는 전형적인 B세포 표지를 가진 작은 B세포의 점막이 침투하는 것을 나타내는 생체검사 시료가 포함되며, 때로는 혈장세포 외관을 가진 B 림프구로 구성되기도 한다.브론초올보랄 라바지 액은 이러한 표지를 가진 10% 이하의 세포를 포함할 수 있다.폐병변의 B세포는 t(11;18)(q21;q21) 변환을 가지므로 API2-MALT1 치메릭 단백질을 사례의 약 40%로 표현한다.이 세포에서 덜 자주 발생하는 유전적 이상으로는 염색체 3 및/또는 18의 t(1;14) (p22;q32) (14;18) (q32;q21) 및 t(3;14) (p14.1;q32) 변환과 삼분법이 있다.[41]
1차 폐 EMZL의 치료는 다양하다.항생제 치료는 연구되지 않았으며 권고될 수 없다.전체 5년 생존율이 89-100%[42]에 이르는 권장 치료법으로는 수술, 방사선치료, 화학요법, 면역요법, 주의 깊은 기다림이 있다.[41]국부적 질병의 경우 수술적 절제 또는 방사선치료를 고려할 수 있다.보다 광범위한 질병에서 리툭시맙 면역요법은 70%의 응답률을 달성했지만 재발률이 높은(~36%)을 기록했다.루다라빈, SOP, 클로로암부실 또는 클로로암부실 + 리툭시맙을 사용한 치료는 각각의 치료법으로 광범위한 질병을 치료하는데 사용되어 왔으며, 전체 평균 생존 시간이 대략 10년 이하였다.[41]
1차 침샘
경우는 주로의 눈물샘을 포함하여 Sjögren 증후군 제1차 침샘 EMZL(또한 타액선 MALT 림프종이라고 부른 것이다)이나, 1차 누선 EMZL(또한 누선의 MALT 림프종이라고 부른 것이다)합병증, 자가 면역 질병은 salivary 및/또는 눈물 분비 기관들의 만성 염증에 의해 특징입니다.[17]이 자가면역질환은 전염성 물질을 포함한 유전적, 환경적 요인이 복합적으로 작용하여 발생하는 것으로 생각된다.이 림프종은 Sjögren[8] 증후군에 걸린 환자의 약 3%를 괴롭히고, 하나 이상의 고통스러운 침샘 또는 덜 흔하게, 열상샘을 포함한다.[17]자가면역질환과 EMZL의 진단 사이의 중간 시간은 7.5년에서[17] 11년 사이에 다양하다.[19]고통받는 개인은 일반적으로 55-60세이며, 편상샘 또는 다른 침엽수나 열상샘의 국소적 경화 및/또는 확대와 함께 존재한다.국소 림프절이나 비장이 림프절이나 비장을 동반하여 림프종증이나 비장을 유발하는 경우가 약 20%인 반면, 높은 수준의 림프종이 있거나 진행 중인 경우는 주로 큰 B세포 림프종을 확산시킨다.[17]조직학적으로 관여된 분비샘은 침투하는 림프구와 함께 전형적인 EMZL의 림프구 기반 병변을 보여주는데, 경우에 따라서는 혈장 세포를 닮은 형태학적 특징을 가지고 있다.질병이 더 진행된 개인에서는 이러한 병변이 눈구멍, 비강, 인두, 하부 호흡기 기도, 위 및/또는 갑상선의 점막 라이닝에서 발생한다.[8]
1차 침샘/후두샘 EMZL 치료는 표준화되지 않았다.소수의 환자들은 주의 깊은 기다림으로 치료를 받았으나 대부분의 환자들은 수술, 방사선치료, 화학요법, 면역요법(예: 리툭시맙), 면역요법(예: 리투시맙 또는 루다라빈 + 리투시맙 또는 벤다무스틴 + 리투시맙) 면역요법과 화학요법을 병행했다.일반적으로 치료기간 5년, 10년, 15년 후의 전반적인 생존율은 각각 95%와 85%, 78%로 나타났다.이러한 치료요법에 대한 반응은 매우 좋았지만, 치료받은 환자의 약 33%가 침샘/후두샘, 림프절 또는 다른 부위에서 림프종의 재발을 경험하고 있다.[19]
림프구경막염
림프구경막염(Limpoepithellial sialadenitis)은 만성 시알라덴염이라고도 불리는데, B세포에 의한 침샘의 양성침입으로, 한계영역 B세포, 구심체, 단세포의 형태학적 특징을 가지고 있다.역사학적으로 이 질환은 침샘관 내 주상피층의 위축과 더불어 이들 분비선에서 상피세포와 림프절 병변의 증식과 관련이 있다.보통 Sjorgen 증후군의 구성요소인 반면, 이러한 역사학적 발견은 또한 이 증후군의 증거가 없는 환자들에게서 발생할 수 있다.매우 드물게 림프구두막염은 침샘 EMZL로 진행되었다.[14]
1차 갑상선
갑상선의 MOLT 림프종이라고도 불리는 1차 갑상선 EMZL은 극히 드물다.하시모토의 갑상선염에 의해 발병하는 갑상선에서 거의 독점적으로 발생하는데, 갑상선에 B세포를 포함한 임파구가 축적되어 갑상선 조직이 파괴되는 것이 특징인 자가면역질환이다.[43]이 신드롬을 앓고 있는 환자들은 갑상선 림프종 발병 위험이 40배에서 80배까지 증가하는데, 이 중 25%가 일차 갑상선 EMZL이다.하시모토의 이 림프종이 발병하는 갑상선염 환자들은 일반적으로 20-30년 동안 갑상선염을 앓아 왔으며 현재 갑상선 크기가 급격히 증가하고 있으며 이와 관련하여 후레쉬, 고음의 호흡소리, 삼킴이나/또는 호흡곤란 등이 발병한 여성([17]중간 70세)조직학적으로, 이 림프종의 병변은 일반적으로 중간 크기의 B세포, 구심체, 플라스마 세포에 의해 채워지는 반응성 림프포이드 모낭과 림프절 병변으로 구성되며, 약 1/3의 경우, 큰 B세포 림프종에서 보이는 것과 유사한 큰 림프구 세포의 시트로 구성된다.이러한 병변의 악성 세포는 EMZL에 일반적인 B-세포 표지를 표현한다. 예를 들어 CD20과 BCL-6은 아니지만 CD10 단백질은 아니다.[44]일차 갑상선 EMZL을 가진 환자들은 더욱 확산된 림프종, 특히 큰 B세포 림프종, 또는 다른 방법으로, 노달 MZL 또는 비장 MZL에 걸릴 위험이 증가한다.[17]
1차 갑상선 EMZL의 치료는 환자의 최대 90%가 초기 질환으로 진단되기 때문에 일반적으로 보수적이다.[17]이 질환의 최적 치료법은 확실하지 않지만 국소성 질환 환자의 대다수는 수술, 방사선 치료, 또는 양방식의 조합으로 치료하여 전체 응답률이 [19]최대 100%에 이르고 5년 무질병 생존율이 95%에 [17]이를 것으로 추정되고 있다.수술+방사선 치료만으로는 방사선 치료만으로는 더 나은 결과를 얻을 수 없는 것으로 보인다.[44]더 높은 등급의 림프종(기본적으로 확산되는 B세포 림프종)으로 진행된 광범위한 질병이나 질병을 가진 환자들은 화학요법(보통 SOP[44][45]) 및/또는 면역요법(즉 리툭시맙[44])으로 치료를 받아왔다.다만 1차 갑상선 EMZL이[46] 전파된 항암치료 환자나 악성 림프종까지[17] 진행된 질환의 5년 생존율은 각각 35%, 44%에 불과하다.
EMZL 및 기타 자가면역질환
하시모토 갑상선염 이외의 자가면역질환을 앓고 있는 환자도 하나 이상의 조직 부위에 EMZL이 발생할 위험이 높아진다.예를 들어 전신 루푸스 에리테마토스 환자들은 일반 모집단에 비해 EMZL 발병 위험이 7.5배 증가하며, 이 발병 진단 시 중위연령이 50세로 6.7~17.8년간 전신 루푸스 에르세마토스 진단을 받았다.[17]류마티스 관절염,[17] 면역혈소판성 자반증,[47] 자가면역 용혈성 빈혈[48] 환자는 유사하게 EMZL에 걸리기 쉽다.이러한 연관성의 정확한 이유는 불분명하지만, 일반적으로 각 질병에 수반되는 만성 염증은 B세포의 악성 행동을 촉진하여 EMZL의 발달을 촉진한다고 여겨진다.[17]EMZL에 의해 복잡한 자가면역질환을 가진 환자에 대한 치료에는 대개 자가면역질환과 EMZL 모두를 치료하는 데 사용되는 표준조치가 포함되었다.[48]
1차 중추신경계
중추신경계의 1차 EMZL은 극히 드문 질환이다.다른 중추신경계 림프종에 비해 공격성이 높은 중추신경계 1차 EMZL은 비침습성 저급 림프종이다.발표된 70건의 사례에 대한 검토에서, 이 질병은 뇌와 척수를 둘러싸고 있는 두꺼운 막(56건), 뇌나 척수 실질마(6건), 뇌 동굴성 부비동(4건), 뇌 맥락막(3건), 뇌 내부[심실] 내에서 악성 한계영역 B세포의 증식을 수반했다.시스템[호흡기] (1건), 소뇌동각 (2건), 시신경 (2건)환자(여성 77%, 중위연령 55세, 18세~78세)는 관여 부위에 따라 다양한 신경학적 징후와 증상을 보였다.가장 많이 나타나는 증상은 두통(30건), 발작(22건), 시각변화(19건) 등이었다.덜 흔하게, 환자들은 페레스테시아(즉, 비정상적인 피부 감각), 운동 부족, 아탁시아스, 기억력 장애, 현기증을 동반한다.진단 당시 중추신경계 밖에는 EMZL의 증거가 없었다.이를 위해 검사한 19건 중 5건에서 뇌척수액에서 악성세포가 검출됐다.[49]역사학적으로 장애의 병변은 CD19, CD20, CD79a)를 표현하는 중소형 B세포로 구성되어 있지만 CD10, CD23, 사이클린 D1 마커 단백질을 일부 플라즈마 세포와 반응성 T세포의 가변 개수가 아니라는 점에서 EMZL의 전형적인 병변이었다.[49][50]3번 염색체 삼분해 검사 건수의 50%가 양성이었다.[49]
국소성 질환의 치료는 수술, 방사선 치료 또는 두 가지 양식의 조합으로 이루어졌으며, 광범위한 중추신경계 질환의 치료는 수술 및/또는 방사선 치료를 포함하거나 포함하지 않는 화학요법으로 구성되었다.치료요법과 관계없이 1차 중추신경계 EZML은 1~86개월의 사후관리 시간 이후 질병의 증거를 가지고 생존한 환자의 77%, 22%에서 완전한 반응(CR)이 일어나며 예후가 좋다.그 병을 치료하는 데 있어 전신과 경막내 화학요법의 가치는 불분명하며 더 많은 연구가 필요하다.[49]
1차 유방
유방의 1차 EMZL(유방의 1차 MOLT 림프종이라고도 함)은 매우 희귀한 질환이다.그것은 보통 증상이 없는 환자에게서 눈에 띄는 유방 덩어리로 나타난다.[51]조직병리학적 발견은 EMZL에 대표적이다: 병변은 소-중간 B세포, 센트로시테 유사 B세포, 플라스마 세포나 단세포의 일부 특징을 가진 작은 림프세포, 그리고 CD20과 CD79a를 발현하지만 대개 CD10, CD43 또는 BCL6 마커 단백질은 발현하지 않는 이들 병변에서 림프세포와 함께 성숙한 혈장세포로 구성된다.[52]유방의 국부적 EMZL 치료에는 국소 방사선 치료를 적당량 권장한다.이 치료법은 전체 생존율이 90% 이상에 이른다.이러한 결과와 방사선 치료에 대한 EMZL의 높은 민감도를 고려할 때 유방절제술은 권장되지 않으며 국소성 질환을 치료하기 위해 넓은 절제가 일반적으로 필요하지 않다.전파된 질병을 가진 환자의 경우 치료 옵션에는 방사선 치료 및/또는 절제를 포함하거나 포함하지 않는 주의 깊은 대기 및 화학요법(일반적으로 CHOP 또는 COP와 유사한 양생법을 사용)이 포함된다.이러한 접근방식은 환자 9명 중 9명이 6~74개월 동안 지속적 질병으로 인한 사망을 107개월 동안 달성했다.이 병을 치료하는 데 사용되는 다른 약으로는 리툭시맙, 타목시펜, 옥살리플라틴 등이 있다.[51]
1차 요로
방광과 신장의 1차 요로 EMZL은 극히 드물지만 이러한 기관에서 발견되는 림프종의 가장 흔한 형태다.그것들은 만성 방광염의 이력이 있는 중년 여성들, 즉 요로 감염이나 다른 원인으로 인한 방광염에서 가장 흔히 발생한다.[19]
1차 방광
일차 방광 림프종의 증상으로는 체중 감소, 피로, 혈뇨, 이뇨, 녹뇨, 비뇨기 빈도, 복부 및/또는 수프라푸브 부위의 통증 등이 있다.[53]그러나 이 림프종은 흔히 다른 장기와 조직과 관련된 전염병으로 발생한다.[54]방사선과 방광 내시경 검사에서 방광벽에 점막 덩어리가 하나 이상 있거나 방광벽이 두꺼워지는 것을 알 수 있다.[19]이러한 병변의 조직병리학은 EMZL의 전형적인 것이다; 그것들은 작은 림프구를 포함하고 있으며, 이들 병변의 악성 세포와 함께 혈장 세포 특징을 가지고 있지만, CD5나 CD10 표식 단백질을 대표적으로 표현하지는 않는다.[53]또한 세포는 EZML의 전형적인 t(11;18) (q21:q 21) 변환을 포함할 수 있다.[54] 일차 방광 EMZL의 치료는 질병의 정도에 따라 다르다.국소성 질환은 예를 들어 양전자 방출 단층촬영(PET/CT), 골반 부위의 자기공명영상(MRI), 골수 검사를 사용하여 확인해야 한다.확인된 국소성 질환은 수술과 방사선 치료를 통해 치료되었으며, 이러한 림프종의 방사선 민감도가 높은 점을 감안할 때 방사선치료가 가장 선호되고 적절한 양식이 될 수 있다.그러나 방광종양 절제술(즉, TURT)을 통한 외과적 절제술은 다산이 우려되는 최상의 치료법이 될 수 있다.전파되고 재발하는 일차 방광 EMZL은 전신 화학요법(보통 SOP 또는 SOP + 리툭시맙 섭생법으로 치료되었다.[53]국소화 및 전파된 질병에 대한 예후는 국소화 질환을 가진 대부분의 환자에게 보고된 장기적(예: 최대 40년)의 재송부 및 전파된 질병 환자에 대한 (최대 10년)의 경우 양호하다[19].[53]
신장
신장 EMZL(즉, 신장 MALT 림프종, 신장 EMZL 또는 신장 MALT 림프종)은 주로 50세 이하의 개인에서 발생하지만, 9세 이하의 개인에게 보고되었다.보고된 사례의 절반 이상이 이 림프종을 신장에 국부화시키거나 신장 주위의 신장과 림프절에서, 다른 곳에서는 레트로페리토늄이나 복부 대동맥을 따라 검출했다.따라서 이러한 경우는 1차 신장 EMZLs로 간주될 수 있다.The remaining cases had widespread disease some of which appear related to primary salivary gland EMZL, primary orbital EMZL, Helicobactor pylori-associated gastritis, systemic lupus erythematosus, or possibly an Epstein–Barr virus-associated lymphoproliferative disease, i.e. a lymphocyte-proliferating disease related to and thought to be caused b너는 이 바이러스에 감염되었다.[55]환자는 신장 질량의 징후와 증상(예: 혈청 크레아티닌의 상승에 의해 결정되는 낮은 팩 통증 및/또는 비정상적인 신장 기능)이 나타날 수 있다.신장 EMZL에 대한 최선의 치료는 불분명하다.보고된 사례들은 신절제술 및/또는 화학요법을 받았다.[56]
1차 담낭
1차 담낭 EMZL(즉 담낭의 외측근 림프종,[57] 담낭의[58] 1차 MOLT 림프종)은 2017년 현재 문헌에 보고된 사례가 17건에 불과할 정도로 극히 희귀한 질환이다.[58]질병이 있는 개인(만 31~84세, 중위수 74세, >60%)에게 특징을 제시하는 것은 담낭의 다른 림프암과 비임파암에서 볼 수 있는 것과 유사하며,[57] 여기에는 복부 우측 상부의 통증, 메스꺼움, 구토, 그리고 약 3분의 2의 경우 담석증이 포함된다.[58]방광암의 99%를 차지하는 다른 담낭암에 비해 1차 담낭 EMZL의 1차 담낭 EMZL의 이러한 유사점뿐만 아니라 실험실에서의 유사점, 의료용 초음파, X선 소견 등을 고려할 때 1차 담낭 EMZL의 진단은 아직 수술 전에 이루어지지 않았다.오히려 외과적으로 제거된 담블래더 검사에만 그 진단이 쉬어왔다.[58]이 담낭에 있는 병변들은 림프구 사이에 있는 작은 림프구로 구성된 분비선의 하위조직에 침투하는 것을 보여준다.림프구는 EMXL에 일반적인 표식기 단백질 프로파일(예: CD20 및 Bcl-2 양성; CD5, 사이클린 D1[58] 및 CD10[57] 음성)을 가지고 있다. 담낭의 외과적 제거술은 2개월에서 96개월의 관찰 기간 동안 단 한 번의 재발을 가진 모든 환자에게서만 재발을 생성했다.[58]
일차 간염
제1차 간외 EMZL(즉, 제1차 간외선영역 B-세포 림프종, 제1차 간 점막 관련 림프 조직 림프종, 제1차 간 점막 관련 림프종)은 간 전체 제1 림프의 3%를 나타내는 극히 희귀한 악성종이다.[59]2019년 평론에서 평가한 1차 간상 EMZL은 47건만 영문학에 보고됐다.[60]이러한 검토를 바탕으로 1차 간 EMZL을 가진 개인은 동반성 간질환(주로 B형 간염이나 C형 간염, 덜 흔하게는 1차 담도 간경변이나 간세포암, 그리고 드물게 A형 간염과 같은 다른 간질환을[60] 가지고 있었다.환자(중간 연령 63세, 범위 30~85세)는 복통, 일반화된 약점, 기침, 간효소의 혈중수치 상승 및/또는 자기공명에 의해 검출된 하나 이상의 간질량에 대한 증거와 같은 증상(사례의 약 64%)이나 증상(다른 간질환과 관련이 있을 수 있음)이 전혀 없는 상태로 제시되었다.노화, 컴퓨터 단층 촬영 또는 양전자 방출 단층 촬영.[60]이러한 증상은 다른 형태의 간암에서 볼 수 있는 것과 사실상 동일하다.이에 따라 1차 간 EMZL의 진단은 수술방법에 의한 조직 획득이 없이는 극히 어렵게 되었다.[59]관련된 간조직의 조직학적 검사에서 일반적으로 중소형 비정형 림프구의 확산 침투가 나타났다.간 담즙관과 관련될 수 있는 이러한 침투에는 종종 림프구 내성 병변이 포함되어 있었다.이들 조직의 면역항진화학실험 결과 CD20과 BCL-2를 발현한 림프구가 나타났지만 CD10이나 사이클린 D1은 아니었다.이 질병에 대한 최적의 치료 전략은 확립되지 않았지만, 1차 간상 EMZL은 나태성 암으로 보인다.항암화학요법이나 리툭시맙 치료요법으로 수술적 절제술을 받았거나 받지 않고 31개월이라는 중간 기간에 걸쳐 관찰된 환자는 92%가 생존했고, 8%가 암과 관련 없거나 간접적으로 관련이 없는 원인으로 사망했으며, 11%가 재발했다.[60]
C형 간염과 관련된 EMZL
EMZL은 C형 간염에 걸린 사람에게 더 자주 발생한다(위험이 약 2.5배 증가).림프종은 일반적으로 바이러스 감염 후 15~25년(중간 시간)에 발생하며 피부(35%의 경우), 침샘(25%), 궤도 애드넥사(15%) 또는 드물게 위나 다른 조직과 관련된다.제2형 극저온증, 즉 다핵 IgG, 단핵 IgM, C형 간염 바이러스 RNA로 구성된 면역 복합체의 순환과 관련이 있다.이 면역 복합체는 10%의 경우에서 혈관염의 징후와 증상을 일으킨다.그 밖에 만성 간염과 관련된 증상과 EMZL의 특정 아형이 있다.[61] C형 간염 바이러스 감염과 관련된 EMZL은 단일 또는 복수의 부드러운 이동 피하 결절로 나타나는 경우는 드물다.[27]이 발표는 주로 여성(사례의 83%)과 노인 환자에서 이루어진다.[61]이 질환을 앓고 있는 환자들은 C형 간염의 순환성 바이러스의 검출 가능한 수준을 가지고 있을 수 있다.[39]C형 간염 바이러스 감염과 관련된 EMZL의 병변 이력은 상당수의 경우에서 t(14;18) 염색체 변환의 표현 이상으로 악성세포 장애의 유전적 이상이 잘 정의되지 않았음에도 불구하고 EMZL의[39] 대표적인 사례다.[62]이 병의 치료는 숙주의 면역체계를 동원하기 위해 페긴터론알파, 인터페론알파 같은 약물을 사용하여 바이러스를 근절하는 데 의존했었다.이 치료법은 바이러스 감염을 50% 정도 완화하고 <사례의 50%>에서 림프종 전파를 발생시켰다.최근에는 바이러스의 번식을 직접 억제하는 약물(예: 시메프레비르, 다클라타스비르, 소포스부버비르, 다사부비르)이 감염을 완화하고 각각 1년, 진행 없는 생존율이 98%, 75%인 환자의 림프종 반응을 각각 최대 100%, 73%까지 달성했다.림프종이 이 요법에 반응하지 않는 환자(약 25%의 경우)의 경우 리툭시맙 또는 리툭시맙 + 페긴터페론알파(peginterferon-alfa)가 권장된다.화학요법 요법은 간질환 환자에게는 독성이 매우 강하므로 가능한 한 C형 간염 바이러스 감염과 관련된 EMZL을 치료하는 데 있어서는 피해야 한다.[61]
비장 한계영역 림프종
비장 한계영역 림프종(SMZL)은 악성 B세포가 비장, 골수, 그리고 덜 흔하게 순환하는 저등급 림프종이다.일반적으로 나태한 질병이지만, 약 5-10%의 경우 훨씬 더 공격적인 악성종양으로 변형되어 큰 B세포 림프종을 확산시킨다.[63]SMZL은 C형 간염 바이러스에[62] 만성적으로 감염되었거나 만성 자가면역질환이나 이상 징후가 있는 개인에서 발병률이 증가하는 것으로 관찰되었다.[64]
징후 및 증상
현재 환자(중간 연령 65세, 범위 30-90세)는 일반적으로 척추의 확대(사례의 75%)를 보이고 있다.[65]그들은 일반적으로 림프절이 넓지 않지만, 허리둘레 힐 주변의 림프절은 제외한다.[66]대부분의 환자는 발열, 야근, 체중감량, 피로 등의 전신 증상이 없다.[65]혈액 검사,<>에 비정상적인 순환 IgM 골수종 단백질[65], 자기 면역 이상의 autoantibodies, autoim(및 항체가 환자 자신의 항원에 대해서 돌려진)순환 사건의 33%;과 ~20 사례%증거에는 적혈구, 혈소판, 및/또는 사건의 25%에 흰 피 세포들의 수준 감축을 보여 준다.hmune용혈성 빈혈, 면역 혈소판성 자반증,[65] 콜드 아글루틴 및/또는 항응고제 항체.[64]SMZL을 가진 개인은 또한 일반적으로 혈액순환 림프구의 수치가 증가하여 어떤 경우에는 악성 B세포로 식별될 수 있다; 이 악성 세포들은 털이 많은 세포 백혈병 환자의 혈액순환에서 발견되는 악성 B세포와 유사한 모발 모양의 돌출부를 가질 수 있다.[66]SMZL 환자도 후천 폰 윌레브랜드병, C1-에스테라제 억제제 결핍으로 인한 혈관부종,[64] 또는 C형 간염 바이러스 감염(예: 임상간염, 순환 C형 간염 바이러스)의 징후와 증상이 나타날 수 있다.SMZL과 C형 간염 바이러스 감염의 연관성은 위치에 따라 다르며, 일부 지역에서는 10%까지 높을 수 있다.[62]마지막으로, 환자의 뼈 마취를 주의 깊게 검사하면 거의 항상 주머니나 더 광범위한 악성 B세포 축적을 발견할 수 있다.[65]
병리학
SMZL과 관련된 악성 세포는 항원 경험이 있는 B세포로 잠정적으로 확인된다.이 병은 적어도 어떤 경우에는 항원이 경험하게 되는 전구 B세포의 만성적인 항원 자극에 의해 시작되는 것으로 보인다.이러한 유래에 대한 증거는 SMZL 여관 내 항원 경험 B세포가 구조적으로 제한된 면역글로불린과 B세포 수용체(클론 선택 참조)를 표현하고 있다는 것을 보여주는 연구에서 나온다.[67]게다가, SMZL을 가진 환자들은 종종 그러한 autoantibodies, 자가 면역성 용혈 빈혈, 면역 혈소판 감소 purpura,[65]저온 응집 병(및 항체 환자 자신의 항원에 대해서 돌려진), 혈액 응고 방지제 항체 순환되는 폰 Willebrand 병 얻는, angeoedem 순환하는 자기 면역성 이상하기로 했다.는 due to C1-esterase 억제제 결핍.[64]인용된 자가면역 이상에 관계된 사람들을 포함한 미확인 항원의 B세포 수용체 결합은 B세포의 증식, 장기 생존을 자극하여 단계적 유전자 이상 획득을 촉진하여 궁극적으로 항원경험 B세포가 악성화되는 것으로 생각된다.[63][67][65]이러한 악성 변형에 기여한다고 생각되는 게놈 이상에는 다음이 포함된다.
- 염색체 7(del7q로 주석이 달린)의 경우의 3040%에서 긴(즉"q")팔에 1)삭제하여 다음과 같은 Chromosome 이상에 이어질 지역의 염색체 17의 짧은(즉"p")팔에 경우의 3-17%에서[63]2)삭제(이 결실 다른 lymphomas. 따라서 하나의 지표로 삼아 SMZL를 위해 사용하는 드문 일이다)한명 두 p53그는의 느슨한.nes세포 생존을 조절하는 작용을 하는 종양 억제기를 인코딩하는 것. 3) 3번 염색체의 q 암에서 10~20%의 케이스로 증가시킨다.[65]
- 1KLF2과 같은 유전자의 돌연변이가;간접적으로 세포 생존, 확산, 자극 생화학제의 생산 NF-κB 신호 경로를 규제하는 전사 인자(사건의 21%)[63][68]2)NOTCH2(사건의 20%)[63] 세포막 단백질은 조절하는 개발의 한계 영역 B-cells에서 그들의 선도자 격인 C.ells고종양 억제 유전자는 이에 따라;[69]3)TP53(사례들 중 14%), 간접적으로, 세포 생존을 촉진하기 위해 프로그램화된 세포의 죽음 세포 증식을 조절해 주는 전사 인자, 불분명한 기능을 가지고[63]4)IGLL5(사례들 중 14%);간접적으로 NF-κB acti을 억제하기 위해 행동하는[63]5)TNFAIP3(사건의 13%), 세포 생존을 홍보하기 위해방학과프로그램된 세포 사망,[63] 그리고 6) <10% 이상의 사례에서 최소한 16개의 다른 유전자가 있다.[63]
전체적으로 NOGH, NF-164B, KLF2 신호 경로의 돌연변이는 SMZL의 병원체 발생에서 특히 중요하게 나타난다.[64]
진단
SMZL 진단에 대한 가장 명확한 증거는 비장절제술로 얻은 환자의 척추 검사에 의해 얻어진다.이 스프렌들은 특징적으로 림프액이 흰 펄프에 침투하고, 보다 작고 가변적인 범위까지 빨강 펄프를 보여준다.이러한 침투는 작은 림프구, 한계영역 B세포, 센트로블라스틱 B세포, 단모세포 같은 B세포, 플라즈마세포로 이루어져 있다.상피세포와 같은 조직세포는 붉은 펄프에서 발견될 수 있다.비장성 유사 림프절은 작은 림프구에 결절형 침투가 나타날 수 있다.환자의 골수에 대한 세심하고 철저한 검사를 통해 흔히 기관과 기관 사이에 있는 림프세포의 골격을 알 수 있다.신소성 B세포는 환자의 혈액에서도 순환할 수 있다.이 모든 조직에서 신소성 세포는 외부와 노달 MZL의 신소성 세포, CD20, CD27 및 BCL2와 유사하지만 CD10, CD23, CD5, CD43, CD38, CCL6, 사이클린 D1 또는 A1 표식 단백질에 부속되지 않는다.또한 이 세포들은 병리학 섹션에 열거된 돌연변이 유전자의 30-40%의[65] 사례와 낮은 비율의 사례에서 델7q 삭제(즉 7번 염색체의 q 암 삭제)를 나타낼 수 있다.반면 SMZL의 진단 초기에 비장 조직의 시험에 근거한다고 현재 진단 대부분의 경우에서 환자의 골수 및/또는 혈액의 종양 비세포를 단백질 또는 유전자 이상 위에서 언급의 모습을 감지하고 시험 및 임상 결과에;[65] 하지만, 경우 출신의. 어렵게 만들다.agnose 골수 및 혈액 소견에 기초하여 SMZL의 최종 진단을 얻기 위해서는 비장의 검사가 필요하다.[66]
치료
그 희귀성을 고려할 때 SMZL의 치료에 대한 체계적이고 통제된 연구는 없었다. 이에 대한 현재 권고사항은 다음과 같다.질병 진행을 감지하기 위해 3~6개월마다 추적검사를 실시하면서 특정 치료를 보류하는 주의사항 대기.이 과정은 증상이 없거나 진행성이 없거나 서서히 진행되는 질환이 있는 SMZL 환자의 약 33%에게 권장된다.이러한 환자들은 장기간 치료적 개입을 요구하지 않을 수 있다.역사적으로 급속도로 진행 중인 질병을 가진 환자들을 위한 초기 치료법은 비장절제술이었다.이들 환자의 약 90%는 증상 감소와 낮은 적혈구, 혈소판, 백혈구 수치가 개선된 것으로 나타났다; 그들은 중간 진행 없는, 전체적으로 5년, 그리고 각각 8.2년, 84%, 67%의 10년 생존율을 보였다.그러나 이러한 환자들은 혈액 내 신소성 B세포 수치에 변화가 없고 비장절제술(예: 혈전증, 감염)으로 인한 심각한 합병증을 겪었으며, 다른 치료 전략을 통해 얻은 것보다 전반적인 생존율을 더 잘 바꾸지 않았다.따라서 SMZL에 대한 비장절제술은 경증 골수 관여 환자에서 현저하게 증후성 확대된 스플렌의 사례로 제한되었고 부피가 큰 림프절 확대가 없었다.[66]
증상이 있거나 빠르게 진행 중인 SMZL 환자에 대한 현재 치료 권장사항은 약물에 의존한다.B세포의 CD20 단백질을 대상으로 하는 단핵항체를 상업적으로 조제하는 리툭시맙은 SMZL에서 크게 활발히 활동하며, 단기치료(예: ~ 4주)가 전체 반응률 90~100%, 완전완료율 50%, 7년 진행무존률 69%를 달성하고 있다.리툭시맙을 이용한 장기 유지 치료는 이러한 결과를 개선하는 것으로 나타나고 리툭시맙 치료 후 재발하는 환자들은 일반적으로 두 번째 약물에 반응한다.Prior to rituximab availability, single drug chemotherapy (e.g. chlorambucil, cyclophosphamide, fludarabine, pentostatin, 2CDA, or bendamustine) and multiple drug regimens (i.e. the CVP regimen of cyclophosphamide, vincristine, and prednisone, or the CHOP regimen of CVP plus doxorubicin) were used to treat the disease.그러나 현재 연구에서는 이러한 화학요법 요법이 반응률뿐만 아니라 반응률과 반응 기간 면에서 단일 에이전트 리툭시맙 요법보다 우수하지 않다는 것을 보여주고 있다.[66]리투시맵과 렘다무스틴을 혼합한 SMZL의 치료는 3년 이상 지속되는 비율 응답률, 진행 없는 생존율, 전체 생존율 93%, 90%, 96%로 각각 전체 응답과 완전 응답률을 각각 91%, 73% 달성하는 것으로 임상 2상 연구결과 밝혀졌다.이 실험의 결과는 확인을 요하는 한편, 이 2가지 약물을 리툭시맙, 인용된 화학요법 또는 리툭시맙과 더불어 증상/진행성 SMZL 환자들에게 인용된 화학요법요법 대신 사용할 것을 강력히 시사한다.[70]
전문가들은 C형 간염 바이러스 감염증도 있는 SMZL 환자는 첫 번째 라인으로 바이러스를 제거하는 작용을 하는 약물로 치료해야 한다고 권고하고 있다.직접 작용하는 항바이러스제가 개발되기 전, 여러 연구에서 이들 환자에 대한 IFN-α 치료는 바이러스 감염뿐만 아니라 림프종에서 재출혈(사례의 약 65%)도 개선되었다고 보고되었다.[66]그라조프레비르, 다클라타스비르, 소포스부비르, 다사부비르와 같은 몇몇 새로운 직접적으로 작용하는 항바이러스제는 C형 간염 바이러스[61] 감염을 치료하는데 더 효과적이며, 일부 환자들에서는 SMZL+C형 간염 바이러스 감염을 가진 환자들에게 림프종 재전송을 더 효과적으로 만들어내거나 더 효과적일 것으로 기대되고 있다.[61][66]
예후
SMZL은 일반적으로 10년 생존율이 42-95%[65]인 나태한 과정을 따른다.이들 사망자의 약 3분의 1은 SMZL과 무관하며, 이 중 5~10명은 SMZL 질병이 대형 C세포 림프종을 확산시키기 위해 변형되었기 때문이다.[66]
노달 한계대 림프종
이전에 단모세포 B세포 림프종, 단모세포 B세포 림프종, 단모세포 B세포 림프종, 단모세포 B세포가 있든 없든 간에 악성 림프구 림프종을 가진 조직이 침투한 것으로, 모든 한계지역 림프종의 형태학적·표현학적 특징을 가지고 있다.[71]NMZL은 다른 조직과 장기가 아닌 림프절의 일차적 관여에 의해 한계영역 림프종의 다른 하위 유형과 다르다.[72]NMZL은 3개의 한계영역 림프종 중 가장 흔하지 않은 하위 유형이다.[73]
징후 및 증상
목, 사타구니, 복부 및 흉부 부위에 림프절이 불규칙하게 확대된 NMZL 환자 거의 모든 경우(중간 연령 50~64세,[71] 남성에서 여성 비율 1.5~1[73])가 존재한다.[71] 일부 환자도 월더의 편도선 링에 이러한 관여를 보일 수 있다.[74]프리젠테이션 환자들은 일반적으로 완전하게 기능하지만, 10-20%의 경우 발열, 야간 땀, 체중 감소, 피로 등의 B 증상을 호소한다.[74] 증상을 호소한다.실험실 연구 결과 환자의 33%는 악성 B[세포가 골수에 침투하고 20%는 이상 IgM 골수종 단백질이 있는 것으로 나타났다.드물게 환자가 순환하는 악성 한계 영역 B 세포 및/또는 하나 이상의 순환하는 정상 혈구 유형의 감소를 나타낼 수 있다.[71]관련 조직의 조직 조직 검사(예:[74] 림프절의 모낭 사이를 중심으로 림프절 전체에 확산 및/또는 림프절 전체에 퍼져 있는 결절) 림프구 침투.이러한 패턴은 EMZL MOTL 림프종에서 볼 수 있는 것과 유사하다.[73]이러한 침투 광석의 세포는 다양한 비율로 작은 림프구, 한계영역 같은 B세포, 구심성 세포와 같은 세포, 단세포와 같은 세포, 혈장 세포와 같은 세포, 그리고 20%의 경우 큰 블라스틱 B세포가 있다.이러한 침투에서 악성 B세포는 다른 한계지역 림프종의 세포와 마찬가지로 CD20, CD19, CD79 및 Bcl2를 일반적으로 표현하는 한계지역 B세포와 같지만 CD10, CD5, CD23, 사이클린 D1은 아니다.[citation needed]
병리학
NMZL 환자 중 약 6~19%가 류마티스 관절염, 쇠그렌 증후군, 자가면역 용혈성 빈혈, 만성 갑상선염 등 자가면역질환과 관련이 있는 것으로 보고됐다.그러나 이러한 질병들이 NMZL의 발전에 기여한다는 증거는 거의 없다.[74] 더욱이 이전의 연구에서 발견된 C형 간염 바이러스 감염과 NMZL의 연관성은 더 최근의 연구에서 확인되지 않았다.[73]따라서 외경 및 비장성 한계 구역 림프구 촉진에 만성 면역 자극의 가정된 역할은 NMZL에 명확하게 입증되지 않았으며, NMZL에는 적용되지 않을 수 있다. NMZL: 이 질병의 발생에 대한 근본적인 초기 원인이 현재 불분명하다.그럼에도 불구하고, NMZL에서 B세포들을 선동하는 것은 그들의 악성 변형에 기여한다고 생각되는 유전적 이상을 획득한다.[citation needed]이러한 유전적 이상에는 다음과 같은 것들이 포함된다.
- 염색체 18(사건의 ~50%)NFATC1[71]의 단백질 제품 세포 proliferati을 홍보하기 위해 행동할 수 있는 overexpression의 염색체 3의 FOXP1, NFKBIZ, BCL6의 단백질 제품의 세포 확산과 생존을 촉진하는 overexpression을 일으킨다 1)그리고(사건의 24%)과 같은 염색체 이상,[71]2)그리고.신규에Urvival,[75]3) 드물게, 염색체의 염색체 7과 12및 삭제의 긴 팔의 염색체 6이 아직 알려지지 않은 기능적 영향,[71], 4)염색체 전좌 사이의 짧은(즉"p")팔의 염색체 2시 위치 24일과 긴(즉"q")팔의 염색체 14살에 위치 32, 전좌의 아직 알려지지 않은 재미 있다.ctional다른 한계 영역 림프종에서는 발견되지 않지만 결과는 NMZL의 진단 마커로 유용하다.[76]
- 1)NOTCH2(경우의 25%)[63]는 그리고 지하실 생존을 조절할 동작하는 종양 억제 유전자는 그들의 전구 세포로부터 갓번짐 B-cells의 발전을 조절해 주는 막 단백질과 같은 유전자의 돌연변이가;[69]2)TNFAIP3(사건의 5-15%)의 제품이 deubiquitinating 효소가 기능이 NF-κB transcri을 억제하기 위하여.ption faCtor고 하며 세포 활성화, 확산, 생존을 조절하는 NF-κB 신호 경로,[67]3)BIRC3, 이는 기능 세포 죽음 세포로 인한를 규제하는cIAP2 단백질을 암호화하고,[67]3-1단백질 제품 간접적으로;NF-κB 세포 신호 경로의 활성화를 규제하 MYD88(사건의 0-10%)[67]4)KLF2 wh.제품ose간접적인 그 NF-κB 세포 신호 경로를 조절한다는 단백질은 전사 인자;[67]5)PTPRD의 제품 단백질이 수용체로는 티로신 인산 가수 분해 효소 있는 종양 억제 유전자 및 간접적으로 규정하고 여러 방식 신호용 프로그램을 규제하고 세포 확산과 반응에 생화학제,[67], 5)에 ~40%의 환자가 또는 모의va의 레MLL2, SIN3A, ARID1A, EP300, CREBBP, TBL1XR1)과 같이 광범위한 다른 유전자의 발현을 조절하기 위해 염색질 리모델링 활동을 하는 다른 유전자들.[67]
진단
NMZL의 진단은 림프절에서 신소성 B-세포의 식별과 경우에 따라 달라지며, 일부의 경우 골수는 적어도 초기 질환에서는 그렇지 않으며, 다른 장기에서는 그렇지 않다.이러한 신소성 세포는 한계영역 림프구에 공통되는 표식 단백질(이전 섹션 참조)과 대부분의 경우 병태생리학 섹션에 표시된 하나 이상의 유전적 이상을 표현해야 한다.[71]
치료
NMZL에 대한 권장 치료법은 질병 상태에 따라 다르다.무증상 NMZL은 질병 진행 상태를 점검하기 위해 정기적인 후속 검사(예: 3~6개월)와 함께 주의 깊은 대기 상태를 사용할 수 있다.그러나 국소성 질환은 무증상 환자에서도 수술에 이어 국소방사선치료까지 연속적으로 치료되고 있다.국부적 단계를 지나 전파되어 급속하게 진행성 질환 및 증상성 질환으로 이동하는 질병은 단일 화학요법 약물(예: 클래드리빈, 루다라빈, 클로로암부실 또는 벤다무스틴), 단일 면역요법 약물(예: 리툭시맙), 다중 약물 화학요법 요법(예: COP) 또는 복합 멀티로 치료되었다.iple 화학요법 약물과 면역요법 약품요법(즉, CHOP + 리툭시맙).이러한 식습관 중 하나 이상의 식습관이 다른 식습관보다 우수하다는 것은 확실하지 않다.[73]
예후
NMZL은 치료가 불가능하지만 비교적 나태한 질환으로 천천히 진행되며 재발하는 과정을 밟는다.그것의 예후 약간 그 사람들의 15%좀 더 공격적인 림프종, 미만성 큰 B세포 림프종에~4.5년의 NMZL.[73]의 다른 연구에서 진단 후 평균 시간으로 진행되고와 비장extranodal 갓번짐 lymphomas[71]에서 보기 때문에 더 나타나면, 병을 가진 사람들 62-90%5년 생존율을 가지고 있다..[73]
아이들.
어린이의 경우 NMZL은 세계보건기구(2016년)에 의해 발표 내용, 관련 림프절의 역사학, 임상 과정 등을 바탕으로 NMZL의 별도 변종으로 분류되어 왔다.[73]공표된 60개 사례 중 소아 NMZL 사례의 95%는 머리와 목 부위의 림프절 확대가 수반되는 무증상 국소화(I/II단계) 질환으로 나타나는 사춘기 소년에서 발생했다.이 사례들은 자가면역이나 병원체 유도 염증성 질환과의 연관성을 전혀 보이지 않았다.이 모든 발견은 어린이들에게서 발생하는 외적 한계영역 림프구에서 볼 수 있는 것과 대조적이다.역사학적으로 관련 림프절은 보통 CD20과 CD43을 발현하는 림프세포에 의해 고통받는 림프절의 생식선 중심부에 침투하는 것을 보여주며, Bcl2를 발현하는 경우가 많으며(사례의 약 50%) 보통 CD10이나 BCL6를 발현하지 않는다.이러한 침투에서 한계 영역 B세포는 성인의 NMZL에 비해 유전학적 이상이 상대적으로 적다.18번 염색체의 삼위일체는 21%의 사례에서 보고되었고, 드물게 3번 염색체의 삼위일체가 보고되었다.이들 세포에서 재발한 유전자 돌연변이는 보고되지 않았다.[77]소아 NMZL의 과정은 재발률이 낮고 일반적으로 우수한 결과를 가진 질병으로 인해 극도로 나태하다.[73]최대 12~18년의 관찰 기간을 통해 환자의 전반적인 생존율은 100%이고 재발률은 최대 4%[77]인 것으로 나타났다.소아 NMZL 치료는 주의력 있는 대기 전략, 리툭시맙, 화학 요법 및/또는 국소 방사선 요법을 사용해 왔다.주의력 있는 대기 전략은 다른 치료법들뿐만 아니라 잘 해왔기 때문에 이 병의 초기 치료법이 권장된다.[77]
최근 연구
MZL 임상시험에서는 B세포 수용체(인접 그림 참조) 신호차단기, 아이브루모맵티오세탄(제블린) 등 다양한 신약이 시험되고 있다.[78]이러한 실험은 연구 중인 약물의 복용량과 안전성을 결정하는 데 중요하다.2017년 1월 19일자로 FDA는 사상 최초로 MZL 표적 의약품인 ibrutinib을 승인했다.[79]이 약은 생존을 위해 핵에 신호를 보낼 수 있는 브루턴의 티로신키나아제(BKT)를 억제해 효과가 있다.즉, B세포의 성장을 늦춘다는 것이다.[79]기존에 이 박테리아와 함께 서식하던 동물의 뱃속에서 헬리코박터균의 수를 크게 줄여주는 백신이 개발됐다.이들 백신 중 하나 이상이 농장과 가축을 기르는 동물뿐만 아니라 사람의 헬리코박터균 감염을 통제할 수 있는 유망한 후보일 수 있다.[80]
참조
- ^ a b c d e f g Bron D, Meuleman N (September 2019). "Marginal zone lymphomas: second most common lymphomas in older patients". Current Opinion in Oncology. 31 (5): 386–393. doi:10.1097/CCO.0000000000000554. PMID 31246587.
- ^ a b Thieblemont C, Zucca E (2017). "Clinical aspects and therapy of gastrointestinal MALT lymphoma". Best Practice & Research. Clinical Haematology. 30 (1–2): 109–117. doi:10.1016/j.beha.2017.01.002. PMID 28288705.
- ^ a b c Sriskandarajah P, Dearden CE (2017). "Epidemiology and environmental aspects of marginal zone lymphomas". Best Practice & Research. Clinical Haematology. 30 (1–2): 84–91. doi:10.1016/j.beha.2016.07.002. PMID 28288721.
- ^ Swerdlow SH, Campo E, Pileri SA, Harris NL, Stein H, Siebert R, Advani R, Ghielmini M, Salles GA, Zelenetz AD, Jaffe ES (May 2016). "The 2016 revision of the World Health Organization classification of lymphoid neoplasms". Blood. 127 (20): 2375–90. doi:10.1182/blood-2016-01-643569. PMC 4874220. PMID 26980727.
- ^ Cheah CY, Opat S, Trotman J, Marlton P (February 2019). "Front-line management of indolent non-Hodgkin lymphoma in Australia. Part 2: mantle cell lymphoma and marginal zone lymphoma". Internal Medicine Journal. 49 (9): 1070–1080. doi:10.1111/imj.14268. PMID 30816618.
- ^ a b Casulo C, Friedberg J (2017). "Transformation of marginal zone lymphoma (and association with other lymphomas)". Best Practice & Research. Clinical Haematology. 30 (1–2): 131–138. doi:10.1016/j.beha.2016.08.029. PMID 28288708.
- ^ a b c d e f g h i j k l m n Smedby KE, Ponzoni M (November 2017). "The aetiology of B-cell lymphoid malignancies with a focus on chronic inflammation and infections". Journal of Internal Medicine. 282 (5): 360–370. doi:10.1111/joim.12684. PMID 28875507.
- ^ a b c Nocturne G, Pontarini E, Bombardieri M, Mariette X (March 2019). "Lymphomas complicating primary Sjögren's syndrome: from autoimmunity to lymphoma". Rheumatology (Oxford, England). doi:10.1093/rheumatology/kez052. PMC 8328496. PMID 30838413.
- ^ a b c d Abbas H, Niazi M, Makker J (May 2017). "Mucosa-Associated Lymphoid Tissue (MALT) Lymphoma of the Colon: A Case Report and a Literature Review". The American Journal of Case Reports. 18: 491–497. doi:10.12659/AJCR.902843. PMC 5424574. PMID 28469125.
- ^ Bracci PM, Benavente Y, Turner JJ, Paltiel O, Slager SL, Vajdic CM, Norman AD, Cerhan JR, Chiu BC, Becker N, Cocco P, Dogan A, Nieters A, Holly EA, Kane EV, Smedby KE, Maynadié M, Spinelli JJ, Roman E, Glimelius B, Wang SS, Sampson JN, Morton LM, de Sanjosé S (August 2014). "Medical history, lifestyle, family history, and occupational risk factors for marginal zone lymphoma: the InterLymph Non-Hodgkin Lymphoma Subtypes Project". Journal of the National Cancer Institute. Monographs. 2014 (48): 52–65. doi:10.1093/jncimonographs/lgu011. PMC 4207869. PMID 25174026.
- ^ Bertoni F, Rossi D, Zucca E (2018). "Recent advances in understanding the biology of marginal zone lymphoma". F1000Research. 7: 406. doi:10.12688/f1000research.13826.1. PMC 5874504. PMID 29657712.
- ^ a b Du MQ (2017). "MALT lymphoma: Genetic abnormalities, immunological stimulation and molecular mechanism". Best Practice & Research. Clinical Haematology. 30 (1–2): 13–23. doi:10.1016/j.beha.2016.09.002. PMID 28288707.
- ^ Arruga F, Vaisitti T, Deaglio S (2018). "The NOTCH Pathway and Its Mutations in Mature B Cell Malignancies". Frontiers in Oncology. 8: 550. doi:10.3389/fonc.2018.00550. PMC 6275466. PMID 30534535.
- ^ a b c d e f g h i Schreuder MI, van den Brand M, Hebeda KM, Groenen PJ, van Krieken JH, Scheijen B (December 2017). "Novel developments in the pathogenesis and diagnosis of extranodal marginal zone lymphoma". Journal of Hematopathology. 10 (3–4): 91–107. doi:10.1007/s12308-017-0302-2. PMC 5712330. PMID 29225710.
- ^ a b c d e f Violeta Filip P, Cuciureanu D, Sorina Diaconu L, Maria Vladareanu A, Silvia Pop C (2018). "MALT lymphoma: epidemiology, clinical diagnosis and treatment". Journal of Medicine and Life. 11 (3): 187–193. doi:10.25122/jml-2018-0035. PMC 6197515. PMID 30364585.
- ^ a b c Bento-Miranda M, Figueiredo C (December 2014). "Helicobacter heilmannii sensu lato: an overview of the infection in humans". World Journal of Gastroenterology. 20 (47): 17779–87. doi:10.3748/wjg.v20.i47.17779. PMC 4273128. PMID 25548476.
- ^ a b c d e f g h i j k l m n Teixeira Mendes LS, Wotherspoon A (2017). "Marginal zone lymphoma: Associated autoimmunity and auto-immune disorders". Best Practice & Research. Clinical Haematology. 30 (1–2): 65–76. doi:10.1016/j.beha.2016.07.006. PMID 28288719.
- ^ a b c d e Ponzoni M, Ferreri AJ (2017). "Bacteria associated with marginal zone lymphomas". Best Practice & Research. Clinical Haematology. 30 (1–2): 32–40. doi:10.1016/j.beha.2017.01.001. PMID 28288714.
- ^ a b c d e f g Matutes E, Montalban C (2017). "Clinical features and management of non-gastrointestinal non-ocular extranodal mucosa associated lymphoid tissue (ENMALT) marginal zone lymphomas". Best Practice & Research. Clinical Haematology. 30 (1–2): 99–108. doi:10.1016/j.beha.2016.07.005. PMID 28288723.
- ^ Sammassimo S, Pruneri G, Andreola G, Montoro J, Steffanoni S, Nowakowski GS, Gandini S, Negri M, Habermann TM, Raderer M, Li ZM, Zinzani PL, Adam P, Zucca E, Martinelli G (December 2016). "A retrospective international study on primary extranodal marginal zone lymphoma of the lung (BALT lymphoma) on behalf of International Extranodal Lymphoma Study Group (IELSG)". Hematological Oncology. 34 (4): 177–183. doi:10.1002/hon.2243. PMID 26152851.
- ^ a b Pileri S, Ponzoni M (2017). "Pathology of nodal marginal zone lymphomas". Best Practice & Research. Clinical Haematology. 30 (1–2): 50–55. doi:10.1016/j.beha.2016.11.001. PMID 28288717.
- ^ a b c Olszewska-Szopa M, Wróbel T (August 2019). "Gastrointestinal non-Hodgkin lymphomas". Advances in Clinical and Experimental Medicine. 28 (8): 1119–1124. doi:10.17219/acem/94068. PMID 31414733.
- ^ Dou W, Li J, Xu L, Zhu J, Hu K, Sui Z, Wang J, Xu L, Wang S, Yin G (September 2016). "Halitosis and helicobacter pylori infection: A meta-analysis". Medicine. 95 (39): e4223. doi:10.1097/MD.0000000000004223. PMC 5265885. PMID 27684792.
- ^ Diaconu S, Predescu A, Moldoveanu A, Pop CS, Fierbințeanu-Braticevici C (2017). "Helicobacter pylori infection: old and new". Journal of Medicine and Life. 10 (2): 112–117. PMC 5467250. PMID 28616085.
- ^ Strand DS, Kim D, Peura DA (January 2017). "25 Years of Proton Pump Inhibitors: A Comprehensive Review". Gut and Liver. 11 (1): 27–37. doi:10.5009/gnl15502. PMC 5221858. PMID 27840364.
- ^ a b c d e f g h Bianchi G, Sohani AR (January 2018). "Heavy Chain Disease of the Small Bowel". Current Gastroenterology Reports. 20 (1): 3. doi:10.1007/s11894-018-0608-y. PMID 29372346.
- ^ a b Zucca E, Bertoni F (April 2016). "The spectrum of MALT lymphoma at different sites: biological and therapeutic relevance". Blood. 127 (17): 2082–92. doi:10.1182/blood-2015-12-624304. PMID 26989205.
- ^ Won JH, Kim SM, Kim JW, Park JH, Kim JY (2019). "Clinical features, treatment and outcomes of colorectal mucosa-associated lymphoid tissue (MALT) lymphoma: literature reviews published in English between 1993 and 2017". Cancer Management and Research. 11: 8577–8587. doi:10.2147/CMAR.S214197. PMC 6759223. PMID 31572011.
- ^ Takenaka R, Tomoda J, Sakata T, Ichiba T, Motoi M, Mizuno M, Tsuji T (March 2000). "Mucosa-associated lymphoid tissue lymphoma of the rectum that regressed spontaneously". Journal of Gastroenterology and Hepatology. 15 (3): 331–5. doi:10.1046/j.1440-1746.2000.02086.x. PMID 10764039.
- ^ a b c Kobayashi T, Takahashi N, Hagiwara Y, Tamaru J, Kayano H, Jin-nai I, Bessho M, Niitsu N (January 2008). "Successful radiotherapy in a patient with primary rectal mucosa-associated lymphoid tissue lymphoma without the API2-MALT1 fusion gene: a case report and review of the literature". Leukemia Research. 32 (1): 173–5. doi:10.1016/j.leukres.2007.04.017. PMID 17570523.
- ^ a b c Ma Q, Zhang C, Fang S, Zhong P, Zhu X, Lin L, Xiao H (March 2017). "Primary esophageal mucosa-associated lymphoid tissue lymphoma: A case report and review of literature". Medicine. 96 (13): e6478. doi:10.1097/MD.0000000000006478. PMC 5380272. PMID 28353588.
- ^ Tabibian JH, Kalani A, Moran AM, Panganamamula K (January 2019). "Extranodal Marginal Zone B Cell (MALT) Lymphoma of the Esophagus". Journal of Gastrointestinal Cancer. 50 (4): 1034–1036. doi:10.1007/s12029-018-00187-5. PMID 30618000.
- ^ Takeuchi Y, Miyahara K, Morito T, Okikawa Y, Kinugasa H, Moritou Y, Higashi R, Kunihiro M, Nakagawa M (January 2019). "The Progression of Esophageal Mucosa-associated Lymphoid Tissue Lymphoma after Helicobacter pylori Eradication Therapy: A Case Report and Discussion of Therapeutic Options". Internal Medicine (Tokyo, Japan). 58 (2): 207–212. doi:10.2169/internalmedicine.1112-18. PMC 6378146. PMID 30146577.
- ^ a b c d e f Sassone M, Ponzoni M, Ferreri AJ (2017). "Ocular adnexal marginal zone lymphoma: Clinical presentation, pathogenesis, diagnosis, prognosis, and treatment". Best Practice & Research. Clinical Haematology. 30 (1–2): 118–130. doi:10.1016/j.beha.2016.11.002. PMID 28288706.
- ^ Tanenbaum RE, Galor A, Dubovy SR, Karp CL (2019). "Classification, diagnosis, and management of conjunctival lymphoma". Eye and Vision. 6: 22. doi:10.1186/s40662-019-0146-1. PMC 6660942. PMID 31372366.
- ^ a b c Guffey Johnson J, Terpak LA, Margo CE, Setoodeh R (April 2016). "Extranodal Marginal Zone B-cell Lymphoma of the Ocular Adnexa". Cancer Control : Journal of the Moffitt Cancer Center. 23 (2): 140–9. doi:10.1177/107327481602300208. PMID 27218791.
- ^ Kempf W, Zimmermann AK, Mitteldorf C (June 2019). "Cutaneous lymphomas-An update 2019". Hematological Oncology. 37 Suppl 1: 43–47. doi:10.1002/hon.2584. PMID 31187534.
- ^ a b Wilcox RA (November 2018). "Cutaneous B-cell lymphomas: 2019 update on diagnosis, risk stratification, and management". American Journal of Hematology. 93 (11): 1427–1430. doi:10.1002/ajh.25224. hdl:2027.42/109952. PMID 30039522.
- ^ a b c Ferreri AJ, Govi S, Ponzoni M (December 2013). "Marginal zone lymphomas and infectious agents". Seminars in Cancer Biology. 23 (6): 431–40. doi:10.1016/j.semcancer.2013.09.004. PMID 24090976.
- ^ a b Ponzoni M, Ferreri AJ, Mappa S, Pasini E, Govi S, Facchetti F, Fanoni D, Tucci A, Vino A, Doglioni C, Berti E, Dolcetti R (2011). "Prevalence of Borrelia burgdorferi infection in a series of 98 primary cutaneous lymphomas". The Oncologist. 16 (11): 1582–8. doi:10.1634/theoncologist.2011-0108. PMC 3233293. PMID 22071292.
- ^ a b c d e Borie R, Wislez M, Antoine M, Cadranel J (2017). "Lymphoproliferative Disorders of the Lung". Respiration; International Review of Thoracic Diseases. 94 (2): 157–175. doi:10.1159/000477740. PMID 28609772.
- ^ Defrancesco I, Arcaini L (March 2018). "Overview on the management of non-gastric MALT lymphomas". Best Practice & Research. Clinical Haematology. 31 (1): 57–64. doi:10.1016/j.beha.2017.11.001. PMID 29452667.
- ^ Ahmed R, Al-Shaikh S, Akhtar M (May 2012). "Hashimoto thyroiditis: a century later". Advances in Anatomic Pathology. 19 (3): 181–6. doi:10.1097/PAP.0b013e3182534868. PMID 22498583.
- ^ a b c d Stein SA, Wartofsky L (August 2013). "Primary thyroid lymphoma: a clinical review". The Journal of Clinical Endocrinology and Metabolism. 98 (8): 3131–8. doi:10.1210/jc.2013-1428. PMID 23714679.
- ^ Watanabe N, Narimatsu H, Noh JY, Iwaku K, Kunii Y, Suzuki N, Ohye H, Suzuki M, Matsumoto M, Yoshihara A, Kameyama K, Kobayashi K, Kami M, Sugino K, Ito K (February 2018). "Long-Term Outcomes of 107 Cases of Primary Thyroid Mucosa-Associated Lymphoid Tissue Lymphoma at a Single Medical Institution in Japan". The Journal of Clinical Endocrinology and Metabolism. 103 (2): 732–739. doi:10.1210/jc.2017-01478. PMID 29165612.
- ^ Peixoto R, Correia Pinto J, Soares V, Koch P, Taveira Gomes A (January 2017). "Primary thyroid lymphoma: A case report and review of the literature". Annals of Medicine and Surgery (2012). 13: 29–33. doi:10.1016/j.amsu.2016.12.023. PMC 5199157. PMID 28053701.
- ^ Kleinstern G, Averbuch M, Abu Seir R, Perlman R, Ben Yehuda D, Paltiel O (April 2018). "Presence of autoimmune disease affects not only risk but also survival in patients with B-cell non-Hodgkin lymphoma". Hematological Oncology. 36 (2): 457–462. doi:10.1002/hon.2498. PMID 29469175.
- ^ a b Dasanu CA, Bockorny B, Grabska J, Codreanu I (April 2015). "Prevalence and Pattern of Autoimmune Conditions in Patients with Marginal Zone Lymphoma: A Single Institution Experience". Connecticut Medicine. 79 (4): 197–200. PMID 26259295.
- ^ a b c d Ayanambakkam A, Ibrahimi S, Bilal K, Cherry MA (January 2018). "Extranodal Marginal Zone Lymphoma of the Central Nervous System". Clinical Lymphoma, Myeloma & Leukemia. 18 (1): 34–37.e8. doi:10.1016/j.clml.2017.09.012. PMID 29103980.
- ^ Razaq W, Goel A, Amin A, Grossbard ML (June 2009). "Primary central nervous system mucosa-associated lymphoid tissue lymphoma: case report and literature review". Clinical Lymphoma & Myeloma. 9 (3): E5–9. doi:10.3816/CLM.2009.n.052. PMID 19525185.
- ^ a b Hissourou Iii M, Zia SY, Alqatari M, Strauchen J, Bakst RL (2016). "Primary MALT Lymphoma of the Breast Treated with Definitive Radiation". Case Reports in Hematology. 2016: 1831792. doi:10.1155/2016/1831792. PMC 4877461. PMID 27247809.
- ^ Liguori G, Cantile M, Cerrone M, La Mantia E, Di Bonito M, Zanconati F, Curcio MP, Aquino G, La Mura A, Giannatiempo R, De Chiara A, Lombardi A, Botti G, D'Antonio A, Caraglia M, Franco R (October 2012). "Breast MALT lymphomas: a clinicopathological and cytogenetic study of 9 cases". Oncology Reports. 28 (4): 1211–6. doi:10.3892/or.2012.1942. PMID 22842723.
- ^ a b c d Vempati P, Knoll MA, Alqatari M, Strauchen J, Malone AK, Bakst RL (2015). "MALT Lymphoma of the Bladder: A Case Report and Review of the Literature". Case Reports in Hematology. 2015: 934374. doi:10.1155/2015/934374. PMC 4568333. PMID 26417464.
- ^ a b Venyo AK (2014). "Lymphoma of the urinary bladder". Advances in Urology. 2014: 327917. doi:10.1155/2014/327917. PMC 3912819. PMID 24511310.
- ^ Garcia M, Konoplev S, Morosan C, Abruzzo LV, Bueso-Ramos CE, Medeiros LJ (September 2007). "MALT lymphoma involving the kidney: a report of 10 cases and review of the literature". American Journal of Clinical Pathology. 128 (3): 464–73. doi:10.1309/0T2UKUKV91W3QR6W. PMID 17709321.
- ^ Makino T, Miwa S, Koshida K, Kawashima A (April 2016). "Mucosa-associated lymphoid tissue lymphoma involving the kidney: a case report and review of the literature". International Cancer Conference Journal. 5 (2): 82–89. doi:10.1007/s13691-015-0234-6. PMC 6498318. PMID 31149432.
- ^ a b c Mani H, Climent F, Colomo L, Pittaluga S, Raffeld M, Jaffe ES (September 2010). "Gall bladder and extrahepatic bile duct lymphomas: clinicopathological observations and biological implications". The American Journal of Surgical Pathology. 34 (9): 1277–86. doi:10.1097/PAS.0b013e3181e9bb8b. PMC 2929270. PMID 20679881.
- ^ a b c d e f Honda M, Furuta Y, Naoe H, Sasaki Y (May 2017). "Primary mucosa-associated lymphoid tissue (MALT) lymphoma of the gallbladder and review of the literature". BMJ Case Reports. 2017: bcr-2017-220161. doi:10.1136/bcr-2017-220161. PMC 5747624. PMID 28551602.
- ^ a b Bohlok A, De Grez T, Bouazza F, De Wind R, El-Khoury M, Repullo D, Donckier V (2018). "Primary Hepatic Lymphoma Mimicking a Hepatocellular Carcinoma in a Cirrhotic Patient: Case Report and Systematic Review of the Literature". Case Reports in Surgery. 2018: 9183717. doi:10.1155/2018/9183717. PMC 5914115. PMID 29850362.
- ^ a b c d Xie H, Lv J, Ji Y, Du X, Yang X (March 2019). "Primary hepatic mucosa-associated lymphoid tissue lymphoma: A case report and literature review". Medicine. 98 (13): e15034. doi:10.1097/MD.0000000000015034. PMC 6456129. PMID 30921228.
- ^ a b c d e Armand M, Besson C, Hermine O, Davi F (2017). "Hepatitis C virus - Associated marginal zone lymphoma". Best Practice & Research. Clinical Haematology. 30 (1–2): 41–49. doi:10.1016/j.beha.2017.02.001. PMID 28288715.
- ^ a b c Mihăilă RG (July 2016). "Hepatitis C virus - associated B cell non-Hodgkin's lymphoma". World Journal of Gastroenterology. 22 (27): 6214–23. doi:10.3748/wjg.v22.i27.6214. PMC 4945980. PMID 27468211.
- ^ a b c d e f g h i j Jaramillo Oquendo C, Parker H, Oscier D, Ennis S, Gibson J, Strefford JC (July 2019). "Systematic Review of Somatic Mutations in Splenic Marginal Zone Lymphoma". Scientific Reports. 9 (1): 10444. Bibcode:2019NatSR...910444J. doi:10.1038/s41598-019-46906-1. PMC 6639539. PMID 31320741.
- ^ a b c d e Arcaini L, Rossi D, Paulli M (April 2016). "Splenic marginal zone lymphoma: from genetics to management". Blood. 127 (17): 2072–81. doi:10.1182/blood-2015-11-624312. PMID 26989207.
- ^ a b c d e f g h i j k Piris MA, Onaindía A, Mollejo M (2017). "Splenic marginal zone lymphoma". Best Practice & Research. Clinical Haematology. 30 (1–2): 56–64. doi:10.1016/j.beha.2016.09.005. PMID 28288718.
- ^ a b c d e f g h Kalpadakis C, Pangalis GA, Angelopoulou MK, Vassilakopoulos TP (2017). "Treatment of splenic marginal zone lymphoma". Best Practice & Research. Clinical Haematology. 30 (1–2): 139–148. doi:10.1016/j.beha.2016.07.004. PMID 28288709.
- ^ a b c d e f g h Spina V, Rossi D (2017). "Molecular pathogenesis of splenic and nodal marginal zone lymphoma". Best Practice & Research. Clinical Haematology. 30 (1–2): 5–12. doi:10.1016/j.beha.2016.09.004. PMID 28288716.
- ^ Jha P, Das H (November 2017). "KLF2 in Regulation of NF-κB-Mediated Immune Cell Function and Inflammation". International Journal of Molecular Sciences. 18 (11): 2383. doi:10.3390/ijms18112383. PMC 5713352. PMID 29125549.
- ^ a b Sakata-Yanagimoto M, Chiba S (2012). "Notch2 and immune function". In Radtke F (ed.). Notch Regulation of the Immune System. Current Topics in Microbiology and Immunology. Vol. 360. pp. 151–61. doi:10.1007/82_2012_235. ISBN 978-3-642-24293-9. PMID 22695918.
- ^ Iannitto E, Bellei M, Amorim S, Ferreri AJ, Marcheselli L, Cesaretti M, Haioun C, Mancuso S, Bouabdallah K, Gressin R, Tripodo C, Traverse-Glehen A, Baseggio L, Zupo S, Stelitano C, Castagnari B, Patti C, Alvarez I, Liberati AM, Merli M, Gini G, Cabras MG, Dupuis J, Tessoulin B, Perrot A, Re F, Palombi F, Gulino A, Zucca E, Federico M, Thieblemont C (December 2018). "Efficacy of bendamustine and rituximab in splenic marginal zone lymphoma: results from the phase II BRISMA/IELSG36 study". British Journal of Haematology. 183 (5): 755–765. doi:10.1111/bjh.15641. PMID 30407629.
- ^ a b c d e f g h i Thieblemont C, Molina T, Davi F (April 2016). "Optimizing therapy for nodal marginal zone lymphoma". Blood. 127 (17): 2064–71. doi:10.1182/blood-2015-12-624296. PMID 26989202.
- ^ Qu Q, Xuan W, Fan GH (January 2015). "Roles of resolvins in the resolution of acute inflammation". Cell Biology International. 39 (1): 3–22. doi:10.1002/cbin.10345. PMID 25052386.
- ^ a b c d e f g h i Tadmor T, Polliack A (2017). "Nodal marginal zone lymphoma: Clinical features, diagnosis, management and treatment". Best Practice & Research. Clinical Haematology. 30 (1–2): 92–98. doi:10.1016/j.beha.2016.08.026. PMID 28288722.
- ^ a b c d van den Brand M, van Krieken JH (July 2013). "Recognizing nodal marginal zone lymphoma: recent advances and pitfalls. A systematic review". Haematologica. 98 (7): 1003–13. doi:10.3324/haematol.2012.083386. PMC 3696602. PMID 23813646.
- ^ Rudolf R, Busch R, Patra AK, Muhammad K, Avots A, Andrau JC, Klein-Hessling S, Serfling E (2014). "Architecture and expression of the nfatc1 gene in lymphocytes". Frontiers in Immunology. 5: 21. doi:10.3389/fimmu.2014.00021. PMC 3909943. PMID 24550910.
- ^ Brown A, Sciascia-Visani I, Farrell D, Smith M, Felix C, Mutharajah V, Ruell J, Taylor G (2019). "A patient with a diagnosis of nodal marginal zone B-cell lymphoma and a t(2;14)(p24;q32) involving MYCN and IGH". Molecular Cytogenetics. 12: 3. doi:10.1186/s13039-019-0419-3. PMC 6359751. PMID 30733831.
- ^ a b c Woessmann W, Quintanilla-Martinez L (June 2019). "Rare mature B-cell lymphomas in children and adolescents". Hematological Oncology. 37 Suppl 1: 53–61. doi:10.1002/hon.2585. PMID 31187530.
- ^ "Marginal Zone Lymphoma - Lymphoma Research Foundation". www.lymphoma.org. Retrieved 2017-12-10.
- ^ a b "FDA Approves First-Ever Targeted Marginal Zone Lymphoma Treatment". New Developments in Lymphoma. 2017-01-19. Retrieved 2017-12-10.
- ^ Blosse A, Lehours P, Wilson KT, Gobert AP (September 2018). "Helicobacter: Inflammation, immunology, and vaccines". Helicobacter. 23 Suppl 1: e12517. doi:10.1111/hel.12517. PMC 6310010. PMID 30277626.