플루오르화 니트릴
Nitryl fluoride| | |||
| 식별자 | |||
|---|---|---|---|
3D 모델(JSmol) | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.030.007 | ||
| EC 번호 |
| ||
PubChem CID | |||
| 유니 | |||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| FNO2 | |||
| 몰 질량 | 65.003 g/g−1/g | ||
| 녹는점 | -166 °C (-267 °F, 107 K) | ||
| 비등점 | -72°C(-98°F, 201K) | ||
| 관련 화합물 | |||
기타 음이온 | 염화 니트릴, 브롬화 니트릴 | ||
기타 캐티온 | 니트로실플루오르화물, 술푸릴플루오르화물 | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
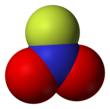
플루오르화 니트릴(NOF2)은 무색 가스 및 강력한 산화제로, 불소화제로[1] 사용되며 로켓 추진제의 산화제로 제안되어 왔습니다(비록 비행하지 않음).
그것은 낮은 끓는점과 일치하는 이온이 아닌 분자종이다.이 구조는 135pm의 [2]짧은 N-F 결합 길이를 가진 평면 질소를 특징으로 합니다.
준비
앙리 모이상과 폴 르보는 1905년 이산화질소의 불소로 니트릴 플루오르화물을 제조했다고 기록했습니다.이 반응은 매우 발열성이 높기 때문에 오염된 제품으로 이어집니다.가장 간단한 방법은 불소 가스를 피하지만 불화 [3]코발트(III)를 사용합니다.
- NO2 + CoF3 → NOF2 + CoF2
CoF는2 CoF로3 재생성할 수 있습니다.다른 방법이 [4]설명되었습니다.
열역학 특성
이 가스의 열역학적 특성은 IR과 라만[5] 분광법에 의해 결정되었다. FNO2 생성의 표준 열은 -19 ± 2 kcal/mol.3이다.
- FNO의2 단분자 분해의 균형은 500 켈빈에서 최소 6 차수, 1000 [5]켈빈에서 2 차수만큼 반응물의 측면에 있다.
- 균질한 열분해는 1200 [5]켈빈 미만의 온도에서는 연구할 수 없습니다.
- 평형은 온도가 [5]상승할수록 반응 물질 쪽으로 이동한다.
- 불화 니트릴에서 N-F 결합 46.0kcal의 해리 에너지는 일반적인 N-F 단일 결합 에너지보다 약 18kcal 적다.이것은22 NO 래디칼의 "재구성 에너지"에 기인할 수 있다. 즉2, FNO의 NO 래디칼은2 유리 NO 분자보다 덜 안정적이다.질적으로 말하자면, N-F 결합에서 "사용된" 홀수 전자는 자유 NO에서2 공명하는 3전자 결합을 형성하고, 따라서 18kcal의 [5]이득으로 분자를 안정화시킨다.
반응
불화질산은 유기질화합물 및 질산에스테르 제조에 사용할 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ Merck Index, 제13판(2001), 페이지1193
- ^ F.A. 코튼과 G.Wilkinson, Advanced 무기화학, 제5판(1988), Wiley, 페이지 333.
- ^ Davis, Ralph A.; Rausch, Douglas A. (1963). "Preparation of Nitryl Fluoride". Inorganic Chemistry. 2 (6): 1300–1301. doi:10.1021/ic50010a048.
- ^ Faloon, Albert V.; Kenna, William B. (1951). "The Preparation of Nitrosyl Fluoride and Nitryl Fluoride1". Journal of the American Chemical Society. 73 (6): 2937–2938. doi:10.1021/ja01150a505. hdl:2027/mdp.39015095101013. ISSN 0002-7863.
- ^ a b c d e Tschuikow-Roux, E. (1962). "Thermodynamic Properties of Nitryl Fluoride". Journal of Physical Chemistry. 66 (9): 1636–1639. doi:10.1021/j100815a017.