코발트(II) 플루오르화
Cobalt(II) fluoride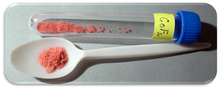 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 코발트(II) 플루오르화 | |
| 기타 이름 이플루오르화 코발트 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.030.044 |
| EC 번호 |
|
펍켐 CID | |
| RTECS 번호 |
|
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| CoF2 | |
| 어금질량 | 96.93 g/190 |
| 외관 | 적색 결정체 고체 |
| 밀도 | 4.46 g/cm3(무수) 2.22 g/cm3(탄화수소) |
| 녹는점 | 1,217 °C(2,223 °F, 1,490 K) |
| 비등점 | 1,400 °C(2,550 °F, 1,670 K) |
| 1.4 g/100 mL(25 °C) | |
| 용해성 | HF에 녹는 알코올, 에테르, 벤젠에서 불용성인 |
자기 감수성(magnetic susibility) | +9490.0/10cm−63/190 |
| 구조 | |
| 4각형(a, 유압) 정형외과(정형수화물) | |
| 위험 | |
| NFPA 704(화재 다이아몬드) | |
| 치사량 또는 농도(LD, LC): | |
LD50(중간 선량) | 경구(랫드): 150mg/kg |
| 관련 화합물 | |
기타 음이온 | 코발트(II) 산화물, 코발트().II) 염화물 |
기타 양이온 | 불소 철(II), 니켈(Nicle)II) 불소화 |
관련 화합물 | 삼불화 코발트 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
코발트(II) 플루오르화물은 공식(CoF2)을 가진 화학 화합물이다. 저온(TN=37.7 K)[3]에서 반자성인 분홍색 결정 고체[1][2] 화합물이다. 이 공식은 적색 4각형 결정체(CoF2)와 적색 4각형 직교 결정체2(CoF·4) 모두에 대해 주어진다.HO2. CoF는2 산소에 민감한 분야, 즉 금속 생산에 사용된다. 저농도에서는 공중 보건 용도가 있다. CoF는2 물에 거의 녹지 않는다. 이 화합물은 따뜻한 미네랄산에 용해될 수 있고 끓는 물에 분해될 것이다. 그러나 수화물은 수용성이 있으며, 특히 di-hydrate CoF2/2H2 O와 3-hydrate CoF2/3는 수용성이 높다.HO형2 화합물이야 수화물 또한 열과 함께 분해될 것이다.
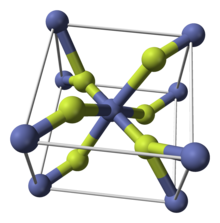
다른 금속 이플루오르화물과 마찬가지로, CoF는2 루타일 구조로 결정되는데, 이 구조는 옥타헤드 코 중심과 평면 플루오르화물이 특징이다.[4]
준비
무수 코발트(II) 플루오르화물은 ()로 조제할 수 있다.II) 염화물 또는 코발트 ()II) 플루오르화 수소 흐름의 산화물:
- CoCl2 + 2HF → CoF2 + 2HCl
- CoO + 2HF → CoF2 + HO2
코발트(III) 불소화물의 물과 반응하여 생성된다.
4수화물 코발트()II) 코발트를 용해하여 불소를 형성한다(II) 불화수소산. 무수 불소는 탈수에 의해 추출될 수 있다. 다른 합성은 더 높은 온도에서 발생할 수 있다. 500 °C에서 불소가 코발트와 결합하여2 CoF와 CoF의3 혼합물을 생성하는 것으로 나타났다.[5]
사용하다
코발트(II) 플루오르화물은 금속 합금의 촉매로 사용될 수 있다. 또한 광학 증착에도 사용되는데, 이 중 광학 품질을 엄청나게 향상시킨다. 코발트(코발트)II) 불소화물은 대부분의 볼륨에서 매우 높은 순도 구성으로 사용할 수 있다. 고순도 구성은 광학적 품질과 표준으로서의 유용성을 향상시킨다.
분석
이 화합물을 분석하기 위해 코발트 (II) 플루오르화물은 질산에 용해될 수 있다. 그런 다음 코발트에 대한 AA 또는 ICP 분광도계에 대한 적절한 농도가 될 때까지 용액을 물로 희석한다. 소량의 소금을 찬물에 녹일 수 있으며 불소 이온 선택 전극이나 이온 크로마토그래피에 의해 불소 이온을 분석할 수 있다.
화학적 특성
CoF는2 약한 Lewis 산이다. 코발트(코발트)II) 콤플렉스는 일반적으로 팔면체 또는 사면체다. 19 전자 종으로서 그것은 18 전자 화합물로 상당히 산화할 수 있는 좋은 환원제다. 코발트(코발트)II) 불소는 300 °C에서 수소로 줄일 수 있다.
참조
- ^ Pradyot Patnaik (2002), Handbook of Inorganic Chemicals, McGraw-Hill Professional, ISBN 978-0-07-049439-8
- ^ Pashkevich, D. S.; Radchenko S. M.; Mukhortov, D. A., "Article title Heat Exchange between Cobalt(II) Fluoride Powder and the Wall of Rotating Cylinder" (PDF), Russian Journal of Applied Chemistry, Consultants Bureau, ISSN 1070-4272, archived from the original (PDF) on 2004-09-29, retrieved 2007-03-07
- ^ 애쉬크로프트/Mermin: 솔리드 스테이트 물리학 (표 33.2)
- ^ Stout, J. W.; Reed, Stanley A. (1954). "The Crystal Structure of MnF2, FeF2, CoF2, NiF2 and ZnF2". J. Am. Chem. Soc. 76 (21): 5279–5281. doi:10.1021/ja01650a005.
- ^ J.C. Bailar (1973), Comprehensive Inorganic Chemistry, Pergoamon
외부 링크
| 위키미디어 커먼즈에는 코발트와 관련된 미디어가 있다(II) 플루오르화. |



