짧은 머리핀 RNA
Short hairpin RNA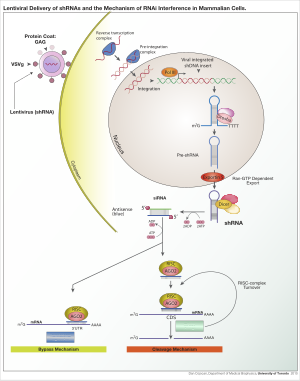
짧은 머리핀 RNA 또는 작은 머리핀 RNA(shRNA/Hairpin Vector)는 RNA 간섭(RNAi)[1][2]을 통해 표적 유전자 발현을 침묵시키는 데 사용할 수 있는 촘촘한 머리핀 회전을 가진 인공 RNA 분자입니다.세포에서 shRNA의 발현은 전형적으로 플라스미드의 전달이나 바이러스 또는 세균 벡터를 통해 이루어진다.shRNA는 상대적으로 낮은 분해율과 전환율을 가진 RNAi의 유리한 매개체이다.단, 발현 벡터의 사용이 필요하며,[3] 이는 의약품 적용에서 부작용을 일으킬 수 있는 가능성이 있다.
프로모터 선택은 강력한 shRNA 발현을 달성하기 위해 필수적이다.처음에는 U6 및 H1과 같은 중합효소 III 촉진제가 사용되었지만, 이러한 촉진제는 공간적, 시간적 [3]제어가 부족하다.이와 같이 유도성 중합효소 II촉진제를 사용하여 shRNA 발현을 조절하는 방향으로 전환되었다.
배달.
세포에서의 shRNA 발현은 플라스미드의 송달 또는 바이러스 또는 세균 벡터를 통해 얻을 수 있다.
shRNA 발현을 얻기 위해 트랜스펙션을 통해 세포에 플라스미드를 전달하는 것은 시판되는 시험관내 시약을 사용하여 달성할 수 있다.그러나 이 방법은 생체 내에 적용할 수 없기 때문에 효용이 제한적이다.
세포에서 shRNA 발현을 얻기 위해 세균 벡터를 사용하는 것은 비교적 최근의 접근법이다.그것은 생쥐에게 공급되는 shRNA를 가진 플라스미드를 포함한 재조합 대장균이 장 [4]상피에서 표적 유전자 발현을 녹다운시킬 수 있다는 것을 보여주는 연구를 뒷받침한다.이 접근법은 가족성 선종성 [5]용종증 환자를 치료하기 위해 2012년 임상시험에서 사용되었다.
아데노 관련 바이러스(AAV), 아데노 바이러스 및 렌티바이러스를 포함한 세포에서 shRNA 발현을 얻기 위해 다양한 바이러스 벡터를 사용할 수 있다.아데노 관련 바이러스와 아데노 바이러스의 경우, 게놈은 에피좀으로 남습니다.이는 삽입형 돌연변이 발생을 회피하기 때문에 유리하다.세포 분열이 매우 느리지 않으면 세포 분열로 바이러스가 빨리 손실된다는 점에서 불리하다.AAV는 바이러스 유전자가 제거되고 포장 능력이 떨어진다는 점에서 아데노바이러스와 다르다.렌즈 바이러스는 전사 활성 크로마틴의 단면에 통합되어 자손 세포로 전달됩니다.이 접근방식을 사용하면 삽입형 돌연변이 유발의 위험이 증가하지만, 통합효소 결핍 [6]렌티바이러스를 사용함으로써 위험을 줄일 수 있다.
작용 메커니즘
벡터가 숙주 게놈에 통합되면 프로모터 선택에 따라 중합효소 II 또는 중합효소 III에 의해 shRNA가 핵에 전사됩니다.이 제품은 pri-microRNA(pri-miRNA)를 모방하여 Drosha에 의해 처리됩니다.결과적으로 생성된 사전 shRNA는 Exportin 5에 의해 핵에서 내보내집니다.그런 다음 이 제품은 Dicer에 의해 처리되고 RNA 유도 소음 복합체(RISC)에 로드됩니다.감지(조수석) 가닥이 저하되었습니다.안티센스(가이드) 스트랜드는 상보적인 시퀀스를 가진 mRNA로 RISC를 유도합니다.완전보완성의 경우 RISC는 mRNA를 절단합니다.상보성이 불완전한 경우 RISC는 mRNA의 변환을 억제합니다.두 경우 모두, shRNA는 표적 유전자 사일링으로 이어진다.
유전자 치료에서의 응용
특정하고 오래 지속되는 유전자 사일링을 제공하는 shRNA의 능력으로 인해 유전자 치료 응용에 shRNA를 사용하는 것에 큰 관심이 있었다.shRNA 기반 치료법의 세 가지 예가 아래에 설명되어 있습니다.
그라달리스사는 진행성 암 치료에 사용되는 FANG 백신을 개발했다.FANG는 면역억제변환성장인자(TGF) β1 및 β2에 [8]대해 2관능성 shRNA(bi-shRNA)에 의존한다.환자로부터 자가종양세포를 채취하여 전기절연을 통해 이관능성 shRNA 및 과립구 대식세포 콜로니 자극인자(GMCSF)를 코드하는 플라스미드를 생체외로 도입하였다.이 세포들은 나중에 조사되어 환자에게 다시 주사되었다.
마리나 바이오텍은 가족성 선종성 용종증 치료에 사용되는 CEQ508을 개발했다.CEQ508은 박테리아 벡터를 사용하여 β-카테닌에 대해 shRNA를 전달한다.
Gradalis, Inc.는 진행암 및/또는 전이암 치료에 사용되는 2관능성 shRNA-STMN1(pbi-shRNA STMN1)을 개발했다.이 pbi-shRNA STMN1은 스타트민 1에 대항하여 BIV(Bilamellar Invaginated Vessicle) 리포플렉스(LP) 기술을 통해 종양내로 전달됩니다.
일반적으로 몇 가지 문제가 shRNA 기반 치료제에 직면한다.가장 중요한 과제는 전달이다. shRNA는 일반적으로 벡터의 사용을 통해 전달되며, 일반적으로 효율적이기는 하지만 상당한 안전 문제를 제기한다.특히, 바이러스 기반 유전자 치료 접근법은 과거 임상 시험에서 위험하다는 것이 입증되었다.역 바이러스 유전자 치료의 1세대에서는 위스코트-알드리치 증후군에 대한 바이러스 벡터로 치료된 일부 환자가 급성 T세포 백혈병에 걸렸다.바이러스 벡터 삽입 위치에 [9]의해 발생한 것으로 확인되었습니다.RISC의 포화도도도 문제입니다.만약 shRNA가 너무 높은 수준에서 발현된다면, 세포는 심각한 문제를 일으킬 수 있는 내생 RNA를 올바르게 처리하지 못할 수 있다.또 다른 과제는 환자가 치료에 [10]대해 면역 반응을 일으킬 수 있다는 것이다.마지막으로, 목표에서 벗어난 효과가 있을 수 있고 shRNA는 의도하지 않은 다른 유전자를 침묵시킬 수 있다.성공적인 새로운 shRNA 기반 치료제를 개발할 때 이러한 모든 과제를 고려해야 한다.
「 」를 참조해 주세요.
레퍼런스
- ^ Paddison PJ, Caudy AA, Bernstein E, Hannon GJ, Conklin DS (April 2002). "Short hairpin RNAs (shRNAs) induce sequence-specific silencing in mammalian cells". Genes & Development. 16 (8): 948–58. doi:10.1101/gad.981002. PMC 152352. PMID 11959843.
- ^ Brummelkamp TR, Bernards R, Agami R (April 2002). "A system for stable expression of short interfering RNAs in mammalian cells". Science. 296 (5567): 550–3. doi:10.1126/science.1068999. hdl:1874/15573. PMID 11910072.
- ^ a b Wang Z, Rao DD, Senzer N, Nemunaitis J (December 2011). "RNA interference and cancer therapy". Pharmaceutical Research. 28 (12): 2983–95. doi:10.1007/s11095-011-0604-5. PMID 22009588.
- ^ Xiang S, Fruehauf J, Li CJ (June 2006). "Short hairpin RNA-expressing bacteria elicit RNA interference in mammals". Nature Biotechnology. 24 (6): 697–702. doi:10.1038/nbt1211. PMID 16699500.
- ^ Burnett JC, Rossi JJ, Tiemann K (September 2011). "Current progress of siRNA/shRNA therapeutics in clinical trials". Biotechnology Journal. 6 (9): 1130–46. doi:10.1002/biot.201100054. PMC 3388104. PMID 21744502.
- ^ Lombardo A, Genovese P, Beausejour CM, Colleoni S, Lee YL, Kim KA, Ando D, Urnov FD, Galli C, Gregory PD, Holmes MC, Naldini L (November 2007). "Gene editing in human stem cells using zinc finger nucleases and integrase-defective lentiviral vector delivery". Nature Biotechnology. 25 (11): 1298–306. doi:10.1038/nbt1353. PMID 17965707.
- ^ Macrae IJ, Zhou K, Li F, Repic A, Brooks AN, Cande WZ, Adams PD, Doudna JA (January 2006). "Structural basis for double-stranded RNA processing by Dicer". Science. 311 (5758): 195–8. doi:10.1126/science.1121638. PMID 16410517.
- ^ Senzer N, Barve M, Kuhn J, Melnyk A, Beitsch P, Lazar M, Lifshitz S, Magee M, Oh J, Mill SW, Bedell C, Higgs C, Kumar P, Yu Y, Norvell F, Phalon C, Taquet N, Rao DD, Wang Z, Jay CM, Pappen BO, Wallraven G, Brunicardi FC, Shanahan DM, Maples PB, Nemunaitis J (March 2012). "Phase I trial of "bi-shRNAi(furin)/GMCSF DNA/autologous tumor cell" vaccine (FANG) in advanced cancer". Molecular Therapy. 20 (3): 679–86. doi:10.1038/mt.2011.269. PMC 3293620. PMID 22186789.
- ^ Persons DA, Baum C (February 2011). "Solving the problem of γ-retroviral vectors containing long terminal repeats". Molecular Therapy. 19 (2): 229–31. doi:10.1038/mt.2010.305. PMC 3034864. PMID 21289636.
- ^ Whitehead KA, Dahlman JE, Langer RS, Anderson DG (2011). "Silencing or stimulation? siRNA delivery and the immune system". Annual Review of Chemical and Biomolecular Engineering. 2: 77–96. doi:10.1146/annurev-chembioeng-061010-114133. PMID 22432611.



