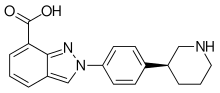
니라파리브
Niraparib | |
| 임상 데이터 | |
|---|---|
| 발음 | /nn-rép-rb/ nih-RAP-uh-rib |
| 상호 | 제줄라 |
| 기타 이름 | MK-4827 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a617007 |
| 라이선스 데이터 | |
| 임신 카테고리 |
|
| 루트 행정부. | 입으로 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 73% |
| 단백질 결합 | 83% |
| 대사 | 카르본실레스테라아제 |
| 대사물 | M1(카르본산) |
| 반감기 제거 | 36시간 |
| 배설물 | 소변 48%, 대변 29% |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.210.548 |
| 화학 및 물리 데이터 | |
| 공식 | C19H20N4O |
| 몰 질량 | 320.396 g/g−1/g |
| 3D 모델(JSmol) | |
| 물에 녹는 정도 | 0.7–1.1 |
| |
| |
제줄라(Zejula)라는 상표로 판매되는 니라파리브는 상피 난소, 나팔관,[3][4][5] 원발성 복막암 치료에 사용되는 항암제이다.입으로 [3][4]먹는 거예요.PARP 억제제입니다.
가장 흔한 부작용으로는 메스꺼움(몸이 아픈 느낌), 혈소판 감소증(혈소판 감소), 피로와 쇠약, 빈혈(적혈구 감소), 변비, 구토, 복부 통증, 호중구 감소(호중구 감소, 백혈구의 일종), 불면증, 두통, 식욕부진, 설사 등이 있다.a, 호흡곤란(호흡곤란), 고혈압(고혈압), 요통, 어지럼증, 기침, 관절통, 뜨거운 홍조 및 백혈구 [4]감소.
Niraparib은 2017년 [4][6][7]미국과 유럽연합에서 의료용으로 승인되었습니다.
의료 용도
니라파리브는 백금 기반 화학요법에 [5]완전 또는 부분 반응하는 난소상피암, 나팔관암 또는 원발성 복막암을 재발하는 성인의 유지 치료에 사용된다.
2019년 10월, 니라파리브 표시는 3개 이상의 사전 화학요법 요법으로 처리된 진행성 난소암, 나팔관암 또는 원발성 복막암 환자 및 암이 상동재조합결핍증([8]HRD) 양성 상태와 관련이 있는 사람으로 확대되었다.HRD는 마지막 백금 기반 화학요법에 [8]대한 반응 후 6개월 이상 질병 진행 환자의 유해 또는 유해한 BRCA 돌연변이 또는 유전자 불안정성에 의해 정의된다.
2020년 4월, 니라파리브에 대한 지표는 진행성 상피 난소, 나팔관 또는 1차 복막암을 가진 성인의 1차 백금 기반 [9]화학요법에 대한 완전 또는 부분 반응 치료로 확대되었다.
유럽연합에서는 니라파리브(niraparib)를 1차 백금 기반 화학요법 완료 후 반응(완전 또는 부분)하는 고도 상피(FIGO Stage III 및 IV) 난소, 나팔관 또는 1차 복막암 성인의 유지 치료를 위한 단요법으로, m에 대한 단요법으로 명시하고 있다.백금계 화학요법에 [4]대한 반응(완전 또는 부분)이 있는 백금계 민감성 높은 장액상피 난소, 나팔관 또는 원발성 복막암 재발 성인의 안색 치료.
금지 사항
처방 [3]정보에는 금기가 기재되어 있지 않습니다.
부작용
연구에서 가장 흔한 부작용은 저혈소판 감소증(환자의 61%에서 심각, 29%에서 심각), 빈혈(50%에서 심각, 25%에서 심각), 호중구 감소증(30%에서 심각, 20%에서 심각)이었다.대부분 가벼운 부작용에서 중간 정도의 부작용으로는 메스꺼움, 피로, 변비가 있었다.250일 이상 진행된 연구(중간)에서 환자의 15%가 부작용으로 [3]인해 니라파립을 영구적으로 중단해야 했습니다.
상호 작용
수행된 임상 상호 작용 연구가 없습니다.니라파리브와 주요 대사물 M1은 중요한 시토크롬 P450 간 효소와 체외에서 유의하게 상호작용하지 않기 때문에 다른 약물과의 상호작용 가능성은 낮다.Niraparib는 M1이 아닌 P-글리코프로틴과 BCRP에 의해 운반되지만 크게 억제되지는 않습니다.니라파리브와 M1은 다른 중요한 전달 [3]단백질과 유의하게 상호작용하지 않는다.
약리학
작용 메커니즘
니라파리브는 효소 PARP1과 PARP2의 [10]억제제이다.
약동학
섭취한 니라파립의 73%가 [12]내장에 흡수되며, 음식 섭취와 무관하게 약 3시간 후에 혈장 농도가 가장 높아집니다.혈액순환에서 물질의 83%가 혈장 단백질에 결합되어 있다.카르본산에스테라아제에 의해 주요 대사물인 카르본산 [11]유도체 M1로 불활성화되며, 이후 글루쿠론화된다.[3]
평균 생물학적 반감기는 36시간이며, 47.5%는 소변, 38.8%는 대변에서 발견된다.미대사 니라파립은 소변에서 11%, [11]대변에서 19%를 차지한다.
화학
이 약물은 소금 니라파리브 토실레이트 일수화물 형태로 사용되며, 일수화물은 흰색에서 흰색, 비흡습성 [3][10]결정체입니다.
스터디
2012년 세포주 연구에 따르면 PARP 억제제는 PARP의 효소적 억제뿐만 아니라 손상된 DNA에 대한 PARP의 포섭에 의해 세포독성 효과를 나타내며, 이 포섭 활성의 강도는 niraparib >>> olaparib [13]> > > veliparib 순으로 나타났다.
역사
니라파리브는 미국 식품의약국(FDA)으로부터 패스트트랙 지정을 받았으며 테사로는 2016년 신약 신청서를 [14]제출했다.2017년 [5]3월 27일 미국에서 승인되었으며,[15] 2017년 11월 16일 유럽연합에서 승인되었다.
553명의 환자를 대상으로 한 연구에서, 생식선에서 유해하거나 유해성이 의심되는 BRCA 돌연변이를 가진 환자의 무진행 생존(PFS)은 플라시보 5.5개월에 비해 니라파리브 치료 하에서 21.0개월이었다.그러한 돌연변이가 없는 환자들은 플라시보 [5][16]하에서는 3.9개월이었던 것에 비해 니라파리브 하에서는 9.3개월의 PFS를 가졌다.
미국 식품의약국(FDA)은 니라파립 패스트 트랙, 우선순위 검토, 획기적인 치료 및 고아 약물 [5]지정을 위한 신청을 허가했다.
레퍼런스
- ^ "Summary Basis of Decision (SBD) for Zejula". Health Canada. Retrieved 29 May 2022.
- ^ "Zejula 100 mg hard capsules - Summary of Product Characteristics (SmPC)". (emc). Retrieved 17 January 2021.
- ^ a b c d e f g h "Zejula- niraparib capsule". DailyMed. Retrieved 17 January 2021.
- ^ a b c d e f "Zejula EPAR". European Medicines Agency (EMA). Retrieved 17 January 2021. 텍스트는 이 소스인 © 유럽 의약품청에서 복사한 것입니다.출처가 확인되면 복제가 허가됩니다.
- ^ a b c d e "Niraparib (Zejula)". U.S. Food and Drug Administration (FDA). 30 March 2017.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ "FDA approves maintenance treatment for recurrent epithelial ovarian, fallopian tube or primary peritoneal cancers". U.S. Food and Drug Administration (FDA) (Press release). 27 March 2017. Retrieved 17 January 2021.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ "Drug Trials Snapshots: Zejula". U.S. Food and Drug Administration (FDA). 27 March 2017. Retrieved 17 January 2021.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ a b "FDA approves niraparib for HRD-positive advanced ovarian cancer". U.S. Food and Drug Administration (FDA). 23 October 2019. Retrieved 17 January 2021.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ "FDA approves niraparib for first-line maintenance of advanced ovarian". U.S. Food and Drug Administration (FDA). 29 April 2020. Retrieved 17 January 2021.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ a b "Niraparib Monograph for Professionals". American Society of Health-System Pharmacists. 22 September 2020. Retrieved 17 January 2021.
- ^ a b c van Andel L, Zhang Z, Lu S, Kansra V, Agarwal S, Hughes L, et al. (December 2017). "14C-niraparib, a novel poly(ADP-Ribose) polymerase (PARP)-1 and PARP-2 inhibitor, in patients with advanced cancer". Investigational New Drugs. 35 (6): 751–765. doi:10.1007/s10637-017-0451-2. PMC 5694528. PMID 28303528.
- ^ van Andel L, Rosing H, Zhang Z, Hughes L, Kansra V, Sanghvi M, et al. (January 2018). "14C-microtracer and therapeutic dose in cancer patients". Cancer Chemotherapy and Pharmacology. 81 (1): 39–46. doi:10.1007/s00280-017-3455-x. PMC 5754411. PMID 29043410.
- ^ Murai J, Huang SY, Das BB, Renaud A, Zhang Y, Doroshow JH, et al. (November 2012). "Trapping of PARP1 and PARP2 by Clinical PARP Inhibitors". Cancer Research. 72 (21): 5588–99. doi:10.1158/0008-5472.CAN-12-2753. PMC 3528345. PMID 23118055.
- ^ "Niraparib Receives FDA Fast Track Designation for the Treatment of Recurrent Platinum-Sensitive Ovarian, Fallopian Tube, or Primary Peritoneal Cancer". The European Society for Medical Oncology (ESMO). 5 September 2016.
- ^ "Zejula". European Medicines Agency. 17 September 2018.
- ^ Adams B (29 June 2016). "Tesaro's PARP ovarian cancer drug hits PhIII goal; prepares to file". Fierce Biotech.
외부 링크
- "Niraparib". Drug Information Portal. U.S. National Library of Medicine.
- "Niraparib tosylate". Drug Information Portal. U.S. National Library of Medicine.
- "Niraparib tosylate monohydrate". NCI Drug Dictionary. National Cancer Institute.
- "Niraparib tosylate monohydrate". National Cancer Institute. 14 April 2017.