인자 D
Factor D| 보체 인자 D(아디핀) | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| 식별자 | |||||||
| 기호. | CFD | ||||||
| Alt. | DF, PFD | ||||||
| NCBI유전자 | 1675 | ||||||
| HGNC | 2771 | ||||||
| 옴 | 134350 | ||||||
| 참조 | NM_001928 | ||||||
| 유니프로트 | P00746 | ||||||
| 기타 데이터 | |||||||
| 궤적 | 19장 페이지 13.3 | ||||||
| |||||||
인자 D(EC 3.4.21.46, C3 프로활성화제 변환효소, 프로퍼틴 인자 D 에스테라아제, 인자 D(완전성), 보체 인자 D, CFD, 아딥신)는 CFD [3]유전자에 의해 인체에서 코드되는 단백질이다.인자 D는 인자 B를 분해하는 보체 시스템의 대체 보체 경로에 관여한다.
기능.
이 유전자에 의해 코드된 단백질은 지방세포에 의해 혈류로 분비되는 세린단백질가수분해효소의 트립신 계열의 구성원이다.암호화된 단백질은 감염제의 체액 억제에 대한 역할로 가장 잘 알려진 대체 보체 경로의 구성요소이다.마지막으로, 암호화된 단백질은 지방으로 높은 수준의 발현을 가지며, 면역 체계 [3]생물학에서 지방 조직에 대한 역할을 암시합니다.
인자 D는 지방 세포에서 트리글리세리드 축적을 위한 포도당 운반을 촉진하고 지방 [4]분해를 억제하는 세린 단백질 분해효소이다.
임상적 의의
비만 환자에서는 인자 D의 수치가 감소합니다[5].이러한 감소는 높은 활동성 또는 저항성으로 인해 발생할 수 있지만 정확한 원인은 알려지지 않았습니다.
구조.
세린단백질가수분해효소의 키모트립신 계열의 모든 구성원들은 매우 유사한 구조를 가지고 있다.인자 D를 포함한 모든 경우, 모든 효소에서 동일한 유형을 가진 6개의 β-스트랜드를 포함하는 각 배럴에 2개의 역평행 β-배럴 도메인이 있다.D인자와 키모트립신 계열의 다른 세린 단백질 분해효소 사이의 골격 구조의 주요 차이점은 2차 구조 요소를 연결하는 표면 루프에 있다.인자 D는 크로트립신 계열에서 전형적으로 발견되는 주요 촉매 및 기질 결합 잔류물의 서로 다른 형태를 나타낸다.이러한 특성은 재구성에 의해 [6]구조 변화가 유도되지 않는 한 인자 D의 촉매 활성이 금지됨을 나타냅니다.
액션 메커니즘
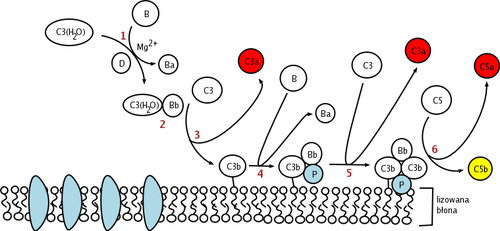
인자 D는 활성 배열로 혈액과 조직에 존재하는 세린 단백질 분해효소이지만 자기 억제된 형태이다.인자 D의 유일한 천연 기질은 인자 B이며 인자 B의 Arg-Lys234235 시실 결합을 분할하면 인자 Ba와 Bb라는 두 개의 인자 B 조각이 생성됩니다.인자 B의 가위 결합이 갈라지기 전에 인자 B가 먼저 C3b와 결합해야 C3bB [7]착체를 형성할 수 있다.C3bB 복합체에서의 인자 B의 이러한 구조변화는 인자 B가 인자 D의 결합 부위에 적합하도록 하는 것이 제안된다.
인자 D의 촉매 삼합체는 Asp, His57 및 Ser로195 구성됩니다102.인자 D의 다른 주요 성분은 자기억제 루프(아미노산 잔류물 212~218)와57 His 측쇄를 비규격 [8][9]배합으로 안정화시키는 Asp-Arg189218 염교이다.억제된 형태에서는 자기 억제 루프가 계수 B에서 계수 D로의 접근을 방해합니다.C3bB 복합체에 의해 인자 D의 자기억제적 적합에 접근하면 인자 D의 소금 브릿지가 C3bB로 대체되고 인자 B의 Arg와234 인자189 [10][11]D의 Asp 사이에 새로운 소금 브릿지가 생긴다.인자 D 소금 브릿지의 변위는 자기억제 루프의 재배열과 활성 부위 히스티딘 측쇄의 회전을 초래하여 인자 D의 표준 형태를 생성한다.이어서 인자 B의 시실 결합의 분열이 일어나 단편 Ba를 방출하고 대체 경로인 C3-변환효소인 [12]C3bb를 형성한다.
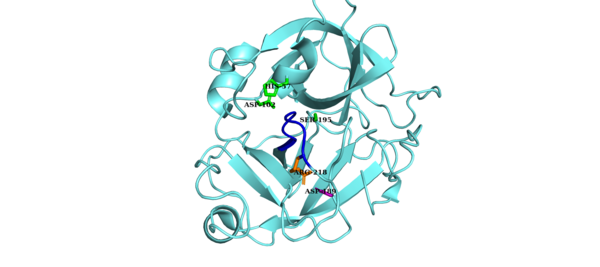 자기 억제 루프(파란색)에 의해 인자 D의 비표준적 Configuration이 억제됩니다.Asp-Arg 소금 브리지(보라색 및 주황색 사이드 체인)는 자가 억제 루프를 안정화시킵니다.촉매 삼합체는 [13]녹색으로 표시됩니다. |  인자 D의 표준 구성은 자기 억제되지 않습니다.Asp-Arg 소금 브리지(각각 보라색 및 주황색 사이드 체인)가 교체되어 자체 억제 루프(파란색)가 이동되었습니다.촉매 삼합체는 [14]녹색으로 표시됩니다. |
규정
D인자는 간과 지방세포에 의해 합성되며, D인자는 간세포와 지방세포가 주요 공급원이다.분비되는 인자 D의 프로 형태는 MASP-3에 의해 분해되어 [15]체내에서 순환하는 활성 배열을 형성한다.인자 D는 매우 높은 기질특이성을 유지하며, 그 결과 [16]체내에 알려진 자연억제제가 없다.그러나 대부분의 인자 D는 촉매 부위로의 기판 접근을 제한하는 자가 억제된 형태로 유지됩니다.인자 D는 분자량이 23.5 kD이고 건강한 사람의 혈액 농도는 1.8 mg/L이다.인자의 합성 속도는 약 1.33mg/kg/일이며, 대부분의 D 인자는 재흡수 후 근위세관에서 이화작용을 거쳐 신장을 통해 제거된다.순효과는 [17]시간당 60%의 높은 부분대사율이다.신장 기능이 정상인 환자에서는 소변에서 D인자가 검출되지 않았다.그러나 신장질환 환자에서는 D인자가 높은 수치로 발견되었다.대체 경로는 낮은 수준의 인자 D에서도 작동할 수 있으며, 인자 D 수준의 결핍은 드물다.[18][19]
질병에서의 역할
염색체 19의 인자 D 유전자의 세린 코돈(인자42 D의 미처리 메티오닌 형태의 Ser)을 정지 코돈(TAG)으로 치환하는 점 돌연변이가 인자 D [20]결핍의 원인으로 확인되었다.인자 D의 결핍은 세균 감염, 특히 Neisseria 감염에 대한 민감도를 높일 수 있습니다.인자 D 결핍의 유전 모드는 상염색체 열성이며, 오직 하나의 대립 유전자에 돌연변이가 있는 개인은 재발하는 감염에 대한 동일한 민감성을 경험하지 못할 수 있다.재감염 환자의 경우 정제된 인자 [21]D를 도입하여 상태를 완전히 개선하였다.
과도한 보체활성화를 수반하는 질병은 발작성 야간에 발생하는 헤모글로빈뇨(PNH)를 포함하며, 인자 D의 억제제는 PNH의 치료에 효용성이 있을 수 있다. 인자 D의 소분자 억제제는 PNH의 치료를 위해 개발 중이며, 1개의 소분자 억제제 ACH-471은 임상시험에서 가능성을 보였다.또는 에큘리주맙과 결합 시 D 억제.D인자 억제제를 투여한 환자는 D인자 [22][23]결핍 환자의 경우처럼 감염이 재발하지 않도록 예방접종을 받아야 합니다.
레퍼런스
- ^ PDB: 1HFD
- ^ Narayana SV, Carson M, el-Kabbani O, Kilpatrick JM, Moore D, Chen X, Bugg CE, Volanakis JE, DeLucas LJ (1994). "Structure of human factor D. A complement system protein at 2.0 A resolution". Journal of Molecular Biology. 235 (2): 695–708. doi:10.1006/jmbi.1994.1021. PMID 8289289.
- ^ a b 엔트레스진 1675
- ^ Ronti T, Lupattelli G, Mannarino E (2006). "The endocrine function of adipose tissue: an update". Clinical Endocrinology. 64 (4): 355–65. doi:10.1111/j.1365-2265.2006.02474.x. PMID 16584505. S2CID 12455240.
- ^ Flier JS, Cook KS, Usher P, Spiegelman BM (1987). "Severely impaired adipsin expression in genetic and acquired obesity". Science. 237 (4813): 405–8. Bibcode:1987Sci...237..405F. doi:10.1126/science.3299706. PMID 3299706.
- ^ Volanakis JE, Narayana SV (1996). "Complement factor D, a novel serine protease". Protein Science. 5 (4): 553–64. doi:10.1002/pro.5560050401. PMC 2143395. PMID 8845746.
- ^ Lesavre, PH; Müller-Eberhard, HJ (1 December 1978). "Mechanism of action of factor D of the alternative complement pathway". The Journal of Experimental Medicine. 148 (6): 1498–509. doi:10.1084/jem.148.6.1498. PMC 2185104. PMID 82604.
- ^ Jing, H; Babu, YS; Moore, D; Kilpatrick, JM; Liu, XY; Volanakis, JE; Narayana, SV (9 October 1998). "Structures of native and complexed complement factor D: implications of the atypical His57 conformation and self-inhibitory loop in the regulation of specific serine protease activity". Journal of Molecular Biology. 282 (5): 1061–81. doi:10.1006/jmbi.1998.2089. PMID 9753554.
- ^ Jing, H; Macon, KJ; Moore, D; DeLucas, LJ; Volanakis, JE; Narayana, SV (15 February 1999). "Structural basis of profactor D activation: from a highly flexible zymogen to a novel self-inhibited serine protease, complement factor D." The EMBO Journal. 18 (4): 804–14. doi:10.1093/emboj/18.4.804. PMC 1171173. PMID 10022823.
- ^ Karki, RG; Powers, J; Mainolfi, N; Anderson, K; Belanger, DB; Liu, D; Ji, N; Jendza, K; Gelin, CF; Mac Sweeney, A; Solovay, C; Delgado, O; Crowley, M; Liao, SM; Argikar, UA; Flohr, S; La Bonte, LR; Lorthiois, EL; Vulpetti, A; Brown, A; Long, D; Prentiss, M; Gradoux, N; de Erkenez, A; Cumin, F; Adams, C; Jaffee, B; Mogi, M (9 May 2019). "Design, Synthesis, and Preclinical Characterization of Selective Factor D Inhibitors Targeting the Alternative Complement Pathway". Journal of Medicinal Chemistry. 62 (9): 4656–4668. doi:10.1021/acs.jmedchem.9b00271. PMID 30995036. S2CID 122356241.
- ^ Forneris, F; Ricklin, D; Wu, J; Tzekou, A; Wallace, RS; Lambris, JD; Gros, P (24 December 2010). "Structures of C3b in complex with factors B and D give insight into complement convertase formation". Science. 330 (6012): 1816–20. Bibcode:2010Sci...330.1816F. doi:10.1126/science.1195821. PMC 3087196. PMID 21205667.
- ^ Vulpetti, A; Randl, S; Rüdisser, S; Ostermann, N; Erbel, P; Mac Sweeney, A; Zoller, T; Salem, B; Gerhartz, B; Cumin, F; Hommel, U; Dalvit, C; Lorthiois, E; Maibaum, J (9 March 2017). "Structure-Based Library Design and Fragment Screening for the Identification of Reversible Complement Factor D Protease Inhibitors". Journal of Medicinal Chemistry. 60 (5): 1946–1958. doi:10.1021/acs.jmedchem.6b01684. PMID 28157311.
- ^ Maibaum, J; Liao, SM; Vulpetti, A; Ostermann, N; Randl, S; Rüdisser, S; Lorthiois, E; Erbel, P; Kinzel, B; Kolb, FA; Barbieri, S; Wagner, J; Durand, C; Fettis, K; Dussauge, S; Hughes, N; Delgado, O; Hommel, U; Gould, T; Mac Sweeney, A; Gerhartz, B; Cumin, F; Flohr, S; Schubart, A; Jaffee, B; Harrison, R; Risitano, AM; Eder, J; Anderson, K (December 2016). "Small-molecule factor D inhibitors targeting the alternative complement pathway". Nature Chemical Biology. 12 (12): 1105–1110. doi:10.1038/nchembio.2208. PMID 27775713.
- ^ Vulpetti, A; Ostermann, N; Randl, S; Yoon, T; Mac Sweeney, A; Cumin, F; Lorthiois, E; Rüdisser, S; Erbel, P; Maibaum, J (10 May 2018). "Discovery and Design of First Benzylamine-Based Ligands Binding to an Unlocked Conformation of the Complement Factor D." ACS Medicinal Chemistry Letters. 9 (5): 490–495. doi:10.1021/acsmedchemlett.8b00104. PMC 5949727. PMID 29795765.
- ^ Hayashi, M; Machida, T; Ishida, Y; Ogata, Y; Omori, T; Takasumi, M; Endo, Y; Suzuki, T; Sekimata, M; Homma, Y; Ikawa, M; Ohira, H; Fujita, T; Sekine, H (15 September 2019). "Cutting Edge: Role of MASP-3 in the Physiological Activation of Factor D of the Alternative Complement Pathway". Journal of Immunology. 203 (6): 1411–1416. doi:10.4049/jimmunol.1900605. PMID 31399515. S2CID 199518699.
- ^ Lorthiois, E; Anderson, K; Vulpetti, A; Rogel, O; Cumin, F; Ostermann, N; Steinbacher, S; Mac Sweeney, A; Delgado, O; Liao, SM; Randl, S; Rüdisser, S; Dussauge, S; Fettis, K; Kieffer, L; de Erkenez, A; Yang, L; Hartwieg, C; Argikar, UA; La Bonte, LR; Newton, R; Kansara, V; Flohr, S; Hommel, U; Jaffee, B; Maibaum, J (13 July 2017). "Discovery of Highly Potent and Selective Small-Molecule Reversible Factor D Inhibitors Demonstrating Alternative Complement Pathway Inhibition in Vivo". Journal of Medicinal Chemistry. 60 (13): 5717–5735. doi:10.1021/acs.jmedchem.7b00425. PMID 28621538.
- ^ Dobó, J; Kocsis, A; Gál, P (2018). "Be on Target: Strategies of Targeting Alternative and Lectin Pathway Components in Complement-Mediated Diseases". Frontiers in Immunology. 9: 1851. doi:10.3389/fimmu.2018.01851. PMC 6092519. PMID 30135690.
- ^ Volanakis, JE; Barnum, SR; Giddens, M; Galla, JH (14 February 1985). "Renal filtration and catabolism of complement protein D.". The New England Journal of Medicine. 312 (7): 395–9. doi:10.1056/NEJM198502143120702. PMID 3844050.
- ^ Pascual, M; Steiger, G; Estreicher, J; Macon, K; Volanakis, JE; Schifferli, JA (October 1988). "Metabolism of complement factor D in renal failure". Kidney International. 34 (4): 529–36. doi:10.1038/ki.1988.214. PMID 3199673.
- ^ Biesma, DH; Hannema, AJ; van Velzen-Blad, H; Mulder, L; van Zwieten, R; Kluijt, I; Roos, D (July 2001). "A family with complement factor D deficiency". The Journal of Clinical Investigation. 108 (2): 233–40. doi:10.1172/JCI12023. PMC 203023. PMID 11457876.
- ^ Hiemstra, PS; Langeler, E; Compier, B; Keepers, Y; Leijh, PC; van den Barselaar, MT; Overbosch, D; Daha, MR (December 1989). "Complete and partial deficiencies of complement factor D in a Dutch family". The Journal of Clinical Investigation. 84 (6): 1957–61. doi:10.1172/JCI114384. PMC 304077. PMID 2687330.
- ^ Yuan, X; Gavriilaki, E; Thanassi, JA; Yang, G; Baines, AC; Podos, SD; Huang, Y; Huang, M; Brodsky, RA (March 2017). "Small-molecule factor D inhibitors selectively block the alternative pathway of complement in paroxysmal nocturnal hemoglobinuria and atypical hemolytic uremic syndrome". Haematologica. 102 (3): 466–475. doi:10.3324/haematol.2016.153312. PMC 5394948. PMID 27810992.
- ^ Risitano, AM (January 2014). "Anti-Complement Treatment in Paroxysmal Nocturnal Hemoglobinuria: Where we Stand and Where we are Going". Translational Medicine @ UniSa. 8: 43–52. PMC 4000462. PMID 24778997.