RNA사일링억제제 p19
RNA silencing suppressor p19| RNA사일링억제제 p19 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 식별자 | |||||||||
| 기호. | 톰버스_p19 | ||||||||
| 팜 | PF03220 | ||||||||
| 인터프로 | IPR004905 | ||||||||
| |||||||||
RNA 사일링 억제제 p19(Tombusvirus P19 핵심 단백질 및 19kDa 증상 심각도 조절기라고도 함)는 톰버스 바이러스의 게놈에 있는 ORF4 유전자에서 발현되는 단백질이다.이 바이러스들은 식물 세포를 감염시키는 양성 감각의 단일 가닥 RNA 바이러스이며, RNA 사일런싱은 광범위하고 견고한 항바이러스 방어 시스템을 형성합니다.p19 단백질은 RNA 사일링 시스템에서 작은 간섭 RNA(siRNA)로 기능하는 19~21-뉴클레오티드 이중가닥 RNA를 결합하는 대항 방어 전략으로 작용한다.p19는 siRNA를 분리함으로써 RNA 사일런싱을 억제하고 바이러스 [1][2][3]증식을 촉진한다.p19 단백질은 중요한 독성[4] 인자로 간주되며 식물과 [5]그 병원체 사이의 진화적 군비 경쟁의 구성요소로 간주됩니다.
구조.
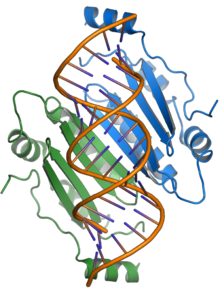
p19 단백질은 그것의 크기에서 이름을 얻었는데, 그것은 약 19킬로달톤이었다.그것은 기능적 호모디머를 형성한다.그 결정 구조는 토마토 덤불 성장 위축 virus[1]과 카네이션 이탈리아의 둥근 무늬 바이러스로부터p19 단백질의;[2]은 단백질 소설 단백질 접고, 2중 가닥 R과 상호 작용할 구속력이 있는 표면은 베타 시트로 알파 및 나선형이 옆에 형성된를 사용하여 RNA결합한 이전의 알려지지 않은 메커니즘의 좋은 예로 사용할 수 있NAs하는 of 비배열 특이적 [1][2][7]방식으로 길이가 약 21개의 뉴클레오티드.
기능.
p19 단백질은 짧은 간섭 RNA(siRNA)로 기능하는 이중 가닥 RNA에 결합하고 DCL4 효소(Dicer와 [7]호몰로지를 가진 식물 효소군의 구성원)의 21-뉴클레오티드 생성물에 특화된다.p19는 siRNA에 결합함으로써 이들 종을 격리하고 세포 내의 항바이러스 RNA 사일런싱 메커니즘을 매개하는 단백질 복합체인 RNA 유도 사일런싱 복합체(RISC)와 상호작용하는 것을 방지한다.
p19 단백질은 또한 숙주 세포에 내생적인 마이크로 RNA 분자와 궁극적으로 바이러스 자신의 게놈에서 파생된 siRNA와 결합할 수 있다.특히 이 패턴의 예외는 아르고나이트-1(AGO1)의 발현을 억제하는 조절 비부호화 RNA인 마이크로RNA miR-168과의 상호작용에서 p19의 비효율성이다.AGO1 단백질은 RNA 소음화에 필요하며, 따라서 p19의 miRNA의 일반적인 격리로부터 선택적으로 억제제를 제거하는 것은 세포 AGO1 수치를 감소시키는 효과가 있으며, p19가 소음화를 [5][8]억제하는 추가적인 메커니즘이다.두 메커니즘은 서로 독립적이며 [9]돌연변이에 의해 선택적으로 폐기될 수 있습니다.
진화
p19 단백질을 코드하는 유전자는 과잉 인쇄된 유전자의 한 예로서, 여러 유전자가 번갈아 판독 [10][11]프레임에서 읽혀지는 게놈의 같은 부분에 의해 코드되는 바이러스에서 공통되는 게놈 배열이다.p19를 코드하는 개방판독범위 ORF4는 ORF3로 지정되어 이동단백질 p22를 코드하는 다른 유전자의 개방판독범위 내에 완전히 포함되어 있다.두 유전자와 그들의 상대적 위치는 톰버스 바이러스 [4][11]계열 내에 보존되어 있다.P19는 이 [11][12]계통의 de novo에서 유래한 것으로 생각된다.
dsRNA의 격리는 바이러스와 [5]숙주 사이의 진화적 군비 경쟁의 형태로 진화한 RNA 소음에 대한 일반적인 바이러스 대응 전략입니다.p19 단백질은 이 역할에서 독특하지 않다; 수렴 진화의 예에서, 이 전략은 RNA와 [3][13][14]결합하는 별개의 구조와 물리적 수단을 가진 단백질을 사용하여 별개의 바이러스 계통에서 적어도 세 번 진화한 것으로 보인다.
역사
토마토 부쉬 스턴트 바이러스는 말괄량이 바이러스의 한 종류로 식물 바이러스를 연구하는 오랜 모델 시스템이다.p19를 코드하는 공개 판독 프레임은 바이러스의 게놈이 배열된 1980년대 말에 처음 발견되었고, 이후 예측된 단백질이 독성과 감염성을 촉진하는 데 있어 처음에는 그 역할이 인정되지 않았지만 유전자로부터 실제로 발현되었다는 것이 입증되었다.p19는 RNA 사일링 억제제로서의 역할에 대한 설명에 따라 RNA 사일링, RNA 간섭 및 관련 [4][6]과정에 대한 분자생물학 연구에서도 도구로 사용되어 왔다.
레퍼런스
- ^ a b c d e Ye K, Malinina L, Patel DJ (December 2003). "Recognition of small interfering RNA by a viral suppressor of RNA silencing". Nature. 426 (6968): 874–8. Bibcode:2003Natur.426..874Y. doi:10.1038/nature02213. PMC 4694583. PMID 14661029.
- ^ a b c Vargason JM, Szittya G, Burgyán J, Hall TM (December 2003). "Size selective recognition of siRNA by an RNA silencing suppressor". Cell. 115 (7): 799–811. doi:10.1016/S0092-8674(03)00984-X. PMID 14697199. S2CID 12993441.
- ^ a b Lakatos L, Szittya G, Silhavy D, Burgyán J (February 2004). "Molecular mechanism of RNA silencing suppression mediated by p19 protein of tombusviruses". The EMBO Journal. 23 (4): 876–84. doi:10.1038/sj.emboj.7600096. PMC 381004. PMID 14976549.
- ^ a b c Scholthof HB (May 2006). "The Tombusvirus-encoded P19: from irrelevance to elegance". Nature Reviews. Microbiology. 4 (5): 405–11. doi:10.1038/nrmicro1395. PMID 16518419. S2CID 30361458.
- ^ a b c Pumplin N, Voinnet O (November 2013). "RNA silencing suppression by plant pathogens: defence, counter-defence and counter-counter-defence". Nature Reviews. Microbiology. 11 (11): 745–60. doi:10.1038/nrmicro3120. PMID 24129510. S2CID 205498691.
- ^ a b Danielson DC, Pezacki JP (April 2013). "Studying the RNA silencing pathway with the p19 protein". FEBS Letters. 587 (8): 1198–205. doi:10.1016/j.febslet.2013.01.036. PMID 23376479.
- ^ a b Ding SW, Voinnet O (August 2007). "Antiviral immunity directed by small RNAs". Cell. 130 (3): 413–26. doi:10.1016/j.cell.2007.07.039. PMC 2703654. PMID 17693253.
- ^ Várallyay E, Válóczi A, Agyi A, Burgyán J, Havelda Z (October 2010). "Plant virus-mediated induction of miR168 is associated with repression of ARGONAUTE1 accumulation". The EMBO Journal. 29 (20): 3507–19. doi:10.1038/emboj.2010.215. PMC 2964164. PMID 20823831.
- ^ Várallyay É, Oláh E, Havelda Z (January 2014). "Independent parallel functions of p19 plant viral suppressor of RNA silencing required for effective suppressor activity". Nucleic Acids Research. 42 (1): 599–608. doi:10.1093/nar/gkt846. PMC 3874164. PMID 24062160.
- ^ Scholthof HB, Scholthof KB, Kikkert M, Jackson AO (November 1995). "Tomato bushy stunt virus spread is regulated by two nested genes that function in cell-to-cell movement and host-dependent systemic invasion". Virology. 213 (2): 425–38. doi:10.1006/viro.1995.0015. PMID 7491767.
- ^ a b c Rancurel C, Khosravi M, Dunker AK, Romero PR, Karlin D (October 2009). "Overlapping genes produce proteins with unusual sequence properties and offer insight into de novo protein creation". Journal of Virology. 83 (20): 10719–36. doi:10.1128/JVI.00595-09. PMC 2753099. PMID 19640978.
- ^ Sabath N, Wagner A, Karlin D (December 2012). "Evolution of viral proteins originated de novo by overprinting". Molecular Biology and Evolution. 29 (12): 3767–80. doi:10.1093/molbev/mss179. PMC 3494269. PMID 22821011.
- ^ Lakatos L, Csorba T, Pantaleo V, Chapman EJ, Carrington JC, Liu YP, Dolja VV, Calvino LF, López-Moya JJ, Burgyán J (June 2006). "Small RNA binding is a common strategy to suppress RNA silencing by several viral suppressors". The EMBO Journal. 25 (12): 2768–80. doi:10.1038/sj.emboj.7601164. PMC 1500863. PMID 16724105.
- ^ Voinnet O (March 2005). "Induction and suppression of RNA silencing: insights from viral infections". Nature Reviews. Genetics. 6 (3): 206–20. doi:10.1038/nrg1555. PMID 15703763. S2CID 26351712.