숙시닐코엔자임A합성효소
Succinyl coenzyme A synthetase| 석신산염: CoA 연결효소(GDP 형성) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 6.2.1.4 | ||||||||
| CAS 번호 | 9014-36-2 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
| 석신산염: CoA 연결효소(ADP 형성) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 6.2.1.5 | ||||||||
| CAS 번호 | 9080-33-5 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
숙시닐 코엔자임 A 합성효소(SCS, 숙시닐-CoA 합성효소 또는 숙시닐-CoA 연결효소라고도 함)는 숙시닐-CoA의 가역 반응을 촉매하여 숙시닐-CoA를 [3]숙시네이트로 만드는 효소이다.효소는 무기 인산염 분자와 뉴클레오시드 이인산 분자(GDP 또는 ADP)로부터 뉴클레오시드 삼인산 분자(GTP 또는 ATP)의 형성에 대한 이러한 반응의 결합을 촉진한다.그것은 세포 대사의 중심 경로인 구연산 회로에 관여하는 촉매 중 하나로 중요한 역할을 하며,[4] 세포의 미토콘드리아 매트릭스 내에 위치한다.
화학반응 및 효소 메커니즘
숙시닐 CoA 합성효소는 다음과 같은 가역 반응을 촉매한다.
- 숙시닐 CoA + Pi + NDP ↔ 숙시네이트 + CoA + NTP
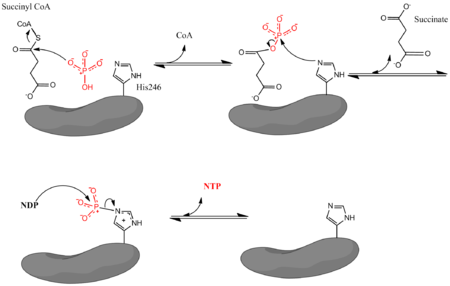
여기서 Pi는 무기인산염, NDP는 뉴클레오시드2인산염(GDP 또는 ADP), NTP는 뉴클레오시드3인산염(GTP 또는 ATP)을 나타낸다.상기 효소는 NDP 및 Pi로부터의 NTP 형성과 숙시닐 CoA의 석신산 전환 결합을 촉진한다.이 반응은 생화학 표준 상태 자유 에너지 변화가 -3.4 kJ/[4]mol이다.이 반응은 아래 그림에 나와 있는 3단계[3] 메커니즘에 의해 발생합니다.첫 번째 단계는 친핵성 무기 인산 분자에 의한 숙시닐 CoA로부터의 CoA 치환을 수반하여 숙시닐 인산염을 형성한다.그런 다음 효소는 히스티딘 잔기를 이용하여 인산숙시닐로부터 인산기를 제거하고 숙신산을 생성한다.마지막으로 인산화히스티딘은 인산기를 뉴클레오시드2인산에 전달하고, 뉴클레오시드3인산은 고에너지를 운반하는 뉴클레오시드3인산을 생성한다.
구조.
서브유닛
세균 및 포유류의 SCS는 α 및 β 서브유닛으로 [5]구성된다.대장균에서 두 개의 αβ 헤테로디머가 서로 연결되어 αβ22 헤테로테라믹 구조를 형성한다.그러나 포유류의 미토콘드리아 SCS는 αβ 이합체로서 활성화되어 헤테로테트레이머를 [6]형성하지 않는다.대장균 헤테로테트라머는 결정화되어 매우 [6][7]상세하게 특징지어졌습니다.그림 2에서 볼 수 있듯이, 2개의 α 서브 유닛(분홍과 녹색)은 구조의 반대편에 있고, 2개의 β 서브 유닛(노란색과 파란색)은 단백질의 중간 영역에 상호작용한다.두 개의 α 서브유닛은 단일 β 단위와만 상호작용하는 반면, β 단위는 단일 α 단위(αβ 이합체를 형성하기 위해) 및 다른 α 이합체의 [6]β 서브유닛과 상호작용한다.짧은 아미노산 사슬은 사량체 구조를 일으키는 두 개의 β 서브유닛을 연결한다.
숙시닐-CoA 합성효소 알파 서브유닛(숙시닐-CoA 결합 아이소폼)의 결정 구조는 조이스 등에 의해 2.10A의 분해능으로 측정되었으며 PDB 코드는 1CQJ. [1][8]이었다.
촉매 잔류물
대장균 SCS의 결정 구조는 조효소 A가 히스티딘 잔기(His246α)[7]에 근접하게 각 α-서브유닛(로스만 폴드 내) 내에 결합한다는 증거를 제공한다.이 히스티딘 잔기는 반응 메커니즘의 석신산염 형성 단계에서 인산화된다.석신산염의 정확한 결합 위치는 잘 [9]정의되지 않았습니다.뉴클레오시드 삼인산의 형성은 각 β 서브유닛의 N 말단 근처에 위치한 ATP 파악 도메인에서 일어난다.단, 이 파악 도메인은 인산화 히스티딘 [8]잔기로부터 약 35Ω 떨어져 있다.이것은 연구자들이 히스티딘을 쥐는 영역으로 가져오고 뉴클레오시드 삼인산의 형성을 촉진하기 위해 효소가 반드시 큰 구성 변화를 겪어야 한다고 믿게 한다.돌연변이 유발 실험은 두 개의 글루탐산 잔류물(촉매 히스티딘 근처, 글루208α와 ATP 파악 도메인 근처, 글루197β)이 히스티딘의 인산화 및 탈인산화에서 역할을 한다는 것을 확인했지만, 효소가 구조를 바꾸는 정확한 메커니즘은 완전히 [9]이해되지 않았다.
Isoforms
존슨 등은 포유동물에서 숙시닐-CoA 합성효소의 두 가지 동질 형태를 설명한다. 하나는 ADP 합성을 지정하고 다른 하나는 [10]GDP를 합성한다.
포유동물에서 효소는 α- 및 β-서브유닛의 헤테로다이머이다.아데노신 또는 구아노신 인산염의 특이성은 β-서브유닛에 의해 정의되며, β-서브유닛은 [10]2개의 유전자에 의해 암호화된다.SUCLG2는 GTP 특이적이고 SUCLA2는 ATP 특이적이며, SUCLG1은 공통 α-서브유닛을 암호화한다.β 변종은 조직마다 [10]다른 양으로 생성되어 GTP 또는 ATP 기질 요건을 유발한다.
심장 및 뇌와 같은 대부분 소비되는 조직은 더 많은 ATP 특이적 숙시닐-CoA 합성효소(ATPS)[11]를 가지고 있는 반면, 신장 및 간과 같은 합성 조직은 더 많은 GTP 특이적 형태를 가지고 있다.비둘기 가슴 근육의 ATPSCS와 비둘기 간의 GTPSCS의 역학적 분석 결과, 비둘기들의 겉으로 보이는 미카엘리스 상수는 CoA에 유사하지만 뉴클레오티드, 인산염, 석신산염에 대해서는 달랐다.가장 큰 차이는 석신산염이었다. ATPSCS = 5mM의 [10]Kappm 대 GTPSCS = 0.5mM의 차이였다.
기능.
뉴클레오시드 삼인산염 생성
SCS는 뉴클레오시드 삼인산(GTP 또는 ATP)이 기질 수준 인산화에 [4]의해 형성되는 반응을 촉매하는 구연산 회로에서 유일한 효소이다.연구에 따르면 대장균 SCS는 GTP 또는 ATP [7]형성을 촉진할 수 있다.하지만, 포유류는 GTP나 ATP에 특유한 다른 종류의 SCS를 가지고 있고 유기체 내의 다른 종류의 조직에 고유합니다.비둘기 세포를 사용한 흥미로운 연구는 GTP 특이 SCS가 비둘기 간 세포에 있고 ATP 특이 SCS가 비둘기 가슴 근육 [12]세포에 있다는 것을 보여주었다.추가 연구는 쥐, 쥐, 인간 조직에서 GTP와 ATP 특이 SCS의 유사한 현상을 밝혀냈다.전형적으로 동화 대사에 관여하는 조직(간이나 신장 등)은 G-SCS를 나타내는 반면, 이화 대사에 관여하는 조직(뇌, 심장, 근육 조직 등)은 [11]A-SCS를 나타내는 것으로 보인다.
대사 중간체 형성
SCS는 숙시닐 CoA와 [13]숙신산염 사이의 상호 변환을 제어함으로써 분자의 다른 대사 경로로의 플럭스를 촉진합니다.숙시닐 CoA는 포르피린, 헴,[14] 케톤체 [15]생합성에 필요한 중간체이기 때문에 이것은 중요하다.
규제 및 억제
일부 박테리아에서는 효소가 전사 [16]수준에서 조절된다.SCS(sucCD)의 유전자는 숙신산탈수소효소 오퍼론의 일부인 sdhC라고 하는 프로모터의 제어 하에 α-케토글루타르산탈수소효소(sucAB)의 유전자와 함께 전사되는 것이 확인되었다.이 오퍼론은 산소의 존재에 의해 상향 조절되며 다양한 탄소 공급원에 반응합니다.LY26650 분자와 같이 히스티딘의 인산화를 막는 항균제는 박테리아 SCS의 [17]강력한 억제제이다.
최적의 액티비티
측정(콩 SCS를 사용하여 수행)은 37°C의 최적 온도와 7.0-8.[18]0의 최적 pH를 나타냅니다.
질병에서의 역할
치명적인 유아 젖산증:SCS의 결함은 젖산의 독성 수치가 축적되는 것이 특징인 유아기 질병인 치명적인 영아 젖산증의 원인으로 밝혀졌다.(가장 심할 때) 이 질환은 보통 [19]생후 2-4일 이내에 사망에 이르게 된다.이 [19]질환의 환자는 SCS의 α 서브유닛을 코드하는 SUCLG1로 알려진 유전자 내에서 2개의 염기쌍 결실을 보이는 것으로 확인되었다.그 결과 대사 중에 기능성 SCS가 없어져 해당과정과 구연산회로 사이의 플럭스의 큰 불균형이 초래된다.세포들은 기능적인 구연산 순환을 가지고 있지 않기 때문에, 세포들이 ATP를 생산하는 주요 수단으로 젖산 생산을 선택하도록 강요당하기 때문에 산증이 발생한다.
「 」를 참조해 주세요.
레퍼런스
- ^ Fraser ME, Hayakawa K, Hume MS, Ryan DG, Brownie ER (Apr 2006). "Interactions of GTP with the ATP-grasp domain of GTP-specific succinyl-CoA synthetase". The Journal of Biological Chemistry. 281 (16): 11058–65. doi:10.1074/jbc.M511785200. PMID 16481318.
- ^ Fraser ME, James MN, Bridger WA, Wolodko WT (Jan 1999). "A detailed structural description of Escherichia coli succinyl-CoA synthetase". Journal of Molecular Biology. 285 (4): 1633–53. doi:10.1006/jmbi.1998.2324. PMID 9917402.
- ^ a b Voet, Donald J. (2011). Biochemistry / Donald J. Voet ; Judith G. Voet. New York, NY: Wiley, J. ISBN 978-0-470-57095-1.
- ^ a b c Berg, Jeremy M. (Jeremy M.); Tymoczko, John L.; Stryer, Lubert.; Stryer, Lubert. Biochemistry. (2002). Biochemistr. New York: W.H. Freeman. pp. 475–477. ISBN 0-7167-3051-0.
- ^ Nishimura JS (1986). "Succinyl-CoA synthetase structure-function relationships and other considerations". Advances in Enzymology and Related Areas of Molecular Biology. Advances in Enzymology and Related Areas of Molecular Biology. Vol. 58. pp. 141–72. doi:10.1002/9780470123041.ch4. ISBN 9780470123041. PMID 3521216.
- ^ a b c Wolodko WT, Kay CM, Bridger WA (Sep 1986). "Active enzyme sedimentation, sedimentation velocity, and sedimentation equilibrium studies of succinyl-CoA synthetases of porcine heart and Escherichia coli". Biochemistry. 25 (19): 5420–5. doi:10.1021/bi00367a012. PMID 3535876.
- ^ a b c Fraser ME, James MN, Bridger WA, Wolodko J (May 1999). "A detailed structural description of escherichia coli succinly-CoA synthetase". Journal of Molecular Biology. 288 (3): 501. doi:10.1006/jmbi.1999.2773. PMID 10329157.
- ^ a b Joyce MA, Fraser ME, James MN, Bridger WA, Wolodko WT (Jan 2000). "ADP-binding site of Escherichia coli succinyl-CoA synthetase revealed by x-ray crystallography". Biochemistry. 39 (1): 17–25. doi:10.1021/bi991696f. PMID 10625475.
- ^ a b Fraser ME, Joyce MA, Ryan DG, Wolodko WT (Jan 2002). "Two glutamate residues, Glu 208 alpha and Glu 197 beta, are crucial for phosphorylation and dephosphorylation of the active-site histidine residue in succinyl-CoA synthetase". Biochemistry. 41 (2): 537–46. doi:10.1021/bi011518y. PMID 11781092.
- ^ a b c d Johnson JD, Mehus JG, Tews K, Milavetz BI, Lambeth DO (Oct 1998). "Genetic evidence for the expression of ATP- and GTP-specific succinyl-CoA synthetases in multicellular eucaryotes". The Journal of Biological Chemistry. 273 (42): 27580–6. doi:10.1074/jbc.273.42.27580. PMID 9765291.
- ^ a b Lambeth DO, Tews KN, Adkins S, Frohlich D, Milavetz BI (Aug 2004). "Expression of two succinyl-CoA synthetases with different nucleotide specificities in mammalian tissues". The Journal of Biological Chemistry. 279 (35): 36621–4. doi:10.1074/jbc.M406884200. PMID 15234968.
- ^ Johnson JD, Muhonen WW, Lambeth DO (Oct 1998). "Characterization of the ATP- and GTP-specific succinyl-CoA synthetases in pigeon. The enzymes incorporate the same alpha-subunit". The Journal of Biological Chemistry. 273 (42): 27573–9. doi:10.1074/jbc.273.42.27573. PMID 9765290.
- ^ Labbe RF, Kurumada T, Onisawa J (Dec 1965). "The role of succinyl-CoA synthetase in the control of heme biosynthesis". Biochimica et Biophysica Acta (BBA) - General Subjects. 111 (2): 403–15. doi:10.1016/0304-4165(65)90050-4. PMID 5879477.
- ^ Ottaway JH, McClellan JA, Saunderson CL (1981). "Succinic thiokinase and metabolic control". The International Journal of Biochemistry. 13 (4): 401–10. doi:10.1016/0020-711x(81)90111-7. PMID 6263728.
- ^ Jenkins TM, Weitzman PD (Sep 1986). "Distinct physiological roles of animal succinate thiokinases. Association of guanine nucleotide-linked succinate thiokinase with ketone body utilization". FEBS Letters. 205 (2): 215–8. doi:10.1016/0014-5793(86)80900-0. PMID 2943604. S2CID 23667115.
- ^ Kruspl W, Streitmann B (Feb 1975). "[Knotty reticulosis with keloid formation]". Zeitschrift für Hautkrankheiten. 50 (3): 117–25. PMID 179232.
- ^ Hunger-Glaser I, Brun R, Linder M, Seebeck T (May 1999). "Inhibition of succinyl CoA synthetase histidine-phosphorylation in Trypanosoma brucei by an inhibitor of bacterial two-component systems". Molecular and Biochemical Parasitology. 100 (1): 53–9. doi:10.1016/s0166-6851(99)00032-8. PMID 10376993.
- ^ Wider de Xifra E, del C Batlle AM (Mar 1978). "Porphyrin biosynthesis: immobilized enzymes and ligands. VI. Studies on succinyl CoA synthetase from cultured soya bean cells". Biochimica et Biophysica Acta. 523 (1): 245–9. doi:10.1016/0005-2744(78)90027-x. PMID 564714.
- ^ a b Ostergaard E, Christensen E, Kristensen E, Mogensen B, Duno M, Shoubridge EA, Wibrand F (Aug 2007). "Deficiency of the alpha subunit of succinate-coenzyme A ligase causes fatal infantile lactic acidosis with mitochondrial DNA depletion". American Journal of Human Genetics. 81 (2): 383–7. doi:10.1086/519222. PMC 1950792. PMID 17668387.
외부 링크
- 미국 국립 의학 도서관 의학 주제 제목(MeSH)에서 숙시닐+코엔자임+A+합성효소