크롬(Chromium)II) 불소화
Chromium(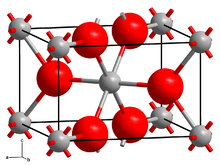 | |
| 이름 | |
|---|---|
| 기타 이름 이플루오르화 크롬, 플루오르화 크롬, 플루오르화 크롬 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.030.140 |
| EC 번호 |
|
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| CRF2 | |
| 어금질량 | 89.9929 g·190−1 |
| 외관 | 청녹색 무지개빛 결정체[1] 공기[1] 중에 가열되면 CrO로23 회전 |
| 밀도 | 3.79 g/cm3[1] |
| 녹는점 | 894°C(1,641°F, 1,167K)[1] |
| 비등점 | > 1,300 °C (2,370 °F; 1,570 K)[1] |
| 76.7 g/100 mL | |
| 구조 | |
| 단색의[1] | |
| 열화학 | |
의 성 엔탈피 대형화 (ΔfH⦵298) | -8.645 kJ/g(고체) |
| 위험 | |
| GHS 라벨 표시: | |
  | |
| 위험 | |
| H314 | |
| P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 | |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
크롬(Chromium)II) 불소는 CrF라는 공식을2 가진 무기 화합물이다. 그것은 청록색 무지개빛 고체로 존재한다. 크롬(Chromium)II) 플루오르화물은 알코올에 거의 불용성인 물에 거의 용해되지 않고 끓는 염산에 용해되지만 뜨거운 증류 황산이나 질산에 의해 공격받지 않는다. 다른 크롬 화합물들과 마찬가지로 크롬도()II) 불소는 공기 중에 크롬(III) 산화물로 산화된다.[2]
준비 및 구조
화합물은 무수 수소 불소를 무수 크롬 위에 통과시켜 준비한다().II) 염화물. 반응은 상온에서 진행되지만 일반적으로 100~200 °C까지 가열되어 완성이 보장된다.[3]
- CrCl2 + 2HF → CrF2 + 2HCl
많은 이플루오르화물과 마찬가지로, CrF는2 Cr(II)에 관한 팔면체 분자 기하학과 F에− 삼각형 기하학을 가진 루틸레와 같은 구조를 채택한다. 6개의 Cr-F 채권 중 2개는 2.43 å로 긴데 4개는 2.00 00에 가까운 짧은 것이다.[4]
참고 항목
외부 링크
참조
- ^ a b c d e f Perry, Dale L. (2011). Handbook of Inorganic Compounds, Second Edition. Boca Raton, Florida: CRC Press. p. 120. ISBN 978-1-43981462-8. Retrieved 2014-01-10.
- ^ 머크 지수, 14 ED 2245 항목
- ^ Riley, edited by Georg Brauer ; translated by Scripta Technica, Inc. Translation editor Reed F. (1963). Handbook of preparative inorganic chemistry. Volume 1 (2nd ed.). New York, N.Y.: Academic Press. p. 256. ISBN 978-0121266011.
{{cite book}}:first=일반 이름 포함(도움말) - ^ 잭, K. H.; Maitland, R. "크롬과 크롬 불소의 결정 구조와 원자간 결합" 런던(1957), 232. 도이:10.1039/PS9570000217


