일산화탄소
Phosphorus monoxide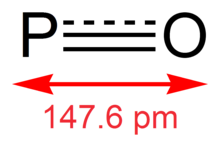 | |
 | |
| 이름 | |
|---|---|
| 기타 이름 옥소인산염, 산화인산염(.); 인포릴 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
| 416 | |
펍켐 CID | |
CompTox 대시보드 (EPA) | |
| 특성. | |
| PO | |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
일산화탄소는 분자 공식 PO를 가진 불안정한 급진적 무기 화합물이다.[2]
일산화탄소는 지구 밖에서 인이 검출된 몇 안 되는 분자 화합물 중 하나로 주목할 만하다. 우주에서 발견된 분자를 포함한 다른 인에는 PN, PC, PC2, HCP, PH3 등이 있다. 그것은 VY Canis Majoris의 항성 쉘과 AFGL 5142로 분류된 항성 형성 지역에서 감지되었다. 이 화합물은 처음에 항성형성 지역에서 생산된 것으로 밝혀졌으며, 초기 지구를 포함한 우주 공간 전체에 걸쳐 성간 혜성에 의해 운반된 것으로 추측되고 있다.[2][3][4]
일산화탄소는 인의 인광에 역할을 한다.
디스커버리
1894년 W. N. Hartley는 인화 화합물에서 나온 자외선 방출에 대한 관측을 최초로 보고했으며, 후에 Geuter에 의해 확대되었다. 스펙트럼 라인과 띠의 근원은 인과 관계가 있는 것으로 알려졌으나 정확한 성질은 알 수 없었다. 1927년 H. J. 에멜레우스와 R. H. 퍼셀은 원인이 산화 인이라고 판단했다. 그러나 P.N.고쉬와 G.N.볼이 산화물을 일산화탄소 인이라고 판단한 것은 1921년이었다.[5]
일산화탄소는 성간 구름에서 발견되는 가장 풍부한 인 함유 분자로 여겨진다.[6] 인은 1998년 연구자들이 수소 대 수소(P/H)의 우주비율이 약 3×10인−7 것을 발견한 후 우주적으로 풍부한 원소로 확인되었다. 성간 구름에서 인이 유행하고 있음에도 불구하고 극히 적은 수의 출처에서 인을 함유하는 분자가 확인되고 발견되었는데, 1987년 IRC +10215의 탄소 함량 봉투에서 질화 인, PN, 자유 급진 CP가 발견되었다. 이것은 분자를 포함한 인이 성간 공간에서 더 많이 발견되어야 한다는 것을 시사했다. 초거성 별 VY Canis Majoris(VY CMajoris, VY CMa)의 산소가 풍부한 껍데기를 검사하는 과정에서 PO의 존재가 검출되었다. VY CMa는 아리조나 전파 관측소(ARO)의 서브밀리미터 망원경(SMT)을 사용하여 연구되었다. 그 망원경은 PO의 회전 주파수를 관찰할 수 있었다. ARO의 10m SMT는 240GHz에서 J=5.5→4.5, 284GHz에서 J=6.5→5.5를 보이는 PO가 각각 잘 정의된 람다-더블트로 구성된 진화된 별을 향해 회전 전환을 측정할 수 있었다. 2001년 VY CMa 슈퍼자이언트(Supergiant)의 외피를 향한 PO가 검출된 이후, PO는 훨씬 더 많은 성간 구름에서 발견되었고 산소가 풍부한 껍질 주변에서 풍부하게 발견되고 있다.[7]
포메이션
PO는 산소나 오존에서 인이 연소될 때 형성된다. 뜨거운 불꽃에서 관찰되는 과도성 분자로, 혹은 고귀한 기체 행렬로 응축될 수 있다.[8] PO는 인산염황화 PSO의43 광분해에서 불활성 가스 매트릭스에서 형성될 수 있다.[9]
지구에서는 일산화탄소가 화염에 인산을 분사하여 연구할 준비를 할 수 있다. 상업용 아세틸렌 가스는 일부 인광을 함유하고 있기 때문에 옥시 아세틸렌 불꽃은 그 스펙트럼에도 약한 PO 방출 대역을 가질 것이다. 불꽃 속에서 PO는 다시 PO로410 산화한다.[10]
반응
인광체
백인이 산화하면서 녹백색을 발한다. 광선은 PO + O• → PO2; 또는 PO + O → PO2 + O의2• 반응에 의해 산화될 때 발생한다.[11] 이 과정에서 PO가 나타나는 가능한 방법은 PO에서4 나올 수 있는 PO2 분자의 분열이다.[12]
리간드
일산화탄소는 몰리브데넘, 루테늄, 오스뮴과 같은 전이 요소에서 리간드로 작용할 수 있다. 인은 금속과 3중 결합을 이룬다.[13][14] 가장 먼저 발견된 것은 니켈-텅스텐 성단이었다. WNiP22 군집은 과산화수소에 의해 산화되어 μ-조정을3 이루었는데, 여기서 각 인 원자는 세 개의 금속 원자에 묶여 있다.[15]
특성.
본드
일산화탄소는 인이 산소에 이중 결합되고 인이 비장해 발란스 전자가 있는 자유 급진이다. 채권 순서는 약 1.8이다.[5] PO의 P=O 결합은 6.4 eV의 분리에너지를 가진다.[16] PO 더블 본드의 본드 길이는 1.476 å이며, 자유 PO는 본드의 스트레칭으로 인해 1220 cm의−1 적외선 진동수를 보인다.[17] PO의 자유로운 급진적 성질은 더욱 산화된 다른 인산염에 비해 반응성이 높고 불안정하다.
스펙트럼
일산화탄소의 자외선 스펙트럼에 보이는 것은 세 가지 중요한 띠를 가지고 있다. 540nm에 가까운 연속체 띠가 있다. 324 nm 부근의 β-시스템은 Dς2→2π 전환에 기인한다. γ 시스템은 Aς2→2THW 전환으로 인해 246 nm에 가까운 띠를 가진다. 이 밴드의 피크는 자외선 230, 238, 246, 253, 260nm에서 발생한다. 이 모든 대역은 조명 및 온도에 따라 방출, 흡수 또는 형광 등이 될 수 있다.[10] C'2Δ 상태도 있다.[18]
γ-system 밴드는 다른 진동 변화를 기반으로 하여 서브밴드로 분해할 수 있다. (0,0), (0,1) 및 (1,0)은 전자적 전환이 일어날 때 두 진동 상태 사이의 전환에 의해 생성되는 서브 멀티플렉스에 대한 지정이다. 이들 각각에는 8개의 직렬로 불리는 가지가 있다. 이것들은12 P, P2, Q2, R2, P1, Q1, R1, R이다21.[19]
분자
PO의 이온화 잠재력은 8.39 eV이다. 이온화되면 PO는 cation PO를+ 형성한다. PO의 부전자 친화력은 1.09 eV이다. 전자를 얻으면 PO− 이온이 형성된다.[5]
r은e 1.4763735 35이다.[5]
분자의 쌍극자 모멘트는 1.88D이다. 인 원자는 전자의 0.35로 계산된 약간의 양의 전하를 가지고 있다.[5]
참고 항목
참조
- ^ Staff (2018). "Phosphorus monoxide - NIST Chemistry WebBook, SRD 69". National Institute of Standards and Technology. Retrieved 19 January 2020.
- ^ Jump up to: a b Staff (2019). "Phosphorus Monoxide". Encyclopedia of Astrobiology. pp. 1229–1230. doi:10.1007/978-3-642-11274-4_1889. ISBN 978-3-642-11271-3.
- ^ ESO (15 January 2020). "Astronomers reveal interstellar thread of one of life's building blocks". Phys.org. Retrieved 15 January 2020.
- ^ Rivilla, V. M.; et al. (2019). "ALMA and ROSINA detections of phosphorus-bearing molecules: the interstellar thread between star-forming regions and comets". Monthly Notices of the Royal Astronomical Society. 492: 1180–1198. arXiv:1911.11647. doi:10.1093/mnras/stz3336.
- ^ Jump up to: a b c d e Moussaoui, Yahia; Ouamerali, Ourida; De Maré, George R. (October 2003). "Properties of the phosphorus oxide radical, PO, its cation and anion in their ground electronic states: comparison of theoretical and experimental data". International Reviews in Physical Chemistry. 22 (4): 641–675. doi:10.1080/01442350310001617011. S2CID 93981281.
- ^ Scherer, Otto J.; Braun, Jürgen; Walther, Peter; Heckmann, Cert; Wolmershäuser, Gotthel (July 1991). "Phosphorus Monoxide(PO) as Complex Ligand". Angewandte Chemie International Edition in English. 30 (7): 852–854. doi:10.1002/anie.199108521.
- ^ Tenenbaum, E. D.; Woolf, N. J.; Ziurys, L. M. (1 September 2007). "Identification of Phosphorus Monoxide (X2Πr) in VY Canis Majoris: Detection of the First P–O Bond in Space". The Astrophysical Journal. 666 (1): L29–L32. Bibcode:2007ApJ...666L..29T. doi:10.1086/521361.
- ^ Mielke, Zofia; McCluskey, Matthew; Andrews, Lester (January 1990). "Matrix reactions of P2 and O3 molecules". Chemical Physics Letters. 165 (2–3): 146–154. Bibcode:1990CPL...165..146M. doi:10.1016/0009-2614(90)85420-H.
- ^ Mielke, Zofia; Andrews, Lester; Nguyen, Kiet A.; Gordon, Mark S. (December 1990). "Matrix-infrared spectra of structural isomers of the phosphorus oxysulfide P4S3O". Inorganic Chemistry. 29 (25): 5096–5100. doi:10.1021/ic00350a016.
- ^ Jump up to: a b Haraguchi, H.; Fowler, W.K.; Johnson, D.J.; Winefordner, J.D. (January 1976). "Molecular fluorescence spectroscopy of phosphorus monoxide in flames studied by a SIT-OMA system". Spectrochimica Acta Part A: Molecular Spectroscopy. 32 (9): 1539–1544. Bibcode:1976AcSpA..32.1539H. doi:10.1016/0584-8539(76)80200-0.
- ^ Qian, Hai-Bo; Davies, Paul B.; Hamilton, Peter A. (1995). "High-resolution spectroscopic study of the oxidation of white phosphorus". Journal of the Chemical Society, Faraday Transactions. 91 (18): 2993. doi:10.1039/ft9959102993.
- ^ Andrews, Lester.; Withnall, Robert. (August 1988). "Matrix reactions of oxygen atoms with P4. Infrared spectra of P4O, P2O, PO and PO2". Journal of the American Chemical Society. 110 (17): 5605–5611. doi:10.1021/ja00225a001.
- ^ Wang, Weibin; Corrigan, John F.; Doherty, Simon; Enright, Gary D.; Taylor, Nicholas J.; Carty, Arthur J. (January 1996). "Phosphorus Monoxide Coordination Chemistry: Synthesis and Structural Characterization of Tetranuclear Clusters Containing a PO Ligand". Organometallics. 15 (12): 2770–2776. doi:10.1021/om960032o.
- ^ Johnson, Marc J. A.; Odom, Aaron L.; Cummins, Christopher C. (1997). "Phosphorus monoxide as a terminal ligand". Chemical Communications (16): 1523–1524. doi:10.1039/A703105J.
- ^ Herrmann, Wolfgang A. (July 1991). "Between Stars and Metals: Phosphorus Monoxide, PO". Angewandte Chemie International Edition in English. 30 (7): 818–819. doi:10.1002/anie.199108181.
- ^ Haraguchi, Hiroki.; Fuwa, Keiichiro. (May 2002). "Determination of phosphorus by molecular absorption flame spectrometry using the phosphorus monoxide band". Analytical Chemistry. 48 (4): 784–786. doi:10.1021/ac60368a024.
- ^ Bérces, Attila; Koentjoro, Olivia; Sterenberg, Brian T.; Yamamoto, John H.; Tse, John; Carty, Arthur J. (October 2000). "Electronic Structures of Transition Metal Phosphorus Monoxide Complexes". Organometallics. 19 (21): 4336–4343. doi:10.1021/om000274v.
- ^ de Brouckère, G. (December 2000). "Configuration interaction calculations of miscellaneous properties of the C'2Δ excited state and related C'2Δ-X2Πr transition bands of phosphorus monoxide". Chemical Physics. 262 (2–3): 211–228. doi:10.1016/s0301-0104(00)00301-3.
- ^ Gupta, A K Sen (1 March 1935). "Rotational analysis of the ultra-violet bands of phosphorus monoxide". Proceedings of the Physical Society. 47 (2): 247–257. Bibcode:1935PPS....47..247G. doi:10.1088/0959-5309/47/2/305.



