디클로로린헥토산화물
Dichlorine heptoxide | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 디클로로린헥토산화물 | |
| 기타 이름 염소(VII) 산화물, 과염소산 무수화물, (페클로릴록시)삼산화염소산염소 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
펍켐 CID | |
CompTox 대시보드 (EPA) | |
| 특성. | |
| 클로27 | |
| 어금질량 | 182.901 g/180 |
| 외관 | 무색의 액체 |
| 밀도 | 1.9 g/cm3 |
| 녹는점 | -91.57°C(-132.83°F; 181.58K) |
| 비등점 | 82°C(180°F, 355K) |
| 과염소산을 만들기 위해 가수 분해하다. | |
| 위험 | |
| 주요 위험 | 산화제, 접촉폭발물[1] |
| NFPA 704(화재 다이아몬드) | |
| 관련 화합물 | |
관련 화합물 | 과산화망간 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
디클로로인 헵타산화물은 ClO라는27 공식을 가진 화학 화합물이다. 이 염소 산화물은 과염소산의 무수화물이다. 오산화 탈수제 인이 존재하는 곳에서 과염소산을 조심스럽게 증류하여 생성된다.[1]
- 2 HClO4 + P4O10 → Cl2O7 + H2P4O11
산화염소는 혼합물에서 증류할 수 있다.
그것은 또한 염소와 오존의 혼합물에 대한 조명에 의해 형성될 수 있다.[2] 그것은 천천히 다시 과염소산까지 가수분해하는데, 이것은 무수할 때도 위험하다.
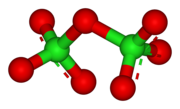
구조
ClO는27 내분자인데, 이는 본질적으로 불안정하며, 에너지가 방출되면서 구성 요소로 분해된다는 것을 의미한다.[3]
- 2 Cl2O7 → 2 Cl2 + 7 O2 (ΔH° = –132 kcal/mol)
ClO는27 Cl-O-Cl 각 118.6°의 각도로 휘어져 있어 분자 C의2 대칭성을 부여한다. 단자 Cl-O 거리는 1.709 å이고, Cl=O 거리는 1.405 å이다.[1] 이 화합물에서 염소는 가장 높은 공식 산화 상태인 +7로 존재하지만, 이 분자의 결합은 유의하게 공존한다.
화학
디클로로린 헵타산화물은 카본 테트라클로라이드 용액의 1차 아민과 2차 아민과 반응하여 과염소화 아미드를 산출한다.[4]
- 2 RNH
2 + Cl
2O
7 → 2 RNHClO
3 + H
2O - 2 R
2NH + Cl
2O
7 → 2 R
2NClO
3 + H
2O
또한 알케인과 반응하여 알킬 과염소산염을 준다. 예를 들어 카본 테트라클로라이드 용액에서 프로펜과 반응하여 이소프로필 과염소산염과 1-염소-2-프로필 과염소산염을 산출한다.[5]
디클로로인 헵타산화물은 강한 산성 산화물로, 용액으로는 과염소산과 평형을 이룬다.
안전
가장 안정적인 염소산화물이지만 ClO는27 강력한 산화제일 뿐 아니라 불꽃이나 기계적 충격이나 요오드와 접촉해 폭발물을 터뜨릴 수 있다.[6] 그럼에도 불구하고 다른 염소산화물에 비해 산화가 강하지 않고, 차가울 때 황, 인, 종이에 공격하지 않는다.[1] 인체에 미치는 영향은 원소염소와 동일하며, 동일한 예방조치가 필요하다.[7]
참조
- ^ Jump up to: a b c d Holleman, Arnold F.; Wiberg, Egon (2001). Inorganic chemistry. Translated by Mary Eagleson; William Brewer. San Diego: Academic Press. p. 464. ISBN 0-12-352651-5.
- ^ Byrns, A. C.; Rollefson, G. K. (1934). "The Formation of Chlorine Heptoxide on Illumination of Mixtures of Chlorine and Ozone". Journal of the American Chemical Society. 56 (5): 1250–1251. doi:10.1021/ja01320a506.
- ^ Martin, Jan M. L (2006-10-12). "Heats of formation of perchloric acid, HClO4, and perchloric anhydride, Cl2O7. Probing the limits of W1 and W2 theory". Journal of Molecular Structure: THEOCHEM. Modelling Structure and Reactivity: the 7th triennial conference of the World Association of Theoritical and Computational Chemists (WATOC 2005). 771 (1): 19–26. arXiv:physics/0508076. doi:10.1016/j.theochem.2006.03.035. ISSN 0166-1280.
- ^ Beard, C. D.; Baum, K. (1974). "Reactions of dichlorine heptoxide with amines". Journal of the American Chemical Society. 96 (10): 3237–3239. doi:10.1021/ja00817a034.
- ^ Baum, K. . (1976). "Reactions of dichlorine heptoxide with olefins". The Journal of Organic Chemistry. 41 (9): 1663–1665. doi:10.1021/jo00871a048.
- ^ Lewis, Robert Alan (1998). Lewis' dictionary of toxicology. CRC Press. p. 260. ISBN 1-56670-223-2.
- ^ Jeanne Mager Stellman, ed. (1998). "Halogens and their compounds". Encyclopaedia of occupational health and safety (4th ed.). International Labour Organization. p. 104.210. ISBN 92-2-109817-6.



