과산화칼륨
Potassium peroxide | |
| 이름 | |
|---|---|
| IUPAC 이름 과산화칼륨 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.037.339 |
| EC 번호 |
|
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| 특성. | |
| K2O2 | |
| 어금질량 | 110.155 g/190 |
| 외관 | 노란색 무정형 고체 |
| 녹는점 | 490°C(914°F, 763K) |
| 물과[1] 반응하다 | |
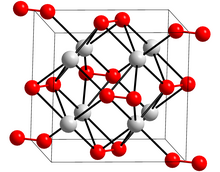
| 구조 | |
| 정형외과 | |
| Cmca, oS16 | |
| 열화학 | |
성 어금니 엔트로피 (S | 113 J·몰−1·K−1[2] |
의 성 엔탈피 대형화 (ΔfH⦵298) | -496 kJ·몰−1[2] |
| 위험 | |
| NFPA 704(화재 다이아몬드) | |
| 관련 화합물 | |
기타 음이온 | 산화칼륨 과산화칼륨 염화칼륨 |
기타 양이온 | 과산화리튬 과산화나트륨 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
과산화칼륨은 분자식 KO를22 가진 무기 화합물이다. 산화칼륨(KO2), 과산화칼륨(KO2)과 함께 칼륨이 공기 중의 산소와 반응하면서 형성된다.
과산화칼륨은 물과 반응하여 수산화칼륨과 산소를 형성한다.
참조
- ^ Lide, David R. (1998). Handbook of Chemistry and Physics (87 ed.). Boca Raton, Florida: CRC Press. pp. 477, 520. ISBN 0-8493-0594-2.
- ^ Jump up to: a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.