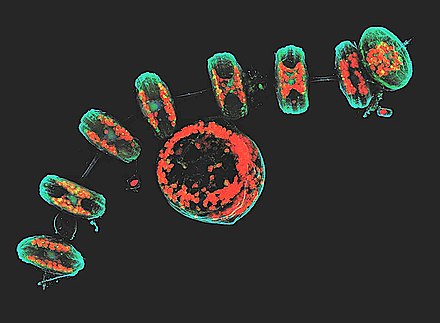
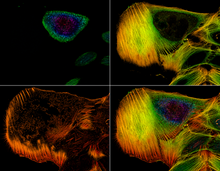
공초점 현미경 검사
Confocal microscopy| 공초점 현미경 검사 | |
|---|---|
| 메쉬 | D018613 |
| OPS-301 코드 | 3-301 |
공초점 현미경법(CLSM) 또는 레이저 공초점 주사 현미경법(LCSM)은 공간 핀홀을 사용하여 초점 밖의 빛을 이미지 [1]형성에서 차단함으로써 마이크로그래프의 광학 분해능과 콘트라스트를 높이는 광학 이미징 기법입니다.샘플의 다른 깊이에서 여러 개의 2차원 이미지를 캡처하면 객체 내에서 3차원 구조(광학적 분할로 알려진 프로세스)를 재구성할 수 있습니다.이 기술은 과학계와 산업계에서 광범위하게 사용되고 있으며 생명과학, 반도체 검사 및 재료과학 분야에서 일반적으로 사용됩니다.
공초점 현미경은 한 번에 하나의 좁은 깊이 수준에서 더 작은 광선을 집중시키는 반면, 빛은 기존의 현미경 아래에서 표본 안으로 최대한 멀리 이동합니다.CLSM은 제어되고 매우 제한된 필드 깊이를 실현합니다.
기본 개념
공초점 이미징의 원리는 1957년 마빈[2] 민스키에 의해 특허를 받았으며 전통적인 광시야 형광 [3]현미경의 한계를 극복하는 것을 목표로 하고 있다.종래의(즉, 광시야) 형광 현미경에서는, 시료 전체가 광원으로부터의 빛에 균등하게 침수된다.시료의 모든 부분을 동시에 들뜨게 할 수 있고, 그 결과 발생하는 형광을 현미경의 광검출기 또는 큰 비초점 배경부를 포함한 카메라로 검출한다.이와는 대조적으로 공초점 현미경은 검출기 전면의 광학 공역 평면에 점조명(점확산 기능 참조)과 핀홀을 사용하여 초점이 맞지 않는 신호를 제거한다. "공초점"이라는 이름은 이 구성에서 유래했다.초점면에 매우 가까운 형광에 의해 발생하는 빛만을 검출할 수 있기 때문에, 특히 시료 깊이 방향에서의 화상의 광학 분해능은 광시야 현미경보다 훨씬 좋다.그러나 샘플 형광에서 나오는 빛의 대부분이 핀홀에서 차단되기 때문에 이러한 분해능의 증가는 신호 강도 감소의 대가를 치르기 때문에 종종 긴 노출이 필요합니다.핀홀 후 신호의 감소를 상쇄하기 위해 광강도는 민감한 검출기(일반적으로 광전자 증배관(PMT) 또는 눈사태 포토다이오드)에 의해 검출되며 광신호를 전기 [4]신호로 변환한다.
한 번에 샘플의 한 지점만 조명되므로 2D 또는 3D 이미징을 수행하려면 샘플의 일반 래스터(즉, 평행 스캔 라인의 직사각형 패턴)를 통해 스캔해야 합니다.빔은 하나 이상의(서보 제어) 진동 미러를 사용하여 수평 평면의 샘플 전체에 걸쳐 스캔됩니다.이 검색 방법은 일반적으로 반응 지연 시간이 낮고 검색 속도가 달라질 수 있습니다.스캔 속도가 느릴수록 신호 대 잡음비가 개선되어 대비가 향상됩니다.
초점 평면의 도달 가능한 두께는 주로 사용된 빛의 파장을 대물 렌즈의 수치 개구부로 나눈 값이지만 시료의 광학 특성으로도 정의된다.이러한 유형의 현미경은 얇은 광학 절단이 가능하기 때문에 샘플의 3D 이미징 및 표면 프로파일링에 특히 적합합니다.
연속되는 슬라이스는 3D 이미지를 생성하기 위해 처리되거나 2D 스택으로 병합될 수 있는 'z-stack'을 구성합니다(대개 최대 픽셀 강도를 취합니다. 다른 일반적인 방법은 표준 편차를 사용하거나 픽셀을 [1]합산하는 것입니다).
공초점 현미경 검사는 광시야 [4]현미경 검사에 비해 측면 분해능이 약간 향상되었을 뿐 아니라 최소한의 샘플 준비로 온전하고 두꺼운 살아있는 검체의 직접 비침습적 연속 광학 절편을 위한 용량을 제공합니다.생물학적 샘플은 종종 형광 염료로 처리되어 선택된 물체를 보이게 한다.그러나 생물학적 시스템의 교란을 최소화하기 위해 실제 염료 농도는 낮을 수 있습니다. 일부 기기는 단일 형광 분자를 추적할 수 있습니다.또한, 트랜스제닉 기술은 그들만의 형광 키메라 분자를 생산하는 유기체를 만들 수 있습니다.공초점 현미경은 시료 내 점 들뜸(회절 제한 지점) 및 결과 형광 신호의 점 검출 원리에 따라 작동합니다.검출기의 핀홀은 초점이 맞지 않는 형광을 차단하는 물리적 장벽을 제공합니다.에어리 디스크의 포커스, 즉 중앙 지점만 기록됩니다.
수평 스캔에 사용되는 기술
시판되는 공초점 현미경에는 다음과 같은 4종류가 있습니다.
공초점 레이저 스캔 현미경은 다중 미러(일반적으로 x축과 y축을 따라 선형으로 스캔하는 2개 또는 3개)를 사용하여 샘플을 가로질러 레이저를 스캔하고 고정된 핀홀과 검출기에 걸쳐 이미지를 "다운"합니다.이 프로세스는 일반적으로 느리고 실시간 이미징에는 작동하지 않지만 고정 샘플의 고해상도 대표 영상을 만드는 데 유용할 수 있습니다.
스피닝 디스크(Nipkow 디스크) 공초점 현미경은 디스크의 움직이는 핀홀을 사용하여 빛의 반점을 스캔합니다.일련의 핀홀이 한 영역을 병렬로 주사하기 때문에 각 핀홀이 특정 영역 위를 더 오랜 시간 공회할 수 있으므로 레이저 주사 현미경에 비해 시료를 비추는 데 필요한 들뜸 에너지를 줄일 수 있다.들뜸 에너지가 감소하면 샘플의 광독성과 광표백이 감소하여 살아있는 세포나 유기체의 이미징을 위해 선호되는 시스템이 됩니다.
마이크로렌즈 확장형 또는 듀얼 스피닝 디스크 공초점 현미경은 마이크로렌즈를 포함한 두 번째 스피닝 디스크를 핀홀을 포함한 스피닝 디스크 앞에 배치하는 것을 제외하고 스피닝 디스크 공초점 현미경과 동일한 원리로 작동합니다.모든 핀홀에는 마이크로렌즈가 관련되어 있습니다.마이크로 렌즈는 광역을 포착하여 각 핀홀에 초점을 맞추어 각 핀홀로 향하는 빛의 양을 크게 늘리고 회전 디스크에 의해 차단되는 빛의 양을 줄이는 역할을 합니다.따라서 마이크로렌즈 강화 공초점 현미경은 표준 회전 디스크 시스템보다 훨씬 더 민감합니다.요코가와 전기는 1992년에 [5]이 기술을 발명했다.
프로그래머블 어레이 현미경(PAM)은 움직이는 핀홀 세트를 생성하는 전자 제어 공간광 변조기(SLM)를 사용합니다.SLM은 전자적으로 조정할 수 있는 개별 픽셀의 특성(투명도, 반사율 또는 광학 회전)을 가진 픽셀 배열을 포함하는 장치입니다.SLM에는 마이크로 전자 미러 또는 액정 구성 요소가 포함되어 있습니다.이미지는 보통 CCD(Charge Coupled Device) 카메라로 획득됩니다.
각각의 공초점 현미경은 특별한 장점과 단점을 가지고 있다.대부분의 시스템은 녹화 속도(즉, 비디오 캡처) 또는 높은 공간 분해능에 최적화되어 있습니다.공초점 레이저 주사 현미경은 프로그램 가능한 샘플링 밀도와 매우 높은 분해능을 가질 수 있지만, Nipkow와 PAM은 카메라 해상도에 의해 정의된 고정 샘플링 밀도를 사용합니다.싱글 포인트 레이저 스캔 시스템은 일반적으로 회전 디스크 또는 PAM 시스템보다 이미징 프레임 속도가 느립니다.시판되는 회전 디스크 공초점 현미경은 초당 50개[6] 이상의 프레임 속도를 달성합니다. 이는 라이브 세포 이미징과 같은 동적 관찰에 바람직한 기능입니다.
실제로 Nipkow와 PAM에서는 핀홀이 충분히 떨어져 있는 한 여러 핀홀을 동시에 스캔할[7] 수 있습니다.
최첨단 공초점 레이저 주사 현미경 개발로 여러 개의 마이크로 전기전자 주사 미러를 사용해 표준 영상 속도(초당 60프레임)보다 뛰어난 촬영이 가능해졌다.
공초점 X선 형광 이미징은 [8]예를 들어 그림의 매립층을 분석할 때 수평 및 수직 조준 외에 깊이를 제어할 수 있는 새로운 기술입니다.
해상도 향상
CLSM은 스캔 전자 현미경(SEM)과 같은 다른 스캔 기술과 비교하여 얻은 해상도를 가장 잘 설명하는 스캔 이미징 기술입니다.CLSM은 예를 들어 AFM이나 STM과 같이 표면에 나노미터의 프로브를 매달 필요가 없다는 장점이 있습니다.예를 들어 이미지가 sca에 의해 얻어지는 경우입니다.표면에 미세한 팁이 있는 nning.대물 렌즈에서 표면까지의 거리(작업 거리라고 함)는 일반적으로 기존의 광학 현미경과 비슷합니다.시스템 광학 설계에 따라 다르지만 일반적으로 수백 마이크로미터에서 수 밀리미터까지의 작동 거리가 있습니다.
CLSM에서 시료는 점 레이저 소스에 의해 조명되며, 각 볼륨 요소는 이산 산란 또는 형광 강도와 관련된다.여기서 주사레이저의 화상은 무한소점이 아니라 3차원 회절패턴이기 때문에 주사용량의 크기는 광학계의 스폿 사이즈(회절한계에 가깝다)에 의해 결정된다.이 회절 패턴의 크기와 그것이 정의하는 초점 부피는 시스템의 대물 렌즈의 숫자 구멍과 사용된 레이저의 파장에 의해 제어됩니다.이는 광시야 조명을 사용하는 기존 광학 현미경의 전형적인 분해능 한계로 볼 수 있다.그러나 공초점 현미경을 사용하면 공초점 개구부를 닫아 회절[citation needed] 패턴의 높은 차수를 제거할 수 있기 때문에 광시야 조명 기술의 분해능 한계를 개선할 수 있습니다.예를 들어 핀홀 직경을 1Airy 단위로 설정하면 회절 패턴의 첫 번째 순서만 개구부를 통해 검출기에 도달하고 고차 차단되므로 약간의 밝기 저하를 감수하면서 분해능을 향상시킬 수 있다.형광 관측에서 공초점 현미경의 분해능 한계는 형광 현미경에서 전형적으로 이용 가능한 소수의 광자에 의해 야기되는 신호 대 잡음비에 의해 종종 제한된다.보다 민감한 광검출기를 사용하거나 조명 레이저 포인트 소스의 강도를 높임으로써 이러한 효과를 보상할 수 있습니다.조명 레이저의 강도를 높이면 특히 형광 밝기의 비교가 필요한 실험의 경우 과도한 표백이나 기타 대상 검체의 손상이 발생할 수 있습니다.식물 잎의 해면상 메소필이나 다른 조직을 포함한 공기와 같이 굴절성이 다른 조직을 촬영할 때 공초점 영상 품질을 손상시키는 구면 이상이 종종 나타난다.그러나 이러한 이상현상은 조직에 쉽게 침투하고 [9]굴절률이 물과 거의 동일한 과불소화탄소(perfluorodecalin)와 같은 광학적으로 투명한 무독성 과불소화탄소(Perfluorocarbons)에 샘플을 장착함으로써 현저하게 감소시킬 수 있다.
사용하다
CLSM은 세포 생물학 및 유전학에서 미생물학 및 발달 [10]생물학에 이르기까지 다양한 생물 과학 분야에서 널리 사용됩니다.양자광학, 나노결정 이미징, 분광학에도 사용된다.
생물학 및 의학
임상적으로 CLSM은 다양한 눈 질환의 평가에 사용되며, [11]특히 각막의 내피세포의 영상촬영, 정성분석 및 정량화에 유용하다.각막진균증의 경우 각막간질 내의 필라멘트 균성 요소의 국소화 및 식별에 사용되며, 신속한 진단을 가능하게 하여 최종 치료의 조기 확립을 가능하게 한다.내시경 시술을 위한 CLSM 기술에 대한 연구(내시경 검사)도 [12]유망하다.제약업계에서는 의약품 유통의 [13]품질과 균일성을 제어하기 위해 박막제제 형태의 제조 공정을 따를 것을 권고했다.공초점 현미경은 미생물들이 선호하는 서식지인 복잡한 다공질 구조인 바이오 필름 연구에도 사용된다.바이오 필름의 시간적 및 공간적 기능 중 일부는 마이크로 스케일 및 메소 스케일 구조를 연구해야만 이해할 수 있다.단일 [14]미생물의 활동과 조직을 발견하기 위해서는 마이크로스케일 연구가 필요하다.
광학 및 결정학
CLSM은 일부 3D 광학 데이터 스토리지 시스템에서 데이터 검색 메커니즘으로 사용되며 Magdalen 파피루스의 연대를 결정하는 데 도움이 되었습니다.
오디오 보존
IRIN 시스템은 광학 스캔 및 손상된 이력 오디오 복구에 공초점 [15]현미경을 사용합니다.
변종 및 확장 기능
축 분해능 향상
핀홀의 포인트 스프레드 함수는 폭이 몇 배인 타원체입니다.따라서 현미경의 축 분해능이 제한됩니다.이를 극복하는 한 가지 방법은 4Pi 현미경 검사입니다. 이 현미경 검사에서는 입사 및 또는 방출된 빛이 시료 위와 아래에서 모두 간섭하여 타원체의 부피를 줄입니다.다른 기술은 공초점 세타 현미경 검사이다.이 기술에서는 조명광의 원뿔과 검출광은 서로 기울어져 있습니다(수직일 때 가장 좋은 결과).두 점 산포 함수의 교차는 훨씬 더 작은 유효 표본 부피를 제공합니다.이를 통해 단일 평면 조명 현미경을 발전시켰다.또한 디콘볼루션(deconvolution)을 실험적으로 도출된 점 확산 함수를 사용하여 초점이 맞지 않는 빛을 제거하여 축방향 및 측면 평면 모두에서 대조도를 개선할 수 있다.
초해상도
분해능이 회절 한계 이하인 공초점 변종(STED)이 있다.이 기술 외에도 PARM, (d)STORM, SIM 등과 같은 다양한 초해상도 기술을 사용할 수 있습니다.사용의 용이성, 해상도, 특수한 기기, 버퍼 또는 형광체의 필요성 등, 모두 독자적인 이점이 있습니다.
저온 조작성
저온에서 샘플 영상을 촬영하기 위해 레이저 스캔 공초점 현미경 아키텍처를 기반으로 두 가지 주요 접근법이 사용되었습니다.한 가지 방법은 연속 흐름 크라이오스탯을 사용하는 것입니다.샘플만 저온 상태이고 투명한 [16]창을 통해 광학적으로 처리됩니다.또 다른 가능한 접근법은 극저온 저장 [17]디워에서 광학 부분(특히 현미경 목적)을 갖는 것이다.이 두 번째 접근방식은 더 번거롭지만 더 나은 기계적 안정성을 보장하고 창문에 의한 손실을 방지합니다.
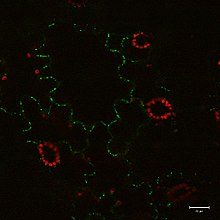
이미지들
역사
시작: 1940-1957
1940년 스위스 베른의 안과 의사 Hans Goldmann은 눈 [18]검사를 기록하는 슬릿 램프 시스템을 개발했습니다.이 계는 후대의 몇몇 저자들에 의해 최초의 공초점 광학계로 [19][20]간주된다.
1943년 군 코아나는 공초점 [21][19]시스템을 발표했다.
1951년 코아나의 동료인 히로토 나오라는 분광 [22]측광학 저널에 공초점 현미경을 묘사했다.
최초의 공초점 주사 현미경은 1955년 마빈 민스키에 의해 만들어졌고 1957년에 특허가 출원되었다.초점 평면의 조명점 스캔은 스테이지를 이동함으로써 달성되었습니다.과학 출판물은 제출되지 않았고, 그것으로 만든 이미지는 [2][23]보존되지 않았다.
탠덤 스캔 현미경
1960년대 플라제주 찰스 대학 의학부의 체코슬로바키아 모이미르 페트라는 최초의 상용 공초점 현미경인 탠덤 스캔 현미경을 개발했습니다. Microscope를 개발했다.체코슬로바키아와 미국의 한 작은 회사에서 Tracor-Northern(나중에 Noran)에 의해 판매되었으며, 회전하는 Nipkow 디스크를 사용하여 여러 개의 들뜸 및 방출 핀홀을 [20][24]생성했습니다.
체코슬로바키아 특허는 1966년 체코슬로바키아 동료인 페트라와 밀란 하드라브스키에 의해 출원되었다.이 현미경으로 생성된 데이터와 이미지를 포함한 최초의 과학 논문은 1967년 예일 대학교와 페트라 [25]대학의 M. David Egger에 의해 저자인 Science 저널에 발표되었습니다.이 논문의 주석으로 페트라는 현미경을 설계하고 그 제작을 감독했으며 부분적으로 예일 대학의 "연구 동료"였다고 언급되어 있다.1968년의 두 번째 출판물은 이론과 악기의 기술적 세부사항을 설명하고, 하드라브스크와 로버트 갈람보스 예일대 그룹장을 추가 [26]저자로 묘사했다.1970년에 미국 특허가 부여되었다.1967년에 [27]제출되었습니다.
1969년 : 최초의 공초점 레이저 주사 현미경
1969년과 1971년, 예일 대학의 데이비드 에거와 폴 다비도빗은 최초의 공초점 레이저 [28][29]주사 현미경을 설명하는 두 개의 논문을 발표했다.그것은 하나의 조명 반점만 생긴다는 것을 의미하는 포인트 스캐너였다.신경조직을 관찰하기 위해 에피-일루미네이션-반사 현미경을 사용했다.633 nm 빛을 가진 5 mW 헬륨-네온-레이저는 반투명 거울에 의해 대상을 향해 반사되었다.목표는 초점 거리가 8.5mm인 단순 렌즈였다.모든 이전 및 이후 시스템과 달리, 샘플은 이 렌즈의 이동(객관적 스캔)으로 스캔되어 초점의 이동을 유도했습니다.반사된 빛은 반투명 거울로 돌아왔고, 투과된 부분은 광전자 증배관이 배치된 검출 핀홀의 다른 렌즈에 의해 초점이 맞춰졌다.신호는 오실로스코프의 CRT에 의해 시각화되었으며, 음극선은 목표와 동시에 이동되었습니다.폴라로이드 사진을 만들 수 있는 특별한 장치. 그 중 3개는 1971년 출판물에 소개되었다.
저자들은 생체 내 조사를 위한 형광 염료에 대해 추측한다.그들은 시간에 민스키의 특허권을 감사합니다 스티브 베어 들고 있는데 알버트 아인슈타인 의과 대학 뉴욕시에 위치한 자신 'Minsky의 현미경을 '와 Galambos, Hadravsky과 Petráň 논의 그들의 마이크로의 발전에 선도적인 감사합니다로 보여 주는 레이저를 사용하자고 제안을 위한 공초점 라인 주사 microscope,[30]를 개발했습니다. 박사 학위 학생입니다.scope. 개발 동기는 Tandem-Scanning-Microscope에서 조명 빛의 10분의−7 1만이 안구 피스에서 이미지를 생성하는 데 참여한다는 것이었다.따라서 대부분의 생물학적 조사에는 [19][31]영상 화질이 충분하지 않았습니다.
1977-1985: 레이저를 사용한 포인트 스캐너 및 스테이지 스캔
1977년에 콜린 J. R. 영국 옥스퍼드의 셰퍼드와 아마르지오티 처드허리는 공초점 현미경과 레이저 [32]스캔 현미경의 이론적 분석을 발표했다.그것은 아마도 "공초점 현미경"[19][31]이라는 용어를 사용한 첫 출판물일 것이다.
1978년 크리스토프 크레머와 토마스 크레머 형제는 전자 오토포커스와 형광 들뜸을 이용한 공초점 레이저 스캔 현미경의 디자인을 발표했다.그들은 또한 "4µ-point-holograme"[31][33]를 사용하여 레이저 포인트 조명을 제안했습니다.이 CLSM 설계는 형광 마커로 라벨이 부착된 생물학적 물체의 3D 검출과 레이저 스캐닝 방법을 처음으로 결합했습니다.
1978년과 1980년 콜린 셰퍼드와 토니 윌슨 주변의 옥스퍼드 그룹은 에피 레이저 조명, 스테이지 스캔 및 광전자 증배관을 검출기로 하는 공초점 현미경을 설명했다.스테이지가 광축(z축)을 따라 이동할 수 있어 광시리얼 [31]섹션이 가능합니다.
1979년 Fred Brakenhoff와 동료들은 광학 분할과 해상도 개선의 이론적 이점이 실제로 달성 가능하다는 것을 증명했다.1985년에 이 그룹은 생물학적 [34]질문에 대답할 수 있는 공초점 현미경으로 찍은 설득력 있는 이미지를 최초로 발표했다.얼마 지나지 않아 더 많은 그룹이 기술적 한계로 인해 미스터리로 남아있던 과학적 질문에 답하기 위해 공초점 현미경을 사용하기 시작했다.
1983년 I. J. 콕스와 C.옥스포드의 셰퍼드는 공초점 현미경이 컴퓨터에 의해 제어되는 첫 번째 작품을 발표했다.최초의 시판 레이저 주사 현미경인 스테이지 스캐너 SOM-25는 1982년부터 Oxford Opto Electronics에 의해 제공되었습니다(BioRad가 여러 번 인수한 후).그것은 옥스포드 [20][35]그룹의 디자인에 기초했다.
1985년 시작: 레이저 포인트 스캐너(빔 스캔 포함)
1980년대 중반, 윌리엄 브래드쇼 아모스와 존 그레이엄 화이트와 캠브리지의 분자생물학 연구소에서 일하는 동료들은 최초의 공초점 빔 주사 [36][37]현미경을 만들었다.샘플이 있는 스테이지가 움직이지 않고, 조명 스팟이 움직이기 때문에, 1초에 4매의 화상을 512 라인으로 고속으로 획득할 수 있었습니다.길이 1~2m의 빔 경로로 인해 크게 확대된 중간 이미지는 직경이 1mm까지인 기존의 홍채 다이어프램을 '핀홀'로 사용할 수 있었습니다.첫 번째 마이크로그래프는 디지털 카메라가 추가되기 전에 필름에 장기간 노출되어 촬영되었습니다.한층 더 개선되어 처음으로 준비 작업을 확대할 수 있게 되었습니다.Zeiss, Leitz, 그리고 Cambridge Instruments는 상업적인 [38]제작에 관심이 없었다.의학 연구 위원회(MRC)가 마침내 프로토타입 개발을 후원했습니다.이 디자인은 바이오라드에 인수되어 컴퓨터 제어로 수정되어 'MRC 500'으로 상용화 되었다.후속 MRC 600은 나중에 코넬 대학에서 [34]1990년에 개발된 최초의 2광자 형광 현미경 개발의 기초가 되었다.
비슷한 시기에 스톡홀름에 있는 KTH Royal Institute of Technology의 개발로 스웨덴 회사인 Sarastro가 [39]상업적으로 배포한 CLSM이 탄생했습니다.1990년 Molecular [40]Dynamics에 인수되었으나 CLSM은 결국 중단되었다.독일에서는 1984년에 설립된 하이델베르크 인스트루먼트가 CLSM을 개발했는데, 이 인스트루먼트는 처음에는 생물학이 아닌 산업용이었다.이 기구는 1990년에 라이카 레이저 테크닉에 인수되었다.자이스는 이미 무공초점 비행점 레이저 스캐닝 현미경을 시장에 출시해 공공초점으로 업그레이드했다.1990년 [41]보고서에 따르면 일부 코포칼 제조업체(Sarastro, Technical Instruments, Meridian Instruments, Bio-Rad, Leica, Tracor-Northern 및 Zeiss)[34]가 언급되었습니다.
1989년 프리츠 칼 프릭스챗은 그의 아들 에카드 프릭스챗과 함께 입자 크기 [42][43]분석을 위한 주사 레이저 다이오드 현미경을 발명했다.라센텍을 공동 설립해 상품화했다.2001년, 라센텍은 메틀러 톨레도에 [44]인수되었다.이들은 주로 제약업계에서 대규모 정제 시스템에서 결정화 과정의 현장 제어를 제공하기 위해 사용됩니다.
「 」를 참조해 주세요.
- 2광자 들뜸 현미경 검사:다광자 형광 현미경은 관련 기술(둘 다 레이저 주사 현미경)을 사용하지만 엄밀하게 공초점 현미경은 아닙니다.공초점이라는 용어는 공초점 평면(공초점)에 횡격막이 존재하기 때문에 발생한다.이 횡격막은 다광자 현미경에서는 보통 보이지 않는다.
레퍼런스
- ^ a b Pawley JB, ed. (2006). Handbook of Biological Confocal Microscopy (3rd ed.). Berlin: Springer. ISBN 0-387-25921-X.
- ^ a b US 3013467, Minsky, Marvin, "현미경 기기", 1961-12-19 출판
- ^ 공초점 주사 현미경의 발명에 관한 회고록, 스캔 10(1988), pp128–138.
- ^ a b Fellers TJ, Davidson MW (2007). "Introduction to Confocal Microscopy". Olympus Fluoview Resource Center. National High Magnetic Field Laboratory. Retrieved 2007-07-25.
- ^ US 5162941, Favro, Lawrence D.; Thomas, Robert L. & Kuo, Pao-Kuang 등, 「공명 현미경」, 1992-11-10년 발행, 웨인 주립 대학 이사회에 할당.
- ^ "Data Sheet of NanoFocus µsurf spinning-disk confocal white light microscope". Archived from the original on 2014-01-20. Retrieved 2013-08-14.
- ^ "Data Sheet of Sensofar 'PLu neox' Dual technology sensor head combining confocal and Interferometry techniques, as well as Spectroscopic Reflectometry".
- ^ Vincze L (2005). "Confocal X-ray Fluorescence Imaging and XRF Tomography for Three Dimensional Trace Element Microanalysis". Microscopy and Microanalysis. 11 (Supplement 2). doi:10.1017/S1431927605503167.
- ^ Littlejohn, George R.; Gouveia, João D.; Edner, Christoph; Smirnoff, Nicholas; Love, John (2010). "Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll". New Phytologist. 186 (4): 1018–1025. doi:10.1111/j.1469-8137.2010.03244.x. hdl:10026.1/9344. ISSN 1469-8137. PMID 20374500.
- ^ Juan Carlos Stockert, Alfonso Blázquez-Castro (2017). "Chapter 6 Fluorescence Instrumental and Techniques". Fluorescence Microscopy in Life Sciences. Bentham Science Publishers. pp. 180–184. ISBN 978-1-68108-519-7. Retrieved 24 December 2017.
- ^ Patel DV, McGhee CN (2007). "Contemporary in vivo confocal microscopy of the living human cornea using white light and laser scanning techniques: a major review". Clin. Experiment. Ophthalmol. 35 (1): 71–88. doi:10.1111/j.1442-9071.2007.01423.x. PMID 17300580. S2CID 23029612.
- ^ Hoffman A, Goetz M, Vieth M, Galle PR, Neurath MF, Kiesslich R (2006). "Confocal laser endomicroscopy: technical status and current indications". Endoscopy. 38 (12): 1275–83. doi:10.1055/s-2006-944813. PMID 17163333.
- ^ Le Person, S.; Puiggali, J.R.; Baron, M.; Roques, M. (1998). "Near infrared drying of pharmaceutical thin films: Experimental analysis of internal mass transport" (PDF). Chemical Engineering and Processing: Process Intensification. 37 (3): 257–263. doi:10.1016/S0255-2701(98)00032-4.
- ^ Gitis, Vitaly; Rothenberg, Gadi (2020). Gitis, Vitaly; Rothenberg, Gadi (eds.). Handbook of Porous Materials. Singapore: World Scientific. pp. 63–64. doi:10.1142/11909. ISBN 978-981-122-322-8.
- ^ 디지털화 프로세스프로젝트 IRINE, 캘리포니아 대학교 버클리 도서관
- ^ Hirschfeld, V.; Hubner, C.G. (2010). "A sensitive and versatile laser scanning confocal optical microscope for single-molecule fluorescence at 77 K". Review of Scientific Instruments. 81 (11): 113705–113705–7. Bibcode:2010RScI...81k3705H. doi:10.1063/1.3499260. PMID 21133476.
- ^ Grazioso, F.; Patton, B. R.; Smith, J.M. (2010). "A high stability beam-scanning confocal optical microscope for low temperature operation". Review of Scientific Instruments. 81 (9): 093705–4. Bibcode:2010RScI...81i3705G. doi:10.1063/1.3484140. PMID 20886985.
- ^ Hans Goldmann (1939). "Spaltlampenphotographie und –photometrie". Ophthalmologica. 98 (5/6): 257–270. doi:10.1159/000299716. 비고: 제98권은 1939년으로 되어 있지만, 기사의 첫 페이지에는 1940년 1월이 발행일로 기재되어 있다.
- ^ a b c d Colin JR Sheppard (3 November 2009). "Confocal Microscopy. The Development of a Modern Microscopy". Imaging & Microscopy.온라인.
- ^ a b c 배리 R.마스터: 공초점 현미경 검사와 멀티호톤 들뜸 현미경 검사.살아있는 세포 이미징의 창시.SPIE Press, Washington, Bellingham, 미국, 2006, ISBN 978-0-8194-6118-6, S. 120-121.
- ^ Zyun Koana (1942). Journal of the Illumination Engineering Institute. 26 (8): 371–385.
{{cite journal}}: 누락 또는 빈 (도움말)논문은 저널 홈페이지에서 볼 수 있습니다.「P359 - 402」라고 하는 라벨이 붙은 PDF 파일의 사이즈는 19,020 킬로바이트이며, 같은 문제의 인접 기사도 포함되어 있습니다.이 기사의 그림 1b는 공초점 투과빔 패스의 구성을 나타내고 있다. - ^ Naora, Hiroto (1951). "Microspectrophotometry and cytochemical analysis of nucleic acids". Science. 114 (2959): 279–280. Bibcode:1951Sci...114..279N. doi:10.1126/science.114.2959.279. PMID 14866220.
- ^ Marvin Minsky (1988). "Memoir on inventing the confocal scanning microscope". Scanning. 10 (4): 128–138. doi:10.1002/sca.4950100403.
- ^ 가이 콕스: 세포생물학의 광학영상기술. 1.판.CRC Press, Taylor & Francis Group, Boca Raton, FL, 미국 2006, ISBN 0-8493-3919-7, 115-122페이지.
- ^ Egger MD, Petrăn M (July 1967). "New reflected-light microscope for viewing unstained brain and ganglion cells". Science. 157 (786): 305–7. Bibcode:1967Sci...157..305E. doi:10.1126/science.157.3786.305. PMID 6030094. S2CID 180450.
- ^ MOJMÍR PETRÁŇ; MILAN HADRAVSKÝ; M. DAVID EGGER; ROBERT GALAMBOS (1968). "Tandem-Scanning Reflected-Light Microscope". Journal of the Optical Society of America. 58 (5): 661–664. Bibcode:1968JOSA...58..661P. doi:10.1364/JOSA.58.000661.
- ^ US 3517980, Mojmir & Hadravsky, 밀라노, Petran, Mojmir & Hadravsky, 1970-06-30, Ceskoslovska 아카다미에 할당된 "해상도 및 대비 향상을 위한 방법과 배치"
- ^ Davidovits, P.; Egger, M. D. (1969). "Scanning laser microscope". Nature. 223 (5208): 831. Bibcode:1969Natur.223..831D. doi:10.1038/223831a0. PMID 5799022. S2CID 4161644.
- ^ Davidovits, P.; Egger, M. D. (1971). "Scanning laser microscope for biological investigations". Applied Optics. 10 (7): 1615–1619. Bibcode:1971ApOpt..10.1615D. doi:10.1364/AO.10.001615. PMID 20111173.
- ^ 배리 R.마스터: 공초점 현미경 검사와 멀티호톤 들뜸 현미경 검사.살아있는 세포 이미징의 창시.SPIE Press, Washington, Bellingham, 미국, 2006, ISBN 978-0-8194-6118-6, 페이지 124-125.
- ^ a b c d Shinya Inoué (2006). "Chapter 1: Foundations of Confocal Scanned Imaging in Light Microscopy". In James Pawley (ed.). Handbook of Biological Confocal Microscopy (3. ed.). Springer Science and Business Media LLC. pp. 1–19. ISBN 978-0-387-25921-5.
- ^ Sheppard, C.J.R.; Choudhury, A. (1977). "Image Formation in the Scanning Microscope". Optica Acta: International Journal of Optics. 24 (10): 1051–1073. Bibcode:1977AcOpt..24.1051S. doi:10.1080/713819421.
- ^ Cremer, C.; Cremer, T. (1978). "Considerations on a laser-scanning-microscope with high resolution and depth of field". Microscopica Acta. 81 (1): 31–44. PMID 713859.
- ^ a b c Amos, W.B.; White, J.G. (2003). "How the Confocal Laser Scanning Microscope entered Biological Research". Biology of the Cell. 95 (6): 335–342. doi:10.1016/S0248-4900(03)00078-9. PMID 14519550. S2CID 34919506.
- ^ Cox, I. J.; Sheppard, C. J. (1983). "Scanning optical microscope incorporating a digital framestore and microcomputer". Applied Optics. 22 (10): 1474. Bibcode:1983ApOpt..22.1474C. doi:10.1364/ao.22.001474. PMID 18195988.
- ^ White, J. G. (1987). "An evaluation of confocal versus conventional imaging of biological structures by fluorescence light microscopy". The Journal of Cell Biology. 105 (1): 41–48. doi:10.1083/jcb.105.1.41. ISSN 0021-9525. PMC 2114888. PMID 3112165.
- ^ Anon (2005). "Dr John White FRS". royalsociety.org. London: Royal Society. Archived from the original on 2015-11-17.
- ^ Amos, W.B.; White, J.G. (2003). "How the Confocal Laser Scanning Microscope entered Biological Research". Biology of the Cell. 95 (6): 335–342. doi:10.1016/S0248-4900(03)00078-9. PMID 14519550. S2CID 34919506.
- ^ Carlsson, K.; Danielsson, P.E.; Lenz, R.; Liljeborg, A.; Majlöf, L.; Åslund, N. (1985). "Three-dimensional microscopy using a confocal laser scanning microscope". Optics Letters. 10 (2): 53–55. Bibcode:1985OptL...10...53C. doi:10.1364/OL.10.000053. PMID 19724343.
- ^ Brent Johnson (1 February 1999). "Image Is Everything". The Scientist. 온라인.
- ^ Diana Morgan (23 July 1990). "Confocal Microscopes Widen Cell Biology Career Horizons". The Scientist. 온라인.
- ^ US 4871251, Preikschat, Fritz K. & Preikschat, Ekhard, "입자 분석용 부속과 방법", 1989-10-03 출판
- ^ US 5012118, Preikschat, Fritz K. & Preikschat, Ekhard, "입자 분석용 부속품과 방법", 1991-04-30 출판
- ^ reserved, Mettler-Toledo International Inc. all rights. "Particle Size Distribution Analysis". Archived from the original on 2016-10-09. Retrieved 2016-10-06.
- Hoffman, David P.; Shtengel, Gleb; Xu, C. Shan; Campbell, Kirby R.; Freeman, Melanie; Wang, Lei; Milkie, Daniel E.; Pasolli, H. Amalia; Iyer, Nirmala; Bogovic, John A.; Stabley, Daniel R.; Shirinifard, Abbas; Pang, Song; Peale, David; Schaefer, Kathy; Pomp, Wim; Chang, Chi-Lun; Lippincott-Schwartz, Jennifer; Kirchhausen, Tom; Solecki, David J.; Betzig, Eric; Hess, Harald F. (2020). "Correlative three-dimensional super-resolution and block-face electron microscopy of whole vitreously frozen cells". Science. 367 (6475): eaaz5357. doi:10.1126/science.aaz5357. ISSN 0036-8075. PMC 7339343. PMID 31949053.
외부 링크
| 라이브러리 리소스 정보 공초점 현미경 검사 |