플루옥시메스테론
Fluoxymesterone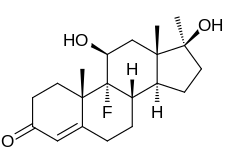 | |
| 임상 데이터 | |
|---|---|
| 상호 | Halotestin, Ora-Testryl, Ultandren, 기타 |
| 기타 이름 | 플루옥시메스트론, 안드로플루오렌, NSC-12165, 9α-플루오로-11β-히드록시-17α-메틸테스토스테론, 9α-플루오로-17α-메틸란드로스트-4-en-11β, 17β-디올-3-온 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a682690 |
| 임신 카테고리 |
|
| 루트 행정부. | 입으로[1] |
| 약물 클래스 | 안드로겐; 아나볼릭 스테로이드 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 구강 : 80%[2] |
| 대사 | 간(6β-히드록실화, 5α- 및 5β-환원, 3α- 및 3β-케토산화, 11β-히드록시산화)[3] |
| 대사물 | • 5α-디히드로플루옥시메스테론[3] • 11-옥소플루옥시메스테론[3] |
| 반감기 제거 | 9.2시간[4][5] |
| 배설물 | 소변(변화률 5% 미만)[2][3] |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.000.875 |
| 화학 및 물리 데이터 | |
| 공식 | C20H29FO3 |
| 몰 질량 | 336.447 g/g−1/g |
| 3D 모델(JSmol) | |
| |
| |
| (표준) | |
할로테스틴과 울탄드렌이라는 상표명으로 판매되는 플루옥시메스테론은 남성들의 낮은 테스토스테론 수치, 남아들의 늦은 사춘기, 여성의 유방암, 그리고 [1]빈혈의 치료에 사용되는 안드로겐과 동화성 스테로이드(AAS) 약물이다.입으로 [1]먹는 거예요.
플루옥시메스테론의 부작용으로는 여드름과 같은 남성화 증상, 머리카락 성장 증가, 목소리 변화, 성욕 증가 [1]등이 있다.그것은 또한 간 손상과 고혈압과 [1][6][7]같은 심혈관 부작용을 일으킬 수 있다.이 약물은 합성 안드로겐 및 동화 스테로이드이므로 테스토스테론 및 디히드로테스토스테론(DHT)[1][8]과 같은 안드로겐의 생물학적 표적인 안드로겐 수용체(AR)의 작용제이다.강한 안드로겐 효과와 중간 정도의 동화 효과가 있어 [1][9]남성화를 만드는 데 유용합니다.
플루옥시메스테론은 1956년에 처음 설명되었고 1957년에 [1][10]의료용으로 도입되었다.플루옥시메스테론은 의학적 용도 외에도 체격과 [1]성능을 향상시키기 위해 사용된다.그 약은 많은 나라에서 통제된 약물이기 때문에 비의학적인 사용은 일반적으로 [1]불법이다.
의료 용도
플루옥시메스테론은 남성의 경우 저나드증, 지연성 사춘기, 빈혈, [1][11]여성의 경우 유방암 치료에 사용되거나 사용되어 왔다.이것은 남성에게는 저고나디즘, 남아에게는 늦어진 사춘기, 그리고 [12]여성에게는 유방암의 치료에 대해 하나 이상의 국가에서 특별히 승인되었습니다.미국의 현행 처방 가이드라인은 남성의 안드로겐 결핍과 여성의 유방암 치료만을 [1]지표로 열거하고 있다.
플루옥시메스테론은 테스토스테론보다 남성화를 유도하는 데 덜 효과적이지만 [13]성인의 확립된 남성화를 유지하는 데 유용하다.
| 경로 | 약 | 주요 브랜드명 | 형태 | 용량 |
|---|---|---|---|---|
| 오랄 | 테스토스테론a | – | 태블릿 | 400 ~ 800 mg / day (분할 용량) |
| 테스토스테론 운데칸산염 | 안드리올, 자텐초 | 캡슐 | 40 ~ 80 mg / 2 ~4 일 (식사 포함 | |
| 메틸테스토스테론b | Android, Metandren, Testred | 태블릿 | 10 ~ 50 mg/일 | |
| 플루옥시메스테론b | 할로테스틴, 오라-테스트릴, 울트란덴 | 태블릿 | 5 ~ 20 mg/일 | |
| 메탄디에논b | 다이너볼 | 태블릿 | 5~15mg/일 | |
| 메스테론b | 프로비언 | 태블릿 | 25~150mg/일 | |
| 하위 언어 | 테스토스테론b | 고환 | 태블릿 | 5~10mg/일 1-4배 |
| 메틸테스토스테론b | 메탄드렌, 오레톤 메틸 | 태블릿 | 10~30mg/일 | |
| 북칼 | 테스토스테론 | 스트라이언트 | 태블릿 | 30 mg (2 일 |
| 메틸테스토스테론b | 메탄드렌, 오레톤 메틸 | 태블릿 | 5 ~ 25 mg / | |
| 경피 | 테스토스테론 | AndroGel, 증언, TestoGel | 겔 | 25~125mg/일 |
| Androderm, AndroPatch, TestoPatch | 비스크로탈 패치 | 2.5~15mg/일 | ||
| 고환 | 음낭 패치 | 4 ~ 6 mg/일 | ||
| 액시론 | 액와액 | 30~120mg/일 | ||
| 안드로스타놀론()DHT | 안드랙팀 | 겔 | 100 ~ 250 mg/일 | |
| 직장의 | 테스토스테론 | 렉탄드론, 테스토스테론b | 좌약 | 40 mg (2-3배/일) |
| 주입(IM 또는 ) | 테스토스테론 | 안드로나크, 스테로타이트, 비로스테론 | 수성 현탁액 | 10~50mg (주당 2~3배) |
| 테스토스테론프로피온산염b | 테스토비론 | 오일 용액 | 10~50mg (주당 2~3배) | |
| 테스토스테론 에난트산 | 델라테스트릴 | 오일 용액 | 50~250mg(1~4주) | |
| Xyosted | 자동 주입기 | 50 ~ 100 mg/주 1회 | ||
| 테스토스테론 시피온산염 | 데포테스토스테론 | 오일 용액 | 50~250mg(1~4주) | |
| 테스토스테론 이소낙산염 | 아고비린 창고 | 수성 현탁액 | 50~100mg/1~2주 | |
| 테스토스테론페닐아세테이트b | 페르안드렌, 안드로젝트 | 오일 용액 | 50~200mg/3~5주 | |
| 혼합 테스토스테론 에스테르 | 서스타논 100, 서스타논 250 | 오일 용액 | 50~250mg/2~4주 | |
| 테스토스테론 운데칸산염 | 아베드, 네비도 | 오일 용액 | 750~1,000mg/10~14주 | |
| 테스토스테론 부시클레이트a | – | 수성 현탁액 | 600~1,000mg/12~20주 | |
| 임플란트 | 테스토스테론 | 테스토펠 | 펠릿 | 150~1,200mg/3~6개월 |
| 주의: 남성은 하루에 약 3~11mg의 테스토스테론을 생산합니다(젊은 남성은 하루 평균 7mg).각주: = 시판된 적이 없습니다.b = 더 이상 사용되지 않거나 더 이상 판매되지 않습니다.출처:"템플릿"을 참조해 주세요. | ||||
| 경로 | 약 | 주요 브랜드명 | 형태 | 용량 |
|---|---|---|---|---|
| 오랄 | 테스토스테론 운데칸산염 | 안드리올, 자텐초 | 캡슐 | 40 ~ 80 mg / 1 ~2 일 |
| 메틸테스토스테론 | 메탄드렌, 에스트라테스트렌 | 태블릿 | 0.5~10mg/일 | |
| 플루옥시메스테론 | 할로테스틴 | 태블릿 | 1 ~ 2.5 mg 1 x 1 ~2 일 | |
| 노르메탄드로네a | 기네코사이드 | 태블릿 | 5 mg/일 | |
| 티볼론 | 리비얼 | 태블릿 | 1.25~2.5mg/일 | |
| 프라스테론()DHEAb | – | 태블릿 | 10 ~ 100 mg/일 | |
| 하위 언어 | 메틸테스토스테론 | 메탄드렌 | 태블릿 | 0.25mg/일 |
| 경피 | 테스토스테론 | 내장 | 패치 | 150~300μg/일 |
| 안드로겔 | 젤, 크림 | 1 ~ 10 mg / day | ||
| 질내 | 프라스테론()DHEA | 인트라로사 | 삽입 | 6.5 mg/일 |
| 주입 | 테스토스테론프로피온산염a | 테스토비론 | 오일 용액 | 25 mg (1 ~2주 |
| 테스토스테론 에난트산 | 프리모디아 창고 델라테스트릴 | 오일 용액 | 25~100mg/4~6주 | |
| 테스토스테론 시피온산염 | 데포테스토스테론, 데포테스타디올 | 오일 용액 | 25~100mg/4~6주 | |
| 테스토스테론 이소낙산염a | 페만드렌 M, 폴리비린 | 수성 현탁액 | 25~50mg/4~6주 | |
| 혼합 테스토스테론 에스테르 | 클라이맥테론a | 오일 용액 | 150mg (4~8주) | |
| 옴나드렌, 서스타논 | 오일 용액 | 50~100mg/4~6주 | ||
| 데카노에이트 난드로네이트 | 데카두라볼린 | 오일 용액 | 25~50mg/6~12주 | |
| 에난트산프라스테론a | 기노디아 창고 | 오일 용액 | 200mg (1x4~6주) | |
| 임플란트 | 테스토스테론 | 테스토펠 | 펠릿 | 50~100mg 1x3~6개월 |
| 참고: 폐경 전 여성은 하루에 약 230 ± 70 μg의 테스토스테론을 생성한다(4주마다 6.4 ± 2.0mg의 테스토스테론), 매일 130 ~ 330 μg의 범위(4주마다 3.6 ~ 9.2mg).각주: = 대부분 단종되었거나 사용할 수 없습니다.b = 처방전 없이 살 수 있습니다.출처:"템플릿"을 참조해 주세요. | ||||
| 경로 | 약 | 형태 | 용량 | |
|---|---|---|---|---|
| 오랄 | 메틸테스토스테론 | 태블릿 | 30 ~ 200 mg/일 | |
| 플루옥시메스테론 | 태블릿 | 하루에 10~40mg 3배 | ||
| 칼루스테론 | 태블릿 | 40~80mg/일 4배속 | ||
| 노르메탄드로네 | 태블릿 | 40 mg/일 | ||
| 북칼 | 메틸테스토스테론 | 태블릿 | 25 ~ 100 mg / day | |
| 주입(IM 또는 ) | 테스토스테론프로피온산염 | 오일 용액 | 50~100mg/주 3배 | |
| 테스토스테론 에난트산 | 오일 용액 | 200~400mg (1x2~4주) | ||
| 테스토스테론 시피온산염 | 오일 용액 | 200~400mg (1x2~4주) | ||
| 혼합 테스토스테론 에스테르 | 오일 용액 | 250 mg/주 1회 | ||
| 메탄드리올 | 수성 현탁액 | 100 mg 3배/주 | ||
| 안드로스타놀론()DHT | 수성 현탁액 | 300mg/주 3배 | ||
| 프로피온산 드로스타놀론 | 오일 용액 | 100 mg (1~3배/주 | ||
| 에난트산메테놀론 | 오일 용액 | 400 mg 3배/주 | ||
| 데카노에이트 난드로네이트 | 오일 용액 | 50~100mg 1~3주 | ||
| 난드로론페닐프로피온산염 | 오일 용액 | 50 ~ 100 mg/주 | ||
| 주의: 복용량이 반드시 동일한 것은 아닙니다.출처:"템플릿"을 참조해 주세요. | ||||
이용 가능한 폼
플루옥시메스테론은 경구정 2, 5, 10mg의 형태로 제공됩니다.[14]
비의료용
플루옥시메스테론은 경쟁력 있는 운동선수, 보디빌더,[1] 파워리프터에 의해 체격 향상 및 경기력 향상 목적으로 사용됩니다.
부작용
플루옥시메스테론과 관련된 부작용으로는 여드름, 부종, 지루/지혈성 피부염, 탈모증, 발성심화, 일반적으로 남성화, 홍조, 여성모양, 유방통증, 생리장애, 저고환성 위축, 음핵확대, 음경확대, 공격성 증가 등이 있다.특히 전립선 비대, 심혈관 독성,[1][15] 간독성 등이 있습니다.
약리학
약역학
| 약 | 비율a |
|---|---|
| 테스토스테론 | ~1:1 |
| 안드로스타놀론()DHT | ~1:1 |
| 메틸테스토스테론 | ~1:1 |
| 메탄드리올 | ~1:1 |
| 플루옥시메스테론 | 1:1–1:15 |
| 메탄디에논 | 1:1–1:8 |
| 드로스타놀론 | 1:3–1:4 |
| 메테놀론 | 1:2–1:30 |
| 옥시메토론 | 1:2–1:9 |
| 옥산드로론 | 1:3–1:13 |
| 스타노졸롤 | 1:1–1:30 |
| 난드로론 | 1:3–1:16 |
| 에틸에스트레놀 | 1:2–1:19 |
| 노르에탄드로네 | 1:1–1:20 |
| 주의: 설치류.각주: = 동화작용에 대한 안드로겐의 비율.출처:"템플릿"을 참조해 주세요. | |
AAS로서 플루옥시메스테론은 테스토스테론이나 DHT와 같은 안드로겐과 마찬가지로 안드로겐 수용체([1][16]AR)의 작용제이다.테스토스테론과 같은 5α 환원효소의 기질이기 때문에 피부, 모낭, 전립선 등의 소위 "안드로겐"[1][16][3] 조직에서 5α-디하이드로플루옥시메스테론으로의 변환을 통해 강화된다.따라서 플루옥시메스테론은 테스토스테론 [1][16]및 메틸테스토스테론과 마찬가지로 안드로겐 활성에 대한 아나볼릭의 비율이 상대적으로 낮다.그럼에도 불구하고 플루옥시메스테론은 메틸테스토스테론이나 [9]테스토스테론보다 안드로겐이 적고 동화성이 더 높습니다.
플루옥시메스테론은 C11β 하이드록실기에 [17]의한 입체장애로 방향족화가 불가능한 것으로 보고되었으며, 따라서 여성유체증이나 [1][18]체액유지 등의 에스트로겐성 효과를 발생시키는 성향이 없는 것으로 간주되고 있다.그러나 역설적으로 심각한 플루옥시메스테론 유도 기모증의 사례 보고가 존재하며, 플루옥시메스테론과 관련된 기모증은 에스트로겐 활성에 [19]의한 것이 아닐 수도 있지만 다른 출판물에서도 보고되었다.플루옥시메스테론은 프로게스토겐 활성이 [1][16]거의 또는 전혀 없는 것으로 생각된다.
플루옥시메스테론은 17α-메틸기가 존재하기 때문에 대사가 저해되어 [1][16]간독성이지만 경구적으로 활성화된다.
11β-HSD저해
플루옥시메스테론은 11β-HSD2 억제제 글리시레틴산과 [6][7]동등한 효력을 가지며 11β-히드록시스테로이드 탈수소효소 타입 2(11β-HSD2)IC50의 강력한 억제제 역할을 하는 것으로 밝혀졌다.플루옥시메스테론의 이러한 작용은 AAS에서 특이하며 11β-히드록실기와 [6]관련이 있을 수 있다. 11β-HSD2는 글루코코르티코이드 코르티솔과 코르티코스테론(코티손과 11-데히드로코르티코스테론)[6][7]의 불활성화를 일으킨다.플루옥시메스테론에 의한 11β-HSD2의 억제는 미네랄코콜티코이드 수용체 과활성화와 고혈압 및 유체유지 등의 관련 부작용을 초래할 수 있으며, 플루옥시메스테론의 [6][7]심혈관 및 기타 부작용에 관여하는 것으로 가정되어 있다.
글루코콜티코이드 활성
다른 AAS와 달리 플루옥시메스테론은 C9α 플루오로 및 C11β 하이드록실기를 [20]포함한 코르티코스테로이드와 공통적인 구조적 특징을 가지고 있다.이와 관련하여 글루코콜티코이드 수용체에 [21]대해 약하지만 임상적으로 유의한 친화력을 가질 수 있다.
약동학
플루옥시메스테론은 C17α 메틸기가 퍼스트패스 대사를 [2][1]억제하기 때문에 테스토스테론과는 달리 약 80%의 경구 생체 가용성을 가진다.인간 혈청 성호르몬 결합 글로불린(SHBG)에 대한 친화력은 매우 낮으며, 테스토스테론의 5% 미만, DHT의 1%[22] 미만이다.간에서 대사되는 약물은 주로 6β-히드록실화, 5α- 및 5β-환원, 3α- 및 3β-케토-산화, 11β-히드록시-산화이다.[3]알려진 활성 대사물로는 5α-디하이드로플루옥시메스테론과 11-옥소플루옥시메스테론이 있다.[3][6][23][9]플루옥시메스테론은 테스토스테론에 [4]비해 긴 약 9.2시간의 제거 반감기를 가지고 있다.그것은 소변에서 제거되며,[2][3] 변하지 않고 5% 미만이 배설된다.
화학
9α-플루오로-11β-히드록시-17α-메틸테스토스테론 또는 9α-플루오로-17α-메틸란드로스트-4-en-11β,17β-디올-3-One이라고도 하는 플루옥시메스테론은 합성 안드로스탄 스테로이드 및 테스토스테론(rost-4-en-173-β-173-one)[24][25]의 17α-알킬화 유도체이다.특히 C9α 위치에 불소 원자를, C11β 위치에 수산기를, C17α [24][25]위치에 메틸기를 가진 테스토스테론의 유도체이다.
합성
순서 1:플루옥시메스테론 합성의 첫 번째 단계는 Actinomyces에 의한 시판 안드로스테디온(1.11)의 미생물 산화입니다. 이는 11α 위치(1.12)에 수산기를 도입하고, 그 후 Jones 시약을 사용하여 케톤으로 산화하여 3,11,17-트리케톤, 아드레노스테론(1.13)을 생성합니다.피롤리딘은 이후 3α-케토기와 반응하여 에나민(1.14)을 형성하고, 후속 단계에서 알킬화로부터 에나민을 보호한다.3α 위치에서 반응하기 위한 피롤리딘의 위치선택성은 스테릭하게 부피가 큰 메틸기의 위치 때문에 아드레노스테론 구조에서 본질적으로 발생한다.후속 공정에서 그리냐드 시약을 사용한 17-케토기(1.14)의 알킬화, 11-위치에서의 수소화물 첨가(1.15) 및 보호되는 3-케토기 재생은 플루옥시메스테론 합성의 최종 공정의 시작 물질(1.16)을 생성한다.여기에는 보다 표준적인 합성 변환이 필요합니다.
순서 2: 시작 물질의 11α-히드록실(1.16)은 p-톨루엔술포닐염화물에 의해 술포닐화되며 트리메틸아민(베이스)을 첨가하면 11α-탄소가 탈양성자화되어 (E2) 토실레이트(pka - 5)가 제거되어 올레핀(1.17)이 된다.브로모늄 중간체(NBS)의 형성에 의해 올레핀과 하이포브롬산(HOBr)의 반응 스테레오특이성을 판정하고 친전자성 브로모늄 양이온은 고리의 입체적으로 저해되지 않는 α면에 접근하여 알켄의 γ전자 밀도에 의해 공격된다.그런 다음 수산화 이온은 11-탄소 고리(β-face) 위에서 공격하여 이중 결합에 걸쳐 히드록실 및 브롬의 입체 특이적 첨가에 의해 구조(1.18)를 생성한다.수산화나트륨을 첨가하면 11α-히드록실기의 탈양성자가 발생하며, 후속 구조는 분자N 내 S2 에폭시 고리를 형성한다.β-에폭시드(1.19)의 에폭시 고리는 프로톤화되어 옥시르늄 이온 중간체를 생성한다.조합공정에서는 2개의 산소-탄소 결합 중 하나가 반대면에서 파괴되어 불소가 링의 α면을 아래쪽에서 공격함으로써 불소 치환기에 대한 11α-히드록실 트랜스를 재생한다.결과 구조(1.20)는 안드로겐 스테로이드인 플루옥시메스테론이다.
체액 검출
스포츠에서 할로테스틴 및 기타 불법 아나볼릭 스테로이드 검출은 소변에서 배설되는 아나볼릭 스테로이드 및 그 대사물의 GS-MS 동정법에 의해 달성된다.뇨시료에서 얻은 건조잔기를 디메틸포름아미드 및 황트리옥시드피리딘 복합체에 용해하여 1% 탄산칼륨 용액으로 가열한다.할로테스틴과 그것의 많은 대사물은 두 개의 극성 하이드록실기를 포함하고, 그들의 끓는점을 증가시키고 휘발성을 감소시키는 분자간 수소 결합을 이끈다.GC-MS용 가스 시료를 얻기 위해 가수분해 생성물을 추출하여 메탄올에 용해하고 N-메틸-트리메틸실릴-트리플루오로아세트아미드(MSTFA) 및 트리메틸실릴리미다졸(MSTI)을 첨가하여 휘발성 트리메틸실릴실릴(TMS)[26] 에스테르를 형성한다.
역사
플루옥시메스테론은 1956년에 처음 설명되었고 [1][10]1957년 미국에서 의료용으로 도입되었다.시간이 지나면서 플루옥시메스테론의 사용은 점점 더 논란이 되고 제한적이 되었다.[1]
사회와 문화
일반명
플루옥시메스테론은 약의 총칭이며, 플루옥시메스테론은 약의 [24][25][27][28]총칭이다.
브랜드명
플루옥시메스테론의 브랜드명은 안드로이드-F, 안드로옥시, 할로테스틴, 오라-테스트릴,[24][25][27][28] 울탄드렌 등이다.
유용성
미국
플루옥시메스테론은 미국에서 [29]의료용으로 사용 가능한 몇 안 되는 AAS 중 하나입니다.기타(2017년 11월 기준)는 테스토스테론, 테스토스테론 사이피온산염, 테스토스테론 에난산염, 테스토스테론 운데칸산염, 메틸테스토스테론, 옥산드로론,[29] 옥시메트로론이다.
기타 국가
플루옥시메스테론은 미국 이외에는 거의 구할 수 없지만 멕시코, 몰도바, 대만 [1][28]등 일부 국가에서는 시판되고 있다.
법적 상태
플루옥시메스테론은 다른 AAS와 함께 규제 물질법에 [30]따라 미국의 스케줄 III 규제 물질이다.
레퍼런스
- ^ a b c d e f g h i j k l m n o p q r s t u v w x William Llewellyn (2011). Anabolics. Molecular Nutrition Llc. pp. 500–508. ISBN 978-0-9828280-1-4.
- ^ a b c d Thomas L. Lemke; David A. Williams (24 January 2012). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. pp. 1360–. ISBN 978-1-60913-345-0.
- ^ a b c d e f g h Kammerer RC, Merdink JL, Jagels M, Catlin DH, Hui KK (1990). "Testing for fluoxymesterone (Halotestin) administration to man: identification of urinary metabolites by gas chromatography-mass spectrometry". J. Steroid Biochem. 36 (6): 659–66. doi:10.1016/0022-4731(90)90185-u. PMID 2214783.
- ^ a b 세스 로버츠(2009).동화 약리학.
- ^ Thomas L. Lemke; David A. Williams (2008). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. pp. 1279–. ISBN 978-0-7817-6879-5.
- ^ a b c d e f Fürstenberger C, Vuorinen A, Da Cunha T, Kratschmar DV, Saugy M, Schuster D, Odermatt A (2012). "The anabolic androgenic steroid fluoxymesterone inhibits 11β-hydroxysteroid dehydrogenase 2-dependent glucocorticoid inactivation". Toxicol. Sci. 126 (2): 353–61. doi:10.1093/toxsci/kfs022. PMID 22273746.
- ^ a b c d Joseph JF, Parr MK (2015). "Synthetic androgens as designer supplements". Curr Neuropharmacol. 13 (1): 89–100. doi:10.2174/1570159X13666141210224756. PMC 4462045. PMID 26074745.
- ^ Kicman AT (2008). "Pharmacology of anabolic steroids". Br. J. Pharmacol. 154 (3): 502–21. doi:10.1038/bjp.2008.165. PMC 2439524. PMID 18500378.
- ^ a b c Charles D. Kochakian (6 December 2012). Anabolic-Androgenic Steroids. Springer Science & Business Media. pp. 370, 374, 401, 454, 504–506. ISBN 978-3-642-66353-6.
- ^ a b William Andrew Publishing (22 October 2013). Pharmaceutical Manufacturing Encyclopedia, 3rd Edition. Elsevier. pp. 1676–. ISBN 978-0-8155-1856-3.
- ^ Susan M. Ford; Sally S. Roach (7 October 2013). Roach's Introductory Clinical Pharmacology. Lippincott Williams & Wilkins. pp. 502–. ISBN 978-1-4698-3214-2.
- ^ "Fluoxymesterone - AdisInsight".
- ^ John A. Thomas; Edward J. Keenan (6 December 2012). Principles of Endocrine Pharmacology. Springer Science & Business Media. pp. 125–. ISBN 978-1-4684-5036-1.
- ^ Jacques Lorrain (1994). Comprehensive Management of Menopause. Springer Science & Business Media. pp. 301–. ISBN 978-0-387-97972-4.
- ^ Jerome Z. Litt; Neil Shear (17 December 2014). Litt's Drug Eruptions and Reactions Manual, 19th Edition. CRC Press. pp. 177–. ISBN 978-1-84214-599-9.
- ^ a b c d e Kicman, A T (2008). "Pharmacology of anabolic steroids". British Journal of Pharmacology. 154 (3): 502–521. doi:10.1038/bjp.2008.165. PMC 2439524. PMID 18500378.
- ^ Attardi BJ, Pham TC, Radler LC, Burgenson J, Hild SA, Reel JR (2008). "Dimethandrolone (7alpha,11beta-dimethyl-19-nortestosterone) and 11beta-methyl-19-nortestosterone are not converted to aromatic A-ring products in the presence of recombinant human aromatase". J. Steroid Biochem. Mol. Biol. 110 (3–5): 214–22. doi:10.1016/j.jsbmb.2007.11.009. PMC 2575079. PMID 18555683.
- ^ Norman T. Adler; Donald Pfaff; Robert W. Goy (6 December 2012). Reproduction. Springer Science & Business Media. pp. 630–. ISBN 978-1-4684-4832-0.
- ^ Lo TE, Andal ZC, Lantion-Ang FL (2015). "Fluoxymesterone-induced gynaecomastia in a patient with childhood aplastic anaemia". BMJ Case Rep. 2015: bcr2014207474. doi:10.1136/bcr-2014-207474. PMC 4434366. PMID 25948845.
- ^ Kirschbaum J (27 October 1978). Profiles of Drug Substances, Excipients and Related Methodology. Academic Press. pp. 253–. ISBN 978-0-08-086102-9.
- ^ Mayer M, Rosen F (1975). "Interaction of anabolic steroids with glucocorticoid receptor sites in rat muscle cytosol". Am. J. Physiol. 229 (5): 1381–6. doi:10.1152/ajplegacy.1975.229.5.1381. PMID 173192.
- ^ Saartok T, Dahlberg E, Gustafsson JA (1984). "Relative binding affinity of anabolic-androgenic steroids: comparison of the binding to the androgen receptors in skeletal muscle and in prostate, as well as to sex hormone-binding globulin". Endocrinology. 114 (6): 2100–6. doi:10.1210/endo-114-6-2100. PMID 6539197.
- ^ Gordan, G. S. (1976). "Cancer in Man". In Kochakian, Charles D. (ed.). Anabolic-Androgenic Steroids. pp. 499–513. doi:10.1007/978-3-642-66353-6_16. ISBN 978-3-642-66355-0.
- ^ a b c d J. Elks (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 568–. ISBN 978-1-4757-2085-3.
- ^ a b c d Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. p. 461. ISBN 978-3-88763-075-1.
- ^ Schänzer, Willi; Opfermann, Georg; Donike, Manfred (1992-11-01). "17-Epimerization of 17α-methyl anabolic steroids in humans: metabolism and synthesis of 17α-hydroxy-17β-methyl steroids". Steroids. 57 (11): 537–550. doi:10.1016/0039-128X(92)90023-3. PMID 1448813. S2CID 54380880.
- ^ a b I.K. Morton; Judith M. Hall (6 December 2012). Concise Dictionary of Pharmacological Agents: Properties and Synonyms. Springer Science & Business Media. pp. 123–. ISBN 978-94-011-4439-1.
- ^ a b c "Fluoxymesterone: Indications, Side Effects, Warnings".
- ^ a b "Drugs@FDA: FDA Approved Drug Products". United States Food and Drug Administration. Retrieved 17 December 2016.
- ^ Steven B. Karch (21 December 2006). Drug Abuse Handbook, Second Edition. CRC Press. pp. 30–. ISBN 978-1-4200-0346-8.
외부 링크