클로르마디논아세테이트
Chlormadinone acetate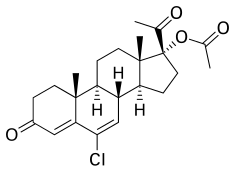 | |
 | |
| 임상 데이터 | |
|---|---|
| 상호 | 벨라라, 루테랑, 프로스탈 등 |
| 기타 이름 | CMA, RS-1280, ICI-39575, STG-155, NSC-92338, 17α-Acetxy-6-dehydropgesterone, 17α-Acetoxy-6-클로로프레그나-4,6-diene-3,20-dion |
| 루트 행정부. | 입으로[1] |
| 약물 클래스 | 프로게스토겐, 프로게스틴, 프로게스토겐에스테르, 안티고나도트로핀, 스테로이드항안드로겐 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 |
|
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 100%[1][2][3] |
| 단백질 결합 | 96.6~99.4% (알부민 및 비알부민 또는 [1][2]) |
| 대사 | 간(환원, 히드록실화, 탈아세틸화, 결합)[1][3] |
| 대사물 | • 3α-Hydroxy-CMA[4][1] • 3β-Hydroxy-CMA[4][1] • 기타[1] |
| 반감기 제거 | 25 ~ 89 시간[5][1][2][6] |
| 배설물 | 소변: 33~45%[6][2] 대변: 24~41%[6][2] |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.005.563 |
| 화학 및 물리 데이터 | |
| 공식 | C23H29클론O4 |
| 몰 질량 | 404.93 g/g−1/g/g |
| 3D 모델(JSmol) | |
| |
| |
클로르마디논아세테이트(CMA)는 벨라라, 기노렐, 루테란, 프로스탈 등의 브랜드명으로 판매되는 프로게스틴 및 항안드로겐 약물로 산부인과적 장애 치료 및 산부인과적 조건 치료에 있어 폐경호르몬 요법의 성분으로 피임약에 사용된다.남성의 경우 전립선암과 전립선암이 확대되고 여성의 [1][5][7][2][8][9][10]경우 여드름과 다모증과 같은 증상이 나타난다.피임약의 에스트로겐과 함께 저용량, 저용량, 저용량, 고용량, 저용량, 저용량, 고용량, 저용량, 저용량, 저용량, 저용량, 저용량, 저용량, 저용량, 저용량, 저용량에서 다양한 [11]징후를 볼 수 있다.입으로 [1]먹는 거예요.
에스트로겐과 CMA의 조합의 부작용으로는 생리불순, 두통, 메스꺼움, 유방 압통, 질 분비물 [2]등이 있습니다.높은 용량에서, CMA는 다른 [12][13]부작용들 중에서 성적 기능 장애, 탈마스크린화, 부신 기능 부전, 탄수화물 대사의 변화를 일으킬 수 있다.이 약물은 프로게스틴 또는 합성 프로게스토겐이며, 따라서 프로게스테론과 같은 프로게스테론의 생물학적 표적인 프로게스테론 [1]수용체의 작용제이다.또한 항안드로겐이므로 테스토스테론 [1]및 디히드로테스토스테론과 같은 안드로겐의 생물학적 표적인 안드로겐 수용체의 길항제이다.CMA는 프로게스토제네틱 활성으로 인해 항나토픽 효과가 [1][14][15]있다.그 약은 글루코콜티코이드 활성도가 약하고 다른 중요한 호르몬 [1]활성은 없다.
CMA는 1959년에 발견되어 1965년에 [16][17][18]의료용으로 도입되었습니다.그것은 "1세대" 프로게스틴으로 [19]여겨질 수 있다.1970년 일부 국가에서는 개에게 관찰된 유방독성에 대한 우려로 이 약물은 철회됐지만 사람에게는 [7][20][21][22][23]적용되지 않는 것으로 드러났다.CMA는 피임약으로 전 세계에 널리 보급되어 있지만, 특히 영어권 [24][11]국가에서는 판매되지 않는다.프랑스, 멕시코, 일본, 한국을 포함한 [24][11]몇몇 국가에서만 단독으로 이용할 수 있다.
의료 용도
CMA는 에스트로겐인 에티닐에스트라디올(EE)과 함께 저용량으로 피임약에 [5][25]사용된다.질 출혈, 올리고메노레아, 다발성월경, 다발성월경, 고월경, 2차 무월경, 자궁내막증 등의 산부인과 질환의 치료에도 사용되고 있으며 프랑스에서는 [7][5][25]에스트로겐과 함께 폐경호르몬 요법(브랜드명 루테랑)에 사용되고 있다.CMA는 복합 피임약에 하루 1~2mg의 용량으로, 산부인과 [24]질환 치료에 하루 2-10mg의 용량으로 사용된다.EE와 CMA를 포함한 복합 피임약은 피부와 [2][26][27]모발 상태와 같은 안드로겐 의존 증상을 줄이는데 유용한 것으로 밝혀졌다.하루에 15~20mg의 CMA를 복용하면 [1]핫플래시가 개선되는 것으로 밝혀졌다.고용량 CMA 전용 정제는 프로게스토겐 전용 산아제한의 한 형태로 사용되지만,[28] 특별히 사용이 허가되지는 않았다.
CMA는 일본과 한국에서 전립선암과 양성 전립선 과형성증(BPH) 치료에 안드로겐 결핍 치료의 수단으로 널리 사용되어 왔지만 세계 [8][9][10][13][11]다른 지역에서는 거의 사용되지 않았다.그것은 전립선 [24]질환 치료에 하루에 50~100mg의 용량으로 사용된다.시프로테론 아세테이트(CPA)와 유사하게, CMA는 고나도트로핀 방출 호르몬 유사체(GnRH 유사체)[13]보다 핫 플래시 위험이 낮다.이 약은 CPA를 제외한 유일한 스테로이드 항안드로겐으로 전립선암 치료에 사용되었으며, 아세트산 메게스트롤도 연구되었지만 [7][29]승인되지 않았다.
CMA는 또한 여성의 여드름, 지루증, 다모증, 그리고 패턴 탈모와 같은 다른 안드로겐 의존성 질환의 치료에 효과가 있는 것으로 밝혀졌는데,[7][2][30][27] CPA와 비슷합니다.그것은 [7]소녀들의 성조숙증 치료에 하루에 4에서 12mg의 적당한 용량으로 연구되었다.이 소녀들에게서 메드록시프로게스테론 아세테이트와 유사한 효능을 보였으며 유방 성장과 [7]월경 등 조기발육을 감소시키기는 하지만 폐지하지는 않는 것으로 나타났다.여자아이들에게서 액와모발 성장이 약간 또는 전혀 관찰되지 않았다.[7]CMA는 주로 일본에서만 사용되지만 CPA나 스피로노락톤과 마찬가지로 트랜스젠더 여성 호르몬 치료의 성분으로 사용되어 왔다.[31]
CMA는 전립선암에 [32][33]걸린 남성의 고나도트로핀 방출 호르몬 작용제 치료 시작 시 테스토스테론 플레어 예방에 사용되어 왔다.
이용 가능한 폼
CMA 구강 약의 낮은 복용에 폼에서(2mg)EE와 피임 약에서 조합에(예를 들어, Belara 독일에서)[34]에 최저치에 적당한 양(2,5,10,25mg)혼자(예를 들어, 멕시코 Lutéran 프랑스에서 Lutoral로)[35][36]과 많은 양(50mg)에서 혼자(예를 들어, Prostal에 일본과 Prostal-L에 한국)이용할 수 있다.[11][37]
금지 사항
EE와 CMA를 포함하는 것과 같은 복합 피임약의 금기사항에는 알려진 또는 의심되는 임신, 수유 및 모유 수유, 혈전 색전증, 담즙혈전증(그러나 간경화나 만성 간염은 아님), 유방암 [38]등이 포함된다.CMA는 동물에서 테라토겐으로 남성 태아의 여성화와 같은 태아 손상을 일으킬 수 있습니다.[39][40]
부작용
EE와 저선량 CMA를 포함한 피임약의 가장 흔한 부작용은 [2]생리 이상, 두통(37%), 메스꺼움(23%), 유방 압통(22%), 질 분비물(19%) 등이다.이러한 제제는 여성의 성욕이나 기능에 부정적인 영향을 미치지 않으며 우울증, 감정 변화 또는 체중 [25][5]증가의 위험을 거의 또는 전혀 보이지 않습니다.고용량 CMA는 성기능 장애(예: 성욕 저하, 발기 장애), 체모 감소, 부신 기능 저하 및 탄수화물 신진대사의 [12][13]변화와 관련이 있다.반대로 가슴의 불쾌감이나 부인과 [7]같은 에스트로겐의 부작용은 없습니다.CMA는 정맥혈전 [25][5]색전증의 위험을 증가시키지 않는다.CMA와 [23]함께 자가면역 프로게스테론 피부염에 대한 보고가 있다. 다른 프로게스틴과 마찬가지로 프로게스테론과는 대조적으로, CMA는 폐경 호르몬 [41]치료에서 에스트로겐과 함께 사용하면 유방암의 위험을 크게 높이는 것으로 밝혀졌다.CMA 또는 [2]CPA가 포함된 복합 피임약을 복용하는 여성에게서 간 기능 검사에서 이상이 관찰되지 않았다.CPA와 달리 고용량 CMA는 간독성과 [13]관련이 없는 것으로 보인다.
아세트산메게스트롤 및 아세트산메드록시프로게스테론과 유사하게, CMA는 바이오아세이에서 [42][43][44][45][46]CPA보다 간유전독성과 발암성에 대한 잠재성이 낮은 것으로 보인다.이는 [43][47][44]스테로이드에서 CPA의 C1α,2α 메틸렌 그룹의 결핍과 관련이 있는 것으로 보인다.CMA를 [45][42]포함한 피임약을 복용하는 여성에게서 간세포암 사례가 보고되었지만, CMA를 포함한 피임약과 관련된 여성의 간 종양 발병률은 다른 프로게스틴을 [45]포함한 피임약과 유사한 것으로 보인다.
과다 복용
CMA는 심각한 부작용이나 독성을 [7][48]설명하지 않고 경구 주입을 통해 하루에 1,000~2,000mg, 근육 내 주입을 통해 100~500mg의 대량 투여로 진행성 전립선암을 가진 남성을 대상으로 연구되었다.
상호 작용
CMA는 시토크롬 P450 효소를 억제하지 않기 때문에 19-노르테스토스테론 [5][2]프로게스틴보다 약물 상호작용 위험이 낮을 수 있다.
약리학
약역학
CMA는 프로게스토겐 활성, 항나토픽 효과, 항안드로겐 활성 및 약한 글루코콜티코이드 [1][2]활성을 가지고 있다.
| 컴파운드 | PR | AR | ER | GR | MR | SHBG | CBG | |
|---|---|---|---|---|---|---|---|---|
| CMA | 67–172 | 3–76 | 0 | 8 | 0 | 0 | 0 | |
| 3α-Hydroxy-CMA | 33 | 4 | ? | 2 | ? | ? | ? | |
| 3β-Hydroxy-CMA | 72 | 15 | ? | 6 | ? | ? | ? | |
| 주의: 값은 백분율(%)입니다.참조 리간드(100%)는 의 경우 프로메게스톤, 의 경우 메트리볼론, 의 경우 알도스테론, 의 경우 코르티솔이었습니다. 출처: | ||||||||
프로게스토겐 활성
CMA는 프로게스토겐 또는 프로게스테론 [1][2]수용체의 작용제이다.클라우버그 테스트에서 프로게스테론의 약 330배, McPhail [7][2]분석에서 프로게스테론의 경구 효능의 약 2,000배에서 10,000배 정도로 프로게스테론의 프로게스테론의 프로게스테론 활성에 매우 강력합니다.비교를 위해 Clauberg 분석에서 메드록시프로게스테론의 아세트산염과 [7]CPA의 효력은 각각 프로게스테론의 약 330배,CMA의 프로게스트제닉 활성은 기능적 항나트륨 및 항에스트로겐 효과와 피임 효과에 [1][25][7]책임이 있다.여성의 CMA 경구배란 억제 용량은 1.5~4mg/일이며 자궁내막 변환 용량은 25mg/[1][49]사이클이다.배란 억제에 대한 한 연구에서 CMA는 1mg/일 68%, 2mg/일 85%, 4mg/[50]일 100% 유효했다.프로게스토겐 전용 피임약으로서의 CMA의 유효 용량은 0.5mg/[51][52][49]일입니다.이 용량에서는 배란 억제는 불완전하며 대신 자궁내막과 [52][49]자궁경부의 프로게스토겐 변화를 통해 피임 효과가 주로 달성된다.
토끼 생체측정에서 PR 활성화는 CMA와 주요 활성대사물인 아세트산 3α-히드록시클로마디논(3α-OH-CMA)과 아세트산 3β-히드록시클로마디논(3β-OH-CMA)[4]에서 유사했다.
항나토픽 효과
CMA는 그 프로게스토겐성 활성에 의해 항나트륨 효과가 있으므로 뇌하수체로부터의 성선도트로핀 황체화호르몬(LH) 및 모낭자극호르몬([2][53][12]FSH) 분비를 억제할 수 있다.그 결과 CMA는 배란 및 성선 호르몬 생성을 억제하고 충분히 높은 [2][53][12]용량으로 순환 테스토스테론 및 에스트라디올 수치를 크게 낮출 수 있다.하루에 50mg의 [12]용량으로 복용한 약은 BPH를 가진 남성에서 테스토스테론 수치를 약 76-85%(약 50-100ng/dL)까지 억제하고 에스트라디올 수치를 약 55-59%(약 7-8pg/mL)까지 억제하는 것으로 밝혀졌다.이와 같이 CMA는 항안드로겐 [2][14][15]및 항에스트로겐 효과를 통해 강력한 기능성 항안드로겐 및 항에스트로겐 효과를 가진다.
항안드로겐 활성
CMA는 수용체에 대한 CPA 친화력의 약 30~40%, [1][54]동물에서 CPA의 항안드로겐 효력의 약 20%를 가진 강력한 항안드로겐 또는 안드로겐 수용체(AR)의 길항제이다.CPA, 아세트산메게스트롤, 스피로노락톤과 같이 항안드로겐 활성을 가지지만 플루트아미드 및 비칼루타미드와 같은 비스테로이드성 항안드로겐과 달리 CMA는 AR의 사일런트 길항제라기보다는 보다 효율적인 작용제가 없을 때 수용체를 활성화하는 능력을 가진 약한 부분작용제이다.스토스테론[25][55]토끼 바이오어세이에서 AR 길항작용은 CMA와 3α-OH-CMA는 [4]비슷했으나 3β-OH-CMA는 낮았다. CMA의 항나토픽 작용과 항안드로겐 작용은 모두 전립선암 [13]치료에 효과가 있는 것으로 생각된다.
저용량 CMA와 EE를 조합한 피임약과 같이 CMA의 항안드로겐 활성은 성호르몬결합글로불린(SHBG) 수치가 크게 증가하고 그에 따라 [25][56]EE에 의해 유도되는 유리 테스토스테론 수치가 떨어지기 때문에 강화된다.레보노르게스트렐과 같은 19-노르테스토스테론 프로게스틴과는 달리, CMA는 SHBG [25][56]수치에서 EE 유도 증가를 억제하지 않는다.
기타 액티비티
공인 회계사 같은 다른 17α-hydroxyprogesterone 파생 상품, 아세트 산 메드 록시 프로게스테론., 그리고 megestrol 아세테이트 유사하게 CMA, 잠재력을 지닌 갑작스러운 중단에 충분한 마시면에 부신 기능 부전을 유발하기 위해 가지고 있는 글루코 코르티코이드 수용체(그 프로게스테론의)과 약한 당질 코르티코이드 활동에 약한 호감이 있다.[57][58][25]그러나 이 약물은 [2]피임약에 존재하는 용량보다 훨씬 높은 용량에서만 유의한 글루코콜티코이드 활성을 보인다.토끼 생체측정에서 GR 활성화는 CMA에서 가장 높았지만 3α-OH-CMA에서는 덜하였으며, 3β-OH-CMA에서는 관찰되지 않았다(대조적으로 [4]GR의 낮은 유효성 부분작용제 또는 길항제일 수 있음).CMA는 에스트로겐 수용체나 미네랄코르티코이드 수용체에 친화력이 없으며 에스트로겐성 또는 항미네랄로코르티코이드 [1][2][5]활성도 없다.프로게스테론과 달리 다른 프로게스틴과 유사하게 CMA는 알려진 신경스테로이드 활성(예: GABAA 수용체 변조)이나 진정 효과가 [1]없다.
CMA는 5α-환원효소의 [25][59]경쟁적 억제제인 것으로 보고되었다.그러나 이 작용에서는 1μM 농도에서 효소가 0.0% 억제되어 효소가 매우 낮은 효력을 보이는 것으로 보이며, 이와 관련하여 [1][5]효소에 중요한 영향을 미치지 않는 것으로 알려져 있다.CMA는 또한 높은 [2]용량에서 테스토스테론 생합성 억제제로서 약하게 작용할 수 있다.19-노르테스토스테론 프로게스틴과 달리, CMA는 시토크롬 P450 시스템에서 효소를 억제하지 않으며, 이것은 CMA에게 약물 [5][2]상호작용의 낮은 위험을 줄 수 있습니다.
특정 프로게스틴은 체외에서 MCF-7 유방암 세포의 증식을 자극하는 것으로 밝혀졌는데, 이는 기존의 PR과는 무관하며 대신 프로게스테론 수용체 막 성분-1(PGRMC1)[60]을 통해 매개된다.반면 프로게스테론과 CMA는 [60]이 분석에서 중성적으로 작용합니다.이러한 발견이 임상 [61]연구에서 프로게스테론과 프로게스틴에서 관찰되는 유방암의 다른 위험을 설명할 수 있을지는 불분명하다.
약동학
CMA의 경구 생체 가용성은 100%이며,[1][2][3] 이는 낮은 퍼스트패스 대사 때문이다.30μg EE와 조합하여 약 1~2시간 후 CMA 2mg 경구 투여 시 최대 혈청 레벨 1.6ng/mL가 생성되었으며, 만성 투여 시 정상 상태 레벨 2.0ng/mL가 [1][5][2]생성되었다.CMA의 정상 농도는 7~[2][5]15일 후에 달성됩니다.CMA의 분포 반감기는 약 2.5시간입니다.[1][3][6]이 약은 매우 친유성이며 지방과 일부 여성 생식 조직에 흡수되어 축적되지만, 이는 높은 용량(예: 하루에 [2][1]10mg 이상)에서만 발생할 수 있다.CMA의 분포량은 알 수 없지만 밀접하게 관련된 스테로이드 CPA의 분포량은 1,300L로 [2]매우 크다.CMA의 혈장 단백질 결합은 96.6~99.4%이며,[1][2] 유리도는 약 1~3%이다.SHBG 또는 코르티코스테로이드 결합 글로불린에 [1]대한 친화력이 없이 알부민과 결합한다.
CMA는 환원, 히드록실화, 탈아세틸화 및 [1][2]결합에 의해 간에서 광범위하게 대사된다.γ이중결합이4(5) 보존된 C3케톤에서 환원되고, 히드록실화는 C2α, C3α, C3β 및 C15β 위치에 있으며, 포합은 글루쿠론화 [1]및 황화를 포함한다.CMA의 주요 대사물은 2α-OH-CMA, 3α-OH-CMA 및 3β-OH-CMA이며, 후자는 중요한 활성 대사물이다.[2][4]CMA의 다른 대사물은 비활성이다.[2]CMA의 제거 반감기는 1회 투여 후 25 - 34시간, 복수 투여 후 34 - 39시간으로 보고되었지만, 일부 출판물은 80 - [1][2][25][5][6]89시간으로 보고되었다.CMA의 장간 재흡수가 발생합니다.[2]이 약물은 담즙뿐만 아니라 소변에서 33~45%,[6][2][1] 대변에서 24~41% 배설되는 것으로 밝혀졌다.투여 후 7일 후에 74%의 용량만 배출되는데, 이는 조직에 CMA가 축적되고 [1]클리어런스가 낮기 때문이다.
화학
17α-아세톡시-6-클로로-6-데히드로게스테론 또는 17α-아세톡시-6-클로로프레그나-4,6-디엔-3,20-디온이라고도 하는 CMA는 합성 프레그난 스테로이드 및 프로게스테론의 [62][63]유도체이다.특히 C6 위치에 염소 원자를, C6 및 C7 위치에 이중 결합을, C17α [62][63]위치에 아세테이트 에스테르를 가진 17α-히드록시프로게스테론의 유도체이다.CMA는 클로르마디논의 C17α 아세테이트 에스테르로, CMA와는 대조적으로 [62][63]시판되지 않았다.CMA의 유사물은 아세트산 델마디논, 카프로에스테론 카프로에스테론, 아세트산 메드록시프로게스테론, 아세트산 메게스트롤 및 아세트산 [62][63]오사테론 등의 기타 17α-히드록시프로게스테론 유도체를 포함한다.CMA는 CPA의 [62][63]1α,2α-메틸렌 치환량이 없다는 점을 제외하고는 CPA와 화학적 구조가 동일합니다.또한 CMA의 구조는 비슷하게 A-링 [62][63]변형이 있는 델마디논 아세테이트 및 오사테론 아세테이트의 구조와 거의 동일하다.
합성
CMA의 화학 합성물이 [64][37][65][66]발표되었습니다.
역사
CMA는 [16][65]1959년에 발견되어 처음 기술되었다.미국에서는 [17][18]1965년부터 1971년까지 Eli Lilly에 의해 C-Quens라는 브랜드명으로 Mestranol과 함께 판매되었다.CMA에 소개된 최초의 순차 피임약으로 오보시스톤, 아콘켄, 세켄스라는 [67][68]브랜드명으로 메스트라놀과 함께 판매되고 있다.비글견의 유선결절 발견(아래 참조)으로 인해 C-Quens는 1971년 Elli Lilly에 의해 자발적으로 시장에서 철수하였고 1972년 [69]CMA의 모든 경구 피임약은 중단되었다.하지만,[70] 후속 연구는 인간에게는 그러한 위험이 없다는 것을 발견했고, CMA는 독일과 [71]중국과 같은 많은 다른 나라들에서 경구 피임약으로 계속 널리 사용되어 왔다.CMA의 항안드로겐 활성은 [5][72]1966년에 처음 기술되었으며, 이후 전립선암과 [8][9][10][13]같은 안드로겐 의존성 질환의 치료에 높은 용량에서만 사용할 수 있도록 개발되었습니다.
1960년대에 CMA는 경구 피임약의 [17][18]성분으로 도입되었다.그러나 1970년경, 비글견에게 [7][20][21][22][23]CMA가 놀라운 유선종양을 유발한다는 발견으로 인해 미국과 영국 같은 많은 시장에서 그러한 제제가 철회되었다.결절의 원인이 된 투여 선량은 장기(2-4년) 동안 권장된 인간 투여량의 10~25배였으며, [7][20][21]인간 투여량의 1~2배로 치료된 개에서는 종양이 발견되지 않았다.CMA 외에도, 유방 종양은 메드록시프로게스테론 아세트산, 메게스트롤 아세트산 및 아나그스톤 아세트산염을 포함한 다양한 다른 17α-히드록시프로게스테론 유도체를 가진 개에서 발견되었으며, 또한 호르몬 피임 표시를 위해 중단되었다(메드록시프로게스테론 아세트산염이 다시 [20][21]도입된 이후).종양은 에티네론 및 클로로에틸노르게스트렐뿐만 아니라 프로게스테론에서도 관찰되었지만,[20] 특히 시중에 남아 있는 비할로겐화 19-노르테스토스테론 유도체 노르게스트렐, 노르에스티론, 노르테노드렐 또는 어원노디올 디아세테이트에서도 관찰되지 않았다.어쨌든, Hughes et al.에 따르면, "개 유선이 프로게스토겐에 [7]의해 직접적으로 유지될 수 있는 유일한 것으로 보이기 때문에 이러한 발견들이 인간과 얼마나 관련이 있는지는 여전히 의문이다."후속 연구는 개와 인간 사이의 종 차이를 밝혀냈고 [70]인간에게는 유사한 위험이 없다는 것을 밝혀냈다.
CMA는 프로게스토겐 전용 알약으로 연구된 최초의 프로게스토겐이었다.[73]비글견에서 [73]독성이 발견된 후 그것은 중단되었고 노르에스티스테론, 노르게스트렐과 같은 다른 프로게스틴으로 대체되었다.
사회와 문화
일반명
클로르마디논 아세테이트는 약과 그것의 , , , ,[62][63][11] 그리고 총칭이다.개발 코드명 RS-1280으로도 [11]알려져 있다.
브랜드명
CMA는 Clordion, Gestafortin, Gestogan, Lormin, Lutéran, Lutoral, Menstridyl, Non-Ovlon, Normenon, Prococyd, Progestormon, Synchrogeston,[62][63][11][37] Verton 등 전 세계에서 다양한 브랜드명으로 판매되고 있습니다.그것은 브랜드명 Belara로 EE와 조합하여 가장 일반적으로 판매되고 있으며,[11] 그 중에서도 Belarina는 더 적은 수준으로 Belarina라는 브랜드명으로 판매되고 있다.이 약은 애니퍼틸, 크로노신, 사이클로놈, 비옥한텐, 싱크로신 등의 [63][11]상표로 수의학에서 사용하기 위해 판매되고 있습니다.
유용성

CMA는 프랑스(브랜드명 Lutéran), 독일(제너럴, 이전 Gestafortin), 일본(브랜드명 Prostal), 멕시코(브랜드명 Lutoral), 한국(브랜드명 Prostal-L)[24][74][11][63]에서 저용량, 중용량 및/또는 고용량으로만 제공됩니다.유럽 및 중남미 대부분 지역과 일본, 태국, 이스라엘, 레바논, 튀니지 및 오만(특히 한국은 [24][74][11][63]제외)을 포함한 많은 국가에서 EE와 함께 사용할 수 있습니다.CMA는 미국, 캐나다, 영국, 아일랜드, 남아프리카, 호주, 뉴질랜드를 포함한 영어권 국가에서는 사용할 수 없으며 북유럽 [24][74][11][63]국가에서도 판매되지 않습니다.CMA는 1960년대에 미국과 영국에서 판매되었지만 개의 [7][23]유방 독성에 대한 간헐적인 우려 때문에 1970년에 이들 국가에서 철회되었다.
시대
피임약의 프로게스틴은 때때로 [75][34]세대별로 분류된다.19-노르테스토스테론 프로게스틴은 일관되게 세대로 분류되는 반면, 피임약에 사용되는 임신 프로게스틴은 전형적으로 그러한 분류에서 제외되거나 "잡종" 또는 "임신"[75][34]으로 분류된다.어쨌든, 1965년의 이러한 제제의 도입일에 근거해, CMA는 「1세대」프로게스틴으로 [19]간주할 수 있다.
수의학에서의 사용
CMA는 사람에게 사용되는 것 외에도 [63][11]수의학에도 사용되어 왔다.
레퍼런스
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai Kuhl H (2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration" (PDF). Climacteric. 8 Suppl 1: 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai Raudrant D, Rabe T (2003). "Progestogens with antiandrogenic properties". Drugs. 63 (5): 463–92. doi:10.2165/00003495-200363050-00003. PMID 12600226. S2CID 28436828.
- ^ a b c d Roger Lobo; P.G. Crosignani; Rodolfo Paoletti (31 October 2002). Women's Health and Menopause: New Strategies - Improved Quality of Life. Springer Science & Business Media. pp. 94–. ISBN 978-1-4020-7149-2.
- ^ a b c d e f g Schneider J, Kneip C, Jahnel U (2009). "Comparative effects of chlormadinone acetate and its 3alpha- and 3beta-hydroxy metabolites on progesterone, androgen and glucocorticoid receptors". Pharmacology. 84 (2): 74–81. doi:10.1159/000226601. ISSN 1423-0313. PMID 19590256. S2CID 22855772.
- ^ a b c d e f g h i j k l m n Bouchard P (2005). "Chlormadinone acetate (CMA) in oral contraception--a new opportunity". The European Journal of Contraception & Reproductive Health Care. 10 Suppl 1: 7–11. doi:10.1080/13625180500434889. PMID 16356876. S2CID 22898956.
- ^ a b c d e f Fotherby K (1974). "Metabolism of synthetic steroids by animals and man". Acta Endocrinol Suppl (Copenh). 185: 119–47. doi:10.1530/acta.0.075S119. PMID 4206183.
- ^ a b c d e f g h i j k l m n o p q A. Hughes; S. H. Hasan; G. W. Oertel; H. E. Voss; F. Bahner; F. Neumann; H. Steinbeck; K.-J. Gräf; J. Brotherton; H. J. Horn; R. K. Wagner (27 November 2013). Androgens II and Antiandrogens / Androgene II und Antiandrogene. Springer Science & Business Media. pp. 490, 508, 516–517, 524, 531. ISBN 978-3-642-80859-3.
- ^ a b c Jack H. Mydlo; Ciril J. Godec (11 July 2003). Prostate Cancer: Science and Clinical Practice. Academic Press. pp. 437–. ISBN 978-0-08-049789-1.
- ^ a b c Kanimoto Y, Okada K (November 1991). "[Antiandrogen therapy of benign prostatic hyperplasia--review of the agents evaluation of the clinical results]". Hinyokika Kiyo (in Japanese). 37 (11): 1423–8. PMID 1722627.
- ^ a b c Ishizuka O, Nishizawa O, Hirao Y, Ohshima S (November 2002). "Evidence-based meta-analysis of pharmacotherapy for benign prostatic hypertrophy". Int. J. Urol. 9 (11): 607–12. doi:10.1046/j.1442-2042.2002.00539.x. PMID 12534901. S2CID 8249363.
- ^ a b c d e f g h i j k l m n "Chlormadinone".
- ^ a b c d e f Kumamoto Y, Yamaguchi Y, Sato Y, Suzuki R, Tanda H, Kato S, Mori K, Matsumoto H, Maki A, Kadono M (February 1990). "[Effects of anti-androgens on sexual function. Double-blind comparative studies on allylestrenol and chlormadinone acetate Part I: Nocturnal penile tumescence monitoring]" (PDF). Hinyokika Kiyo (in Japanese). 36 (2): 213–26. PMID 1693037.
- ^ a b c d e f g Fourcade RO, Chatelain C (July 1998). "Androgen deprivation for prostatic carcinoma: a rationale for choosing components". Int. J. Urol. 5 (4): 303–11. doi:10.1111/j.1442-2042.1998.tb00356.x. PMID 9712436.
- ^ a b H.J.T. Coelingh Benni; H.M. Vemer (15 December 1990). Chronic Hyperandrogenic Anovulation. CRC Press. pp. 151–. ISBN 978-1-85070-322-8.
- ^ a b Chassard D, Schatz B (2005). "[The antigonadrotropic activity of chlormadinone acetate in reproductive women]". Gynécologie, Obstétrique & Fertilité (in French). 33 (1–2): 29–34. doi:10.1016/j.gyobfe.2004.12.002. PMID 15752663.
- ^ a b Howard J.A. Carp (9 April 2015). Progestogens in Obstetrics and Gynecology. Springer. pp. 37–38. ISBN 978-3-319-14385-9.
The first progesterone derivative 17-acetoxyprogesterone was developed by Schering in 1954 followed by medroxyprogesterone acetate in 1957. This was followed by [megestrol] acetate and chlormadinone acetate in 1959.
- ^ a b c Richard Patterson (21 December 2012). Drugs in Litigation: Damage Awards Involving Prescription and Nonprescription Drugs. LexisNexis. pp. 184–. ISBN 978-0-327-18698-4.
- ^ a b c d Robert Bud; Bernard S. Finn; Helmuth Trischler (1999). Manifesting Medicine: Bodies and Machines. Taylor & Francis. pp. 113–. ISBN 978-90-5702-408-5.
- ^ a b John David Gordon (2007). Obstetrics, Gynecology & Infertility: Handbook for Clinicians. Scrub Hill Press, Inc. pp. 229–. ISBN 978-0-9645467-7-6.
- ^ a b c d e C.H. Lingeman (6 December 2012). Carcinogenic Hormones. Springer Science & Business Media. pp. 149–. ISBN 978-3-642-81267-5.
- ^ a b c d Christian Streffer; H. Bolt; D. Follesdal; P. Hall; J.G. Hengstler; P. Jacob; D. Oughton; K. Prieß; E. Rehbinder; E. Swaton (11 November 2013). Low Dose Exposures in the Environment: Dose-Effect Relations and Risk Evaluation. Springer Science & Business Media. pp. 135–. ISBN 978-3-662-08422-9.
- ^ a b Gisela Dallenbach-Hellweg (9 March 2013). Histopathology of the Endometrium. Springer Science & Business Media. pp. 183–. ISBN 978-3-662-07788-7.
- ^ a b c d S D Gangolli (31 October 2007). The Dictionary of Substances and their Effects (DOSE). Royal Society of Chemistry. pp. 250–251. ISBN 978-1-84755-754-4.
- ^ a b c d e f g Sweetman, Sean C., ed. (2009). "Sex hormones and their modulators". Martindale: The Complete Drug Reference (36th ed.). London: Pharmaceutical Press. p. 2084. ISBN 978-0-85369-840-1.
- ^ a b c d e f g h i j k Druckmann R (April 2009). "Profile of the progesterone derivative chlormadinone acetate - pharmocodynamic properties and therapeutic applications". Contraception. 79 (4): 272–81. doi:10.1016/j.contraception.2008.10.017. PMID 19272496.
- ^ Jeffrey K. Aronson (21 February 2009). Meyler's Side Effects of Endocrine and Metabolic Drugs. Elsevier. pp. 214–. ISBN 978-0-08-093292-7.
- ^ a b Caruso S, Rugolo S, Agnello C, Romano M, Cianci A (December 2009). "Quality of sexual life in hyperandrogenic women treated with an oral contraceptive containing chlormadinone acetate". J Sex Med. 6 (12): 3376–84. doi:10.1111/j.1743-6109.2009.01529.x. PMID 19832931.
- ^ Gourdy P, Bachelot A, Catteau-Jonard S, Chabbert-Buffet N, Christin-Maître S, Conard J, Fredenrich A, Gompel A, Lamiche-Lorenzini F, Moreau C, Plu-Bureau G, Vambergue A, Vergès B, Kerlan V (November 2012). "Hormonal contraception in women at risk of vascular and metabolic disorders: guidelines of the French Society of Endocrinology". Ann. Endocrinol. (Paris). 73 (5): 469–87. doi:10.1016/j.ando.2012.09.001. PMID 23078975.
- ^ Venner P (1992). "Megestrol acetate in the treatment of metastatic carcinoma of the prostate". Oncology. 49 Suppl 2 (2): 22–7. doi:10.1159/000227123. PMID 1461622.
- ^ B. Gabard; P. Elsner; C. Surber; P. Treffel (28 June 2011). Dermatopharmacology of Topical Preparations: A Product Development-Oriented Approach. Springer Science & Business Media. pp. 279–. ISBN 978-3-642-57145-9.
- ^ Masumori N (May 2012). "Status of sex reassignment surgery for gender identity disorder in Japan". Int. J. Urol. 19 (5): 402–14. doi:10.1111/j.1442-2042.2012.02975.x. PMID 22372595. S2CID 38888396.
- ^ Kotake T, Usami M, Akaza H, Koiso K, Homma Y, Kawabe K, Aso Y, Orikasa S, Shimazaki J, Isaka S, Yoshida O, Hirao Y, Okajima E, Naito S, Kumazawa J, Kanetake H, Saito Y, Ohi Y, Ohashi Y (November 1999). "Goserelin acetate with or without antiandrogen or estrogen in the treatment of patients with advanced prostate cancer: a multicenter, randomized, controlled trial in Japan. Zoladex Study Group". Jpn. J. Clin. Oncol. 29 (11): 562–70. doi:10.1093/jjco/29.11.562. PMID 10678560.
- ^ Yoshida K, Takeuchi S (1995). "Pretreatment with chlormadinone acetate eliminates testosterone surge induced by a luteinizing-hormone-releasing hormone analogue and the risk of disease flare in patients with metastatic carcinoma of the prostate". Eur. Urol. 27 (3): 187–91. doi:10.1159/000475158. PMID 7541358.
- ^ a b c IARC Working Group on the Evaluation of Carcinogenic Risks to Humans; World Health Organization; International Agency for Research on Cancer (2007). Combined Estrogen-progestogen Contraceptives and Combined Estrogen-progestogen Menopausal Therapy. World Health Organization. pp. 44, 434. ISBN 978-92-832-1291-1.
- ^ William Berrebi (20 November 2009). Diagnostics et thérapeutique de poche: Guide pratique du symptôme à la prescription. Armando Editore. pp. 534–. ISBN 978-2-84371-485-6.
- ^ Besnard–Charvet Christelle (21 October 2014). Homeopatie & perimenopauza. Grada Publishing, a.s. pp. 61–. ISBN 978-80-247-5191-7.
- ^ a b c Jürgen Engel; Axel Kleemann; Bernhard Kutscher; Dietmar Reichert (14 May 2014). Pharmaceutical Substances, 5th Edition, 2009: Syntheses, Patents and Applications of the most relevant APIs. Thieme. pp. 273–274. ISBN 978-3-13-179275-4.
- ^ A. Labhart (6 December 2012). Clinical Endocrinology: Theory and Practice. Springer Science & Business Media. pp. 575–. ISBN 978-3-642-96158-8.
- ^ Gómez Vázquez M, Navarra Amayuelas R, Lamarca M, Baquedano L, Romero Ruiz S, Vilar-Checa E, Iniesta MD (September 2011). "Ethinylestradiol/Chlormadinone acetate for use in dermatological disorders". Am J Clin Dermatol. 12 Suppl 1: 13–9. doi:10.2165/1153875-S0-000000000-00000. PMC 7382652. PMID 21895045.
- ^ Thomas H. Shepard; Ronald J. Lemire (2004). Catalog of Teratogenic Agents. JHU Press. pp. 80–. ISBN 978-0-8018-7953-1.
- ^ Sturdee DW (2013). "Are progestins really necessary as part of a combined HRT regimen?" (PDF). Climacteric. 16 Suppl 1: 79–84. doi:10.3109/13697137.2013.803311. PMID 23651281. S2CID 21894200.
- ^ a b Rabe T, Feldmann K, Heinemann L, Runnebaum B (January 1996). "Cyproterone acetate: is it hepato- or genotoxic?". Drug Saf. 14 (1): 25–38. doi:10.2165/00002018-199614010-00004. PMID 8713486. S2CID 11589326.
In principle, DNA adduct formation is not unique for CPA. DNA adducts in the rat liver were also found after in vitro incubation with megestrol and chlormadinone, as well as after in vivo exposure with both these compounds and with ethinylestradiol. [8-11] However, the adduct level generated by chlormadinone and megestrol is about 30 to 50 times lower than that after CPA.[12] [...] with chlormadinone [acetate] we found 5 liver cell adenomas, 5 focal nodular hyperplasias and 1 liver cell carcinoma.
- ^ a b Brambilla G, Martelli A (December 2002). "Are some progestins genotoxic liver carcinogens?". Mutat. Res. 512 (2–3): 155–63. doi:10.1016/S1383-5742(02)00047-9. PMID 12464349.
- ^ a b Werner S, Kunz S, Beckurts T, Heidecke CD, Wolff T, Schwarz LR (December 1997). "Formation of DNA adducts by cyproterone acetate and some structural analogues in primary cultures of human hepatocytes". Mutat. Res. 395 (2–3): 179–87. doi:10.1016/S1383-5718(97)00167-8. PMID 9465929.
- ^ a b c Martelli A, Brambilla Campart G, Ghia M, Allavena A, Mereto E, Brambilla G (March 1996). "Induction of micronuclei and initiation of enzyme-altered foci in the liver of female rats treated with cyproterone acetate, chlormadinone acetate, or megestrol acetate". Carcinogenesis. 17 (3): 551–4. doi:10.1093/carcin/17.3.551. PMID 8631143.
- ^ Martelli A, Mattioli F, Ghia M, Mereto E, Brambilla G (May 1996). "Comparative study of DNA repair induced by cyproterone acetate, chlormadinone acetate and megestrol acetate in primary cultures of human and rat hepatocytes". Carcinogenesis. 17 (5): 1153–6. doi:10.1093/carcin/17.5.1153. PMID 8640927.
- ^ Siddique, Y.H., T. Beg 및 M.Afzal, 2008.일부 합성 프로게스틴의 구조적 관계와 그 유전독성 효과.인: Y.H., Siddique, 독물학의 최근 동향(Ed.Transworld Research Network, Trivandrum, 인도 케랄라, 페이지: 75-84. 978-81-7895-384-7
- ^ Popelier G (May 1973). "[Treatment of the carcinoma of the prostate with gestagens (author's transl)]". Urologe A (in German). 12 (3): 134–9. PMID 4127418.
- ^ a b c Lobo, Rogerio A.; Stanczyk, Frank Z. (1994). "New knowledge in the physiology of hormonal contraceptives". American Journal of Obstetrics and Gynecology. 170 (5): 1499–1507. doi:10.1016/S0002-9378(12)91807-4. ISSN 0002-9378. PMID 8178898.
- ^ Elger, Walter (1972). "Physiology and pharmacology of female reproduction under the aspect of fertility control". Reviews of Physiology Biochemistry and Experimental Pharmacology, Volume 67. Ergebnisse der Physiologie Reviews of Physiology. Vol. 67. pp. 69–168. doi:10.1007/BFb0036328. ISBN 3-540-05959-8. PMID 4574573.
- ^ Edgren RA, Sturtevant FM (August 1976). "Potencies of oral contraceptives". Am. J. Obstet. Gynecol. 125 (8): 1029–38. doi:10.1016/0002-9378(76)90804-8. PMID 952300.
- ^ a b Bingel AS, Benoit PS (February 1973). "Oral contraceptives: therapeutics versus adverse reactions, with an outlook for the future I". J Pharm Sci. 62 (2): 179–200. doi:10.1002/jps.2600620202. PMID 4568621.
- ^ a b Katayama T, Umeda K, Kazama T (November 1986). "[Hormonal environment and antiandrogenic treatment in benign prostatic hypertrophy]". Hinyokika Kiyo (in Japanese). 32 (11): 1584–9. PMID 2435122.
- ^ Sitruk-Ware R, Husmann F, Thijssen JH, Skouby SO, Fruzzetti F, Hanker J, Huber J, Druckmann R (September 2004). "Role of progestins with partial antiandrogenic effects". Climacteric. 7 (3): 238–54. doi:10.1080/13697130400001307. PMID 15669548. S2CID 23112620.
- ^ Luthy IA, Begin DJ, Labrie F (1988). "Androgenic activity of synthetic progestins and spironolactone in androgen-sensitive mouse mammary carcinoma (Shionogi) cells in culture". J. Steroid Biochem. 31 (5): 845–52. doi:10.1016/0022-4731(88)90295-6. PMID 2462135.
- ^ a b Curran MP, Wagstaff AJ (2004). "Ethinylestradiol/chlormadinone acetate". Drugs. 64 (7): 751–60, discussion 761–2. doi:10.2165/00003495-200464070-00005. PMID 15025547. S2CID 815669.
- ^ John A. Thomas (12 March 1997). Endocrine Toxicology, Second Edition. CRC Press. pp. 152–. ISBN 978-1-4398-1048-4.
- ^ Nick Panay (31 August 2015). Managing the Menopause. Cambridge University Press. pp. 126–. ISBN 978-1-107-45182-7.
- ^ Thomas L. Lemke; David A. Williams (24 January 2012). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. pp. 1404–. ISBN 978-1-60913-345-0.
- ^ a b Neubauer H, Ma Q, Zhou J, Yu Q, Ruan X, Seeger H, Fehm T, Mueck AO (October 2013). "Possible role of PGRMC1 in breast cancer development". Climacteric. 16 (5): 509–13. doi:10.3109/13697137.2013.800038. PMID 23758160. S2CID 29808177.
- ^ Trabert B, Sherman ME, Kannan N, Stanczyk FZ (September 2019). "Progesterone and breast cancer". Endocr. Rev. 41 (2): 320–344. doi:10.1210/endrev/bnz001. PMC 7156851. PMID 31512725.
- ^ a b c d e f g h J. Elks (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 247–. ISBN 978-1-4757-2085-3.
- ^ a b c d e f g h i j k l m Index Nominum 2000: International Drug Directory. Taylor & Francis US. 2000. p. 215. ISBN 978-3-88763-075-1. Retrieved 29 May 2012.
- ^ William Andrew Publishing (22 October 2013). Pharmaceutical Manufacturing Encyclopedia, 3rd Edition. Elsevier. pp. 966–967. ISBN 978-0-8155-1856-3.
- ^ a b Ringold, H. J.; Batres, E.; Bowers, A.; Edwards, J.; Zderic, J. (1959). "Steroids. CXXVII.16-Halo Progestational Agents". Journal of the American Chemical Society. 81 (13): 3485–3486. doi:10.1021/ja01522a090. ISSN 0002-7863.
- ^ 랑베인, G., 멘저, E., Meyer, M. 및 Wesemann, R.(1973).3, 5, 6, 7-테트라치환 중간체 상에서 17α 아세톡시-6-클로로-6-데히드로게스테론(클로마디논)의 신규 합성.저널 Fur Praktische Chemie, 315(1), 8-22.
- ^ Helmuth Vorherr (2 December 2012). The Breast: Morphology, Physiology, and Lactation. Elsevier Science. pp. 123–. ISBN 978-0-323-15726-1.
- ^ "U.S. Agency for International Development" (PDF).
- ^ Consolidated List of Products Whose Consumption And/or Sale Have Been Banned, Withdrawn, Severely Restricted Or Not Approved by Governments. United Nations Publications. 1983. pp. 52–53, 260. ISBN 978-92-1-130230-1.
- ^ a b Benno Clemens Runnebaum; Thomas Rabe; Ludwig Kiesel (6 December 2012). Female Contraception: Update and Trends. Springer Science & Business Media. pp. 134–135. ISBN 978-3-642-73790-9.
- ^ A. T. Gregoire (13 March 2013). Contraceptive Steroids: Pharmacology and Safety. Springer Science & Business Media. pp. 381–. ISBN 978-1-4613-2241-2.
- ^ 크래프트, H. G., & Kiesler, H. (1966)클로르마디논 아세테이트 및 관련 화합물의 항에스트로겐 및 항안드로겐 활성.호르몬 스테로이드제에서요호르몬 스테로이드 관련 제2차 국제회의의 진행상황, 밀라노.암스테르담의 메디카 발췌문입니다
- ^ a b M.R. Henzl (1978). "Natural and Synthetic Female Sex Hormones". In S.S.C. Yen; R.B. Jaffe (eds.). Reproductive Endocrinology: Physiology, Pathophysiology, and Clinical Management. W.B. Saunders Co. pp. 421–468. ISBN 978-0721696256.
- ^ a b c "Micromedex Products: Please Login".
- ^ a b V. Unzeitig; Rick H.W. van Lunsen (15 February 2000). Contraceptive Choices and Realities: Proceedings of the 5th Congress of the European Society of Contraception. CRC Press. pp. 73–. ISBN 978-1-85070-067-8.
추가 정보
- Furuya S, Furuya R, Ogura H, Shimamura S, Araki T (March 2005). "[Transurethral resection for prostatic adenoma larger than 100 ml--preoperative treatment with interstitial laser coagulation of the prostate plus chlormadinone acetate as a treatment maneuver for safer operations]". Hinyokika Kiyo (in Japanese). 51 (3): 159–64. PMID 15852668.
- Bouchard P (2005). "Chlormadinone acetate (CMA) in oral contraception--a new opportunity". Eur J Contracept Reprod Health Care. 10 Suppl 1: 7–11. doi:10.1080/13625180500434889. PMID 16356876. S2CID 22898956.
- Druckmann R (April 2009). "Profile of the progesterone derivative chlormadinone acetate - pharmocodynamic properties and therapeutic applications". Contraception. 79 (4): 272–81. doi:10.1016/j.contraception.2008.10.017. PMID 19272496.
- Guerra-Tapia A, Sancho Pérez B (September 2011). "Ethinylestradiol/Chlormadinone acetate: dermatological benefits". Am J Clin Dermatol. 12 Suppl 1: 3–11. doi:10.2165/1153874-S0-000000000-00000. PMC 7382656. PMID 21895044.
- Barriga PP, Ambrosi Penazzo N, Franco Finotti M, Celis AA, Cerdas O, Chávez JA, Cuitiño LA, Fernandes CE, Plata MA, Tirán-Saucedo J, Vanhauwaert PS (July 2016). "At 10 years of chlormadinone use in Latin America: a review". Gynecol. Endocrinol. 32 (7): 517–20. doi:10.3109/09513590.2016.1153059. PMID 27113551. S2CID 27256311.



