L형 칼슘 채널
L-type calcium channel| 칼슘 채널, 전압 의존 | |
|---|---|
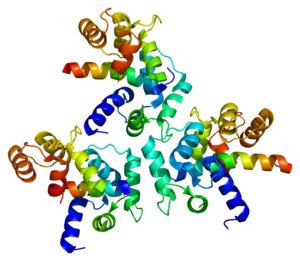 결정 구조 | |
| 식별자 | |
| 기호. | 칼슘 채널, 전압 의존 |

L형 칼슘 채널(디히드로피리딘 채널 또는 DHP 채널이라고도 함)은 고전압 활성 칼슘 [2]채널군의 일부입니다."L"은 활성화의 길이를 나타내는 Long-lasting을 나타냅니다.이 채널에는 Cav1.1, Cav1.2, Cav1.3 및 Cav1.4의 4개의 Isoform이 있습니다.
L형 칼슘 채널은 골격, 평활, 심근의 들뜸 수축 결합 및 부신피질의 [1]내분비세포의 알도스테론 분비를 담당한다.그것들은 또한 뉴런에서 발견되고, 내분비세포의 L형 칼슘 채널의 도움으로, 신경 호르몬과 신경 전달 물질을 조절합니다.그들은 또한 유전자 발현, mRNA 안정성, 신경 생존, 허혈에 의한 축삭 손상, 시냅스 효과, 그리고 다른 [3]이온 채널의 활성화와 비활성화 모두에서 역할을 하는 것으로 보여져 왔다.
심장근세포에서 L형 칼슘채널은 내부2+ Ca전류를 통과하여 리아노딘수용체2([4]RyR2)를 활성화함으로써 석소체로부터의 칼슘방출을 유발한다.이러한 채널의 인산화는 칼슘에 대한 투과성을 증가시키고 각각의 심장근세포의 수축성을 증가시킨다.
L형 칼슘 채널 차단제는 심장(베라파밀과 같은 페닐알킬아민) 또는 혈관(니페디핀과 같은 디히드로피리딘)[5]에 대한 친화력이 더 높은지에 따라 심장 부정맥이나 항고혈압제로 사용됩니다.
골격근에는 T-튜브에 위치한 L-형 칼슘 채널이 매우 고농도로 존재한다.근육 탈분극은 큰 게이트 전류를 발생시키지만 비정상적으로 낮은 칼슘 플럭스를 발생시키는데, 이는 이제 이온 전류의 매우 느린 활성화로 설명된다.이러한 이유로, 단일 활동 전위 동안 T-튜브막을 통과하는 Ca는 거의 또는 전혀2+ 없다.
역사
1953년, Paul Fatt와 Bernard Katz는 갑각류 근육에서 전압 게이트 칼슘 채널을 발견했습니다.채널은 서로 다른 활성화 전압 및 칼슘 전도 특성을 보였으며, 따라서 고전압 활성화 채널(HVA)과 저전압 활성화 채널(LVA)로 분리되었습니다.추가 실험 후, HVA 채널이 1,4-dihydropyridine(DHP)[6]으로 개방된다는 것이 밝혀졌습니다.DHP를 사용하여 HVA 채널이 특정 조직에 특이적이며 다르게 반응하는 것을 발견하였고, 이는 HVA 채널을 L형, P형,[3] N형으로 추가로 분류하는 결과를 가져왔다.L형 칼슘채널은 펩타이드 염기서열을 분석하였으며, L형 칼슘채널은 αS1(Skeletal Muscle), αC11(Cardiac), αD(뇌에서 발견), [6]αF1(망막에서 발견) 등 4종류가 있었다.2000년 전압 개폐 칼슘 채널의 α 서브유닛에 대한1 연구가 더 진행된 후, L형 칼슘 채널 CaV1이라는 새로운 명명법이 사용되었고 서브유닛은 CaV1.1, Cav1.2, CaV1.3 및 CaV1.[3]4로 불렸다.CaV1 서브유닛에 대한 연구를 통해 서브유닛의 구조, 기능 및 제약 용도에 대한 [7]더 많은 정보가 계속해서 밝혀지고 있습니다.
구조.
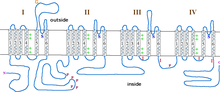
L형 칼슘 채널은 α1(170~240kDa), α2(150kDa), β(17~25kDa), β(50~78kDa) 및 β(32kDa) 소단위 [8]5개를 포함한다.α2, β 및 β 서브유닛은 α1 서브유닛에 비공유 결합되어 있으며 α1 서브유닛의 이온트래픽과 생물물리학적 특성을 조절한다.α2 서브유닛과 β 서브유닛은 세포외 공간에 있고 β 서브유닛과 β [8]서브유닛은 세포외 공간에 위치한다.
α1 서브유닛은 도메인 I-IV로 알려진 4개의 트랜스막 영역을 가진 헤테로테트라머로, α-헬리시스로 혈장을 6회 교차하고, S0-S6(S0과 S1은 함께 막을 한 [3]번 교차한다)라고 불린다.전체적으로 α1 서브유닛은 전압 감지 영역, 전도공 및 게이트 [9]장치를 포함합니다.대부분의 전압 개폐 이온 채널과 마찬가지로 α-서브유닛은 4개의 서브유닛으로 구성됩니다.각 서브유닛은 막을 가로지르는 6개의 알파 헬리컬, 막 통과 도메인에 의해 형성된다(번호 S1-S6).S1~S4 서브유닛은 전압센서를 구성하고 S5~S6 서브유닛은 선택성 [10]필터를 구성한다.세포의 전압을 감지하기 위해, S1-S3 헬리크는 음전하 아미노산을 많이 포함하고, S4 헬리크는 S4와 S5 헬리크를 연결하는 P-루프와 함께 대부분 양전하 아미노산을 포함합니다.S1-6 도메인 뒤에는 2개의 EF-hand 모티브(C1-2 및 C3-4)와 Pre-IQ 도메인(C5)과 IQ 도메인(C6)으로 구성된 6개의 C 도메인이 있습니다.또한 N-terminus에는 2개의 EF-핸드 모티브가 있습니다.N 및 C 말단은 모두 세포질 공간에 있으며 C 말단은 N [11]말단보다 훨씬 길다.
β 서브유닛은 채널의 기능을 조절하기 위해 4개의 아이소폼(β1-β4)을 가진 것으로 알려져 있으며, βα1 결합 포켓(ABP)[7][12]에서 세포 내 α1 I 및 II 링커를 통해 α1에 연결되어 있다.각 아이소폼은 HOOK 도메인으로 분리된 src 호몰로지3 도메인(SH3)과 구아닐산키나아제 라이크 도메인(GK)과 3개의 비구조화 [12]영역을 포함한다.
α2 및 β 서브유닛은 디술피드 결합(때로는 α2' 서브유닛으로 알려져 있음)에 의해 서로 연결되어 [7]α1과 상호작용한다. 이들은 α2δ-1 ~ α2--2로 불리는 4개의 알려진 아이소폼을 가지며 폰 윌브랜드 A(VWA) 도메인과 캐시 도메인을 포함한다.α2 영역은 세포외 공간에 있고 β 영역은 세포막 내에 있으며 글리코실포스파티딜이노시톨([12]GPI) 앵커로 고정되어 있는 것으로 나타났다.
γ 서브유닛은 8개의 아이소폼(θ1-θ8)을 가지며 α1 서브유닛에 연결되며 CaV1.1 [12]및 CaV1.2 채널의 근육세포에서만 발견되었다.γ 서브유닛에 대해서는 많이 알려져 있지 않지만 소수력에서의 [3]상호작용과 관련이 있다.
메커니즘
L형 칼슘 채널의 모공 개방은 α1 서브유닛에서 이루어진다.막이 탈분극되면 S4 나선은 S4 및 S5 링커를 통해 S5 및 S6 나선의 세포질 말단으로 이동한다.그러면 α1 서브유닛의 [11]S6 헬리크 내부에 의해 형성된 활성화 게이트가 열립니다.
L형 칼슘 채널의 가장 지배적인 자동 억제 방법은Ca2+/Cam [11]콤플렉스모공이 열려 칼슘이 유입되면 칼슘은 칼모듈린과 결합하고 인접한 EF-핸드 모티브를 연결하는 루프와 상호작용하여 EF-핸드 모티브의 배좌 변화를 일으키므로 모공과 상호작용하여 [6]채널에서 빠른 억제를 일으킨다.모공과 EF 손이 어디에서 어떻게 상호작용하는지에 대해서는 여전히 논의되고 있다.Ca/Cam 복합체의2+ 소수성 포켓은 또한 "방향족 앵커"[11]로 알려진 IQ 영역의 세 부분에 결합할 것입니다.Ca/Cam 복합체는2+ L형 칼슘 채널에 대한 친화력이 높아 세포에 칼슘이 적은 경우에도 차단된다.모공은 세포가 다시 분극하면서 닫히고 채널의 배좌 변화를 일으켜 닫힌 배좌에 놓입니다.
억제 및 변조
L형 칼슘 채널의 가장 알려진 특징 중 하나는 1,4-디히드로피리딘(DHPs)[3]에 대한 고유한 민감도입니다.다른 전압 게이트 칼슘 채널과는 달리 L형 칼슘 채널은 δ-CT X(GVIA) 및 δ-AG A(IVA) 억제 [3]약물에 내성이 있다.
잘 관찰된 변조 형태는 대체 스플라이싱에 의한 것입니다.대체 스플라이싱에 의한 변조의 일반적인 형태는 C 터미널 모듈레이터(CTM)입니다.DCRD라고 불리는 C 말단에는 양전하α-나선이 있고 PCRD라고 불리는 IQ 모티브(CaM 상호작용 부위) 직후에는 음전하 나선이 있다.두 개의 나선은 개방 상태 확률을 낮추고 칼슘 의존성 억제(CDI)를 낮추기 위해 [7]CaM과 경쟁적으로 결합하는 구조를 형성할 수 있다.
팔미토일화와[6] RNA [7]편집으로 인해 채널에 서로 다른 특성을 부여하기 위해 서로 다른 아이소폼을 생성하기 위한 대체 스플라이싱도 β 서브유닛에서 볼 수 있다.β 서브유닛에 대한 다른 형태의 변조에는 서브유닛 발현 증가 또는 감소가 포함된다.이는 β 서브유닛이 채널의 개방확률을 높이고 혈장막의 활성을 증가시키며 채널의 [6]유비쿼티화를 길항하기 때문이다.
또한 L형 칼슘 채널은 [13]방광과 같은 G단백질 결합 수용체 및 아드레날린 [6]신경계에 의해 조절된다.G단백질결합수용체에 의해 활성화되는 단백질인산화효소A(PKA)는 채널이 A-Kinase-Anchoring단백질(AKAPs)과 시그널링 복합체를 형성한 후 L형 칼슘 채널을 인산화하여 채널을 통해 칼슘 전류를 증가시켜 개방상태 확률을 높이고 회복 기간을 단축할 수 있다.G 단백질 결합 수용체로부터 활성화된 포스포리파아제 C(PLC)는 폴리포스포이노시티드를 분해하여 칼슘 통로를 20%~30%[7] 감소시킬 수 있다.
아드레날린 신경계는 [6]β-아드레날린 수용체가 자극되어 채널의 활성화를 증가시킬 때 C-말단 단편을 절단함으로써 L형 칼슘 채널을 조절하는 것으로 나타났다.
유전자
「 」를 참조해 주세요.
레퍼런스
- ^ a b Felizola SJ, Maekawa T, Nakamura Y, Satoh F, Ono Y, Kikuchi K, et al. (October 2014). "Voltage-gated calcium channels in the human adrenal and primary aldosteronism". The Journal of Steroid Biochemistry and Molecular Biology. 144 Pt B (part B): 410–416. doi:10.1016/j.jsbmb.2014.08.012. PMID 25151951. S2CID 23622821.
- ^ Rossier MF (2016). "T-Type Calcium Channel: A Privileged Gate for Calcium Entry and Control of Adrenal Steroidogenesis". Frontiers in Endocrinology. 7: 43. doi:10.3389/fendo.2016.00043. PMC 4873500. PMID 27242667.
- ^ a b c d e f g Lipscombe D, Helton TD, Xu W (November 2004). "L-type calcium channels: the low down". Journal of Neurophysiology. 92 (5): 2633–2641. doi:10.1152/jn.00486.2004. PMID 15486420.
- ^ Yamakage M, Namiki A (February 2002). "Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review". Canadian Journal of Anaesthesia. 49 (2): 151–164. doi:10.1007/BF03020488. PMID 11823393.
- ^ Hughes A (2017). "Calcium channel blockers". In Bakris G, Sorrentino M (eds.). Hypertension: a companion to Braunwald's heart disease (Third ed.). Philadelphia, PA: Elsevier Health Sciences. pp. 242–253. ISBN 9780323508766. OCLC 967938982.
- ^ a b c d e f g Dolphin AC (October 2018). "Voltage-gated calcium channels: their discovery, function and importance as drug targets". Brain and Neuroscience Advances. 2: 2398212818794805. doi:10.1177/2398212818794805. PMC 6179141. PMID 30320224.
- ^ a b c d e f Striessnig J, Pinggera A, Kaur G, Bock G, Tuluc P (March 2014). "L-type Ca2+ channels in heart and brain". Wiley Interdisciplinary Reviews. Membrane Transport and Signaling. 3 (2): 15–38. doi:10.1002/wmts.102. PMC 3968275. PMID 24683526.
- ^ a b Bodi I, Mikala G, Koch SE, Akhter SA, Schwartz A (December 2005). "The L-type calcium channel in the heart: the beat goes on". The Journal of Clinical Investigation. 115 (12): 3306–3317. doi:10.1172/JCI27167. PMC 1297268. PMID 16322774.
- ^ "Voltage-gated calcium channels Introduction BPS/IUPHAR Guide to PHARMACOLOGY". www.guidetopharmacology.org. Retrieved 2019-11-28.
- ^ Catterall WA, Perez-Reyes E, Snutch TP, Striessnig J (December 2005). "International Union of Pharmacology. XLVIII. Nomenclature and structure-function relationships of voltage-gated calcium channels". Pharmacological Reviews. 57 (4): 411–425. doi:10.1124/pr.57.4.5. PMID 16382099. S2CID 10386627.
- ^ a b c d Wahl-Schott C, Baumann L, Cuny H, Eckert C, Griessmeier K, Biel M (October 2006). "Switching off calcium-dependent inactivation in L-type calcium channels by an autoinhibitory domain". Proceedings of the National Academy of Sciences of the United States of America. 103 (42): 15657–15662. Bibcode:2006PNAS..10315657W. doi:10.1073/pnas.0604621103. PMC 1622877. PMID 17028172.
- ^ a b c d Shaw RM, Colecraft HM (May 2013). "L-type calcium channel targeting and local signalling in cardiac myocytes". Cardiovascular Research. 98 (2): 177–186. doi:10.1093/cvr/cvt021. PMC 3633156. PMID 23417040.
- ^ Phelps C, Chess-Williams R, Moro C (2022). "The Dependence of Urinary Bladder Responses on Extracellular Calcium Varies Between Muscarinic, Histamine, 5-HT (Serotonin), Neurokinin, Prostaglandin, and Angiotensin Receptor Activation". Frontiers in Physiology. 13: 841181. doi:10.3389/fphys.2022.841181. PMC 9008219. PMID 35431993.
추가 정보
- Takahashi K, Hayashi S, Miyajima M, Omori M, Wang J, Kaihara K, et al. (May 2019). "L-type calcium channel modulates mechanosensitivity of the cardiomyocyte cell line H9c2". Cell Calcium. 79: 68–74. doi:10.1016/j.ceca.2019.02.008. PMID 30836292.
이 기사에는 미국 국립 의학 도서관(미국 국립 의학 도서관)의 공공 도메인 텍스트가 포함되어 있습니다.
외부 링크
- "Voltage-Gated Calcium Channels". IUPHAR Database of Receptors and Ion Channels. International Union of Basic and Clinical Pharmacology.
- 미국 국립의학도서관의 L-Type+Calcium+Channel Medical Subject Headings(Me-Type+Calcium+Channel