ADAM10
ADAM10| ADAM10 내분비효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| EC 번호 | 3.4.24.81 | ||||||||
| CAS 번호. | 193099-09-1 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
ADAM10, CDw156 또는 CD156c라고도 알려진 분해인 및 금속단백질 도메인 함유 단백질 10은 인간에서 ADAM10 유전자에 의해 인코딩되는 단백질이다.[5]
함수
ADAM 계열의 구성원들은 독특한 구조를 가진 세포 표면 단백질로, 잠재적인 접착력과 프로테아제 영역을 모두 가지고 있다.Shedase는 ADAM 야금화효소의 총칭으로 세포 표면에서 주로 막 단백질을 분쇄하는 기능을 한다.셰다이스는 일단 분해되면 위치와 기능이 변경된 수용성 엑토돔을 방출한다.[6][7][8]
단일 셰다제가 다양한 물질을 "차단"할 수 있지만, 여러 셰다제는 동일한 기질을 분할하여 다른 결과를 초래할 수 있다.이 유전자는 TNF-알파, E-cadherin을 포함한 많은 단백질을 분해하는 ADAM 가족 구성원을 암호화한다.[5]
ADAM10(EC#: 3.4.24.81)은 셰다아제로서 펩타이드 가수분해 반응에 대한 광범위한 특이성을 가지고 있다.[9]
ADAM10은 두 개의 세포 표면 사이에 형성된 에프린/에프 콤플렉스 내에서 에프린을 분쇄한다.에프린이 반대 세포로부터 해방되면 에프린/에프 콤플렉스 전체가 내피세포가 된다.트랜스에서의 이러한 드리핑은 이전에 보여지지 않았지만 다른 드리핑 이벤트와 관련이 있을 수 있다.[10]
뉴런에서 ADAM10은 아밀로이드 전구단백질의 단백질 분해 처리를 위한 α-시크레타아제 활성이 가장 중요한 효소다.[11]ADAM10은 ADAM17과 함께 골수세포 2(Trem2)에 발현된 트리거 수용체의 엑토도마인을 분해하여, 그동안 신경데생물의 CSF 및 세라 바이오마커로 제안되어 온 수용성 TREM2(sTrem2)를 생산한다.[12]
ADAM10은 Mamiellophycae의 모든 주요 동물군, choanoflagellate, 곰팡이, 녹조 등이 공유하는 ADAM 단백질의 가장 조상의 하위 집단인 A 하위 가족에 속한다.[13]
구조
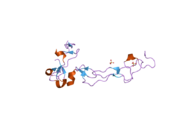
ADAM10의 전체 구조를 나타내는 결정학적 X선 회절 분석은 발표되지 않았지만, 이 기법을 사용하여 하나의 영역이 연구되었다.이신티그린과 시스테인이 풍부한 영역(오른쪽 그림)은 체내 프로테아제 활성을 규제하는 데 필수적인 역할을 한다.최근의 실험 증거는 활성 부위와 구별되는 이 부위가 효소의 기질 특이성에 책임이 있을 수 있음을 시사한다.이 영역은 효소 기질의 특정 부위에 결합하여 특정 기질 단백질의 잘 정의된 위치에서 펩타이드 결합 가수분해를 발생시킬 것을 제안한다.[14]
ADAM10의 제안된 활성 부위는 시퀀스 분석으로 확인되었으며, 스네이크 베놈 메탈로프로테이트 도메인 계열의 효소와 동일하다.촉매 활성 ADAM 단백질에 대한 컨센서스 시퀀스는 HEXGHNLGXXHD이다.ADAM10과 동일한 활성 사이트 시퀀스를 갖는 ADAM17의 구조 분석은 이 시퀀스의 세 히스티딘이 Zn2+ 원자를 결합하고, 글루타미트가 촉매 잔류물임을 시사한다.[15]
촉매 메커니즘
ADAM10의 정확한 메커니즘은 철저히 조사되지 않았지만 활성 부위는 카복시펩티다효소 A와 열성신 등 아연단백질이 잘 연구된 것과 동일하다.따라서 ADAM10은 이러한 효소와 유사한 메커니즘을 활용할 것을 제안한다.아연 프로테아제에서는 주요 촉매 원소가 글루탐산염 잔류물과 히스티딘 잔류물로 조정된 Zn2+ 이온으로 식별되었다.[16]
제안된 메커니즘은 글루타민산염에 의한 물 분자의 감응으로부터 시작된다.그 결과 수산화물은 펩타이드 백본에 있는 카보닐 탄소에 대한 핵포착 공격을 개시하여 사면중간을 생성한다.이 단계는 Zn에2+ 의한 산소로부터의 전자의 인출과 아연의 후속으로 중간 상태에서 산소 원자의 음전하를 안정화함으로써 촉진된다.전자가 산소 원자로부터 아래로 이동하여 이중 결합을 다시 형성함에 따라, 사면체 중간은 글루탐산염 잔여물에 의해 -NH의 양성자가 있는 제품으로 붕괴된다.[16]
임상적 유의성
뇌질환
ADAM10은 치골 척추 형성, 성숙 및 안정화를 담당하는 분자 메커니즘의 변조 및 글루타마터제 시냅스의 분자 조직 조절에 핵심적인 역할을 한다.따라서 ADAM10 활성의 변화는 신경 발달 장애, 즉 자폐 스펙트럼 장애에서부터 신경 퇴행성 질환, 즉 알츠하이머병에 이르기까지 다양한 형태의 시냅스 운동의 시작과 엄격히 상관관계가 있다.[17]
말라리아 기생충과의 상호작용
플라스모듐 팔시파룸 말라리아 기생충 표면에 있는 여러 가지 다른 단백질들은 침입자들이 적혈구에 묶이는 것을 돕는다.그러나 일단 숙주혈구에 부착되면 기생충들은 세포의 입구를 방해할 수 있는 '딱 달라붙는' 표면 단백질을 제거해야 한다.이 예에서 특별히 PfSUB2라고 불리는 쉐다세 효소는 기생충이 세포를 침범하는 데 필요하다. 기생충이 없으면 기생충은 죽는다.이 연구에 따르면, 셰다제는 기생충의 끝 근처에 있는 세포실에 저장되고 방출된다.일단 표면에 닿으면 효소는 그것을 앞뒤로 멈추게 하는 모터에 부착되어 끈적끈적한 표면 단백질을 해방시킨다.이 단백질을 제거하면 기생충은 적혈구로 들어가게 된다.전체 침공은 약 30초간 지속되며, 이 ADAM 야금화효소가 없다면 말라리아는 적혈구를 침범하는 데 효과적이지 않을 것이다.[18]
유방암
선택적 ADAM10 억제제는 저선량 헤르셉틴과 결합하여 HER2 과대압축 셀 라인의 증식을 감소시키는 반면 ADAM10을 억제하지 않는 억제제는 영향을 미치지 않는다.이러한 결과는 ADAM10이 HER2 분비의 주요 결정 요인이 되는 것과 일치하며, 이 억제제는 유방암과 HER2 신호가 있는 다양한 다른 암을 치료하기 위한 새로운 치료 접근법을 제공할 수 있다.[19]
알츠하이머병 환자의 해마 뉴런에서 단백질 AP2와 결합한 뉴런 시냅스에서 이 유전자의 생성물의 존재는 증가된 양에서 관찰되었다.[20]
참고 항목
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000137845 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000054693 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b "Entrez Gene: ADAM10 ADAM metallopeptidase domain 10".
- ^ Moss ML, Bartsch JW (June 2004). "Therapeutic benefits from targeting of ADAM family members". Biochemistry. 43 (23): 7227–35. doi:10.1021/bi049677f. PMID 15182168.
- ^ Nagano O, Saya H (December 2004). "Mechanism and biological significance of CD44 cleavage". Cancer Science. 95 (12): 930–5. doi:10.1111/j.1349-7006.2004.tb03179.x. PMID 15596040. S2CID 9009213.
- ^ Blobel CP (January 2005). "ADAMs: key components in EGFR signalling and development". Nature Reviews. Molecular Cell Biology. 6 (1): 32–43. doi:10.1038/nrm1548. PMID 15688065. S2CID 7011302.
- ^ "Entry of ADAM10 endopeptidase (EC-Number 3.4.24.81 )".
- ^ Janes PW, Saha N, Barton WA, Kolev MV, Wimmer-Kleikamp SH, Nievergall E, et al. (October 2005). "Adam meets Eph: an ADAM substrate recognition module acts as a molecular switch for ephrin cleavage in trans". Cell. 123 (2): 291–304. doi:10.1016/j.cell.2005.08.014. PMID 16239146. S2CID 7962666.
- ^ Haass C, Kaether C, Thinakaran G, Sisodia S (May 2012). "Trafficking and proteolytic processing of APP". Cold Spring Harbor Perspectives in Medicine. 2 (5): a006270. doi:10.1101/cshperspect.a006270. PMC 3331683. PMID 22553493.
- ^ Yang, Jiaolong; Fu, Zhihui; Zhang, Xingyu; Xiong, Min; Meng, Lanxia; Zhang, Zhentao (2020-07-07). "TREM2 ectodomain and its soluble form in Alzheimer's disease". Journal of Neuroinflammation. 17 (1): 204. doi:10.1186/s12974-020-01878-2. ISSN 1742-2094. PMC 7341574. PMID 32635934.
- ^ Souza J, Lisboa A, Santos T, Andrade M, Neves V, Teles-Souza J, Jesus H, Bezerra T, Falcão V, Oliveira R, Del-Bem L (2020). "The evolution of ADAM gene family in eukaryotes". Genomics. 112 (5): 3108–3116. doi:10.1016/j.ygeno.2020.05.010. PMID 32437852. S2CID 218832838.
- ^ Smith KM, Gaultier A, Cousin H, Alfandari D, White JM, DeSimone DW (December 2002). "The cysteine-rich domain regulates ADAM protease function in vivo". The Journal of Cell Biology. 159 (5): 893–902. doi:10.1083/jcb.200206023. PMC 2173380. PMID 12460986.
- ^ Wolfsberg TG, Primakoff P, Myles DG, White JM (October 1995). "ADAM, a novel family of membrane proteins containing A Disintegrin And Metalloprotease domain: multipotential functions in cell-cell and cell-matrix interactions". The Journal of Cell Biology. 131 (2): 275–8. doi:10.1083/jcb.131.2.275. PMC 2199973. PMID 7593158.
- ^ a b Lolis E, Petsko GA (1990). "Transition-state analogues in protein crystallography: probes of the structural source of enzyme catalysis". Annual Review of Biochemistry. 59: 597–630. doi:10.1146/annurev.bi.59.070190.003121. PMID 2197984.
- ^ Marcello E, Borroni B, Pelucchi S, Gardoni F, Di Luca M (November 2017). "ADAM10 as a therapeutic target for brain diseases: from developmental disorders to Alzheimer's disease". Expert Opinion on Therapeutic Targets. 21 (11): 1017–1026. doi:10.1080/14728222.2017.1386176. PMID 28960088. S2CID 46800368.
- ^ "'Sheddase' helps the malaria parasite invade red blood cells". Archived from the original on 2008-04-12.
- ^ Liu PC, Liu X, Li Y, Covington M, Wynn R, Huber R, et al. (June 2006). "Identification of ADAM10 as a major source of HER2 ectodomain sheddase activity in HER2 overexpressing breast cancer cells". Cancer Biology & Therapy. 5 (6): 657–64. doi:10.4161/cbt.5.6.2708. PMID 16627989. S2CID 23463401.
- ^ Marcello E, Saraceno C, Musardo S, Vara H, de la Fuente AG, Pelucchi S, et al. (June 2013). "Endocytosis of synaptic ADAM10 in neuronal plasticity and Alzheimer's disease". The Journal of Clinical Investigation. 123 (6): 2523–38. doi:10.1172/JCI65401. PMC 3668814. PMID 23676497.
추가 읽기
- Wolfsberg TG, Primakoff P, Myles DG, White JM (October 1995). "ADAM, a novel family of membrane proteins containing A Disintegrin And Metalloprotease domain: multipotential functions in cell-cell and cell-matrix interactions". The Journal of Cell Biology. 131 (2): 275–8. doi:10.1083/jcb.131.2.275. PMC 2199973. PMID 7593158.
- O'Bryan JP, Fridell YW, Koski R, Varnum B, Liu ET (January 1995). "The transforming receptor tyrosine kinase, Axl, is post-translationally regulated by proteolytic cleavage". The Journal of Biological Chemistry. 270 (2): 551–7. doi:10.1074/jbc.270.2.551. PMID 7822279. S2CID 46190313.
- Howard L, Lu X, Mitchell S, Griffiths S, Glynn P (July 1996). "Molecular cloning of MADM: a catalytically active mammalian disintegrin-metalloprotease expressed in various cell types". The Biochemical Journal. 317 ( Pt 1) (1): 45–50. doi:10.1042/bj3170045. PMC 1217484. PMID 8694785.
- McKie N, Edwards T, Dallas DJ, Houghton A, Stringer B, Graham R, et al. (January 1997). "Expression of members of a novel membrane linked metalloproteinase family (ADAM) in human articular chondrocytes". Biochemical and Biophysical Research Communications. 230 (2): 335–9. doi:10.1006/bbrc.1996.5957. PMID 9016778.
- Rosendahl MS, Ko SC, Long DL, Brewer MT, Rosenzweig B, Hedl E, et al. (September 1997). "Identification and characterization of a pro-tumor necrosis factor-alpha-processing enzyme from the ADAM family of zinc metalloproteases". The Journal of Biological Chemistry. 272 (39): 24588–93. doi:10.1074/jbc.272.39.24588. PMID 9305925. S2CID 21399815.
- Yamazaki K, Mizui Y, Tanaka I (October 1997). "Radiation hybrid mapping of human ADAM10 gene to chromosome 15". Genomics. 45 (2): 457–9. doi:10.1006/geno.1997.4910. PMID 9344679.
- Yamazaki K, Mizui Y, Sagane K, Tanaka I (December 1997). "Assignment of a disintegrin and metalloproteinase domain 10 (Adam10) gene to mouse chromosome 9". Genomics. 46 (3): 528–9. doi:10.1006/geno.1997.5043. PMID 9441766.
- Yavari R, Adida C, Bray-Ward P, Brines M, Xu T (July 1998). "Human metalloprotease-disintegrin Kuzbanian regulates sympathoadrenal cell fate in development and neoplasia". Human Molecular Genetics. 7 (7): 1161–7. doi:10.1093/hmg/7.7.1161. PMID 9618175.
- Dallas DJ, Genever PG, Patton AJ, Millichip MI, McKie N, Skerry TM (July 1999). "Localization of ADAM10 and Notch receptors in bone". Bone. 25 (1): 9–15. doi:10.1016/S8756-3282(99)00099-X. PMID 10423016.
- Dias Neto E, Correa RG, Verjovski-Almeida S, Briones MR, Nagai MA, da Silva W, et al. (March 2000). "Shotgun sequencing of the human transcriptome with ORF expressed sequence tags". Proceedings of the National Academy of Sciences of the United States of America. 97 (7): 3491–6. Bibcode:2000PNAS...97.3491D. doi:10.1073/pnas.97.7.3491. PMC 16267. PMID 10737800.
- Hattori M, Osterfield M, Flanagan JG (August 2000). "Regulated cleavage of a contact-mediated axon repellent". Science. 289 (5483): 1360–5. Bibcode:2000Sci...289.1360H. doi:10.1126/science.289.5483.1360. PMID 10958785.
- Vincent B, Paitel E, Saftig P, Frobert Y, Hartmann D, De Strooper B, et al. (October 2001). "The disintegrins ADAM10 and TACE contribute to the constitutive and phorbol ester-regulated normal cleavage of the cellular prion protein". The Journal of Biological Chemistry. 276 (41): 37743–6. doi:10.1074/jbc.M105677200. PMID 11477090.
- Chubinskaya S, Mikhail R, Deutsch A, Tindal MH (September 2001). "ADAM-10 protein is present in human articular cartilage primarily in the membrane-bound form and is upregulated in osteoarthritis and in response to IL-1alpha in bovine nasal cartilage". The Journal of Histochemistry and Cytochemistry. 49 (9): 1165–76. doi:10.1177/002215540104900910. PMID 11511685. S2CID 6879742.
- Lemjabbar H, Basbaum C (January 2002). "Platelet-activating factor receptor and ADAM10 mediate responses to Staphylococcus aureus in epithelial cells". Nature Medicine. 8 (1): 41–6. doi:10.1038/nm0102-41. PMID 11786905. S2CID 7135441.
- Healy EF, Romano P, Mejia M, Lindfors G (November 2010). "Acetylenic inhibitors of ADAM10 and ADAM17: in silico analysis of potency and selectivity". Journal of Molecular Graphics & Modelling. 29 (3): 436–42. doi:10.1016/j.jmgm.2010.08.006. PMID 20863729.
- Arndt M, Lendeckel U, Röcken C, Nepple K, Wolke C, Spiess A, et al. (February 2002). "Altered expression of ADAMs (A Disintegrin And Metalloproteinase) in fibrillating human atria". Circulation. 105 (6): 720–5. doi:10.1161/hc0602.103639. PMID 11839628. S2CID 10279346.
- Colciaghi F, Borroni B, Pastorino L, Marcello E, Zimmermann M, Cattabeni F, et al. (February 2002). "[alpha]-Secretase ADAM10 as well as [alpha]APPs is reduced in platelets and CSF of Alzheimer disease patients". Molecular Medicine. 8 (2): 67–74. doi:10.1007/BF03402076. PMC 2039975. PMID 12080182.
- Lim R, Winteringham LN, Williams JH, McCulloch RK, Ingley E, Tiao JY, et al. (October 2002). "MADM, a novel adaptor protein that mediates phosphorylation of the 14-3-3 binding site of myeloid leukemia factor 1" (PDF). The Journal of Biological Chemistry. 277 (43): 40997–1008. doi:10.1074/jbc.M206041200. PMID 12176995. S2CID 40077371.
- Gatta LB, Albertini A, Ravid R, Finazzi D (November 2002). "Levels of beta-secretase BACE and alpha-secretase ADAM10 mRNAs in Alzheimer hippocampus". NeuroReport. 13 (16): 2031–3. doi:10.1097/00001756-200211150-00008. PMID 12438920.
- Gutwein P, Mechtersheimer S, Riedle S, Stoeck A, Gast D, Joumaa S, et al. (February 2003). "ADAM10-mediated cleavage of L1 adhesion molecule at the cell surface and in released membrane vesicles". FASEB Journal. 17 (2): 292–4. doi:10.1096/fj.02-0430fje. PMID 12475894. S2CID 21521110.
외부 링크
- UCSC 게놈 브라우저에서 ADAM10 인간 유전자 위치.
- UCSC 게놈 브라우저의 ADAM10 인간 유전자 세부 정보.
- PDBe-KB에서 UniProt: O14672(Disintein and metaloprotein-dometrotinase domain-contining statency 10)에 대한 PDB의 모든 구조 정보 개요.
이 기사는 공공영역에 있는 미국 국립 의학 도서관의 텍스트를 통합하고 있다.