마그네슘 트랜스포터
Magnesium transporter마그네슘 운반체는 세포막을 가로질러 마그네슘을 운반하는 단백질이다.모든 형태의 생명체는 마그네슘을 필요로 하지만, Mg의2+ 분자 메커니즘이 환경으로부터 흡수되고 유기체 내에서 이 중요한 원소의 분포가 서서히 해명되고 있을 뿐이다.null
MgtA의 ATPase 함수는 심돌리핀 의존도가 높고 μM 범위에서 자유마그네슘을 검출하는 것으로 나타났다.
박테리아에서 Mg는2+ 아마도 주로 CorA 단백질과[2] MgTE 단백질에 의해 공급될 것이다.[3][4]효모에서 초기 섭취는 Alr1p와 Alr2p 단백질을 통해 이루어지지만,[5] 이 단계에서 확인된 단백질을 분배하는 유일한 내부2+ Mg는 Mrs2p이다.[6]원생대 내에서는 단 한 대의 Mg2+ 트랜스포터(XntAp)만이 확인되었다.[7]메타조아에서는 Mrs2p와[8] MgtE 호몰로로그가[9] 확인되었으며, 두 개의 새로운 Mg2+ 운송 시스템 TRPM6/TRPM7과[10][11] PCLN-1이 함께 확인되었다.[12]마침내 식물에서는 또 다른 새로운 단백질인 AtMHX와 함께 Mrs2p 호몰로로그 계열이 확인되었다[13][14].[15]
진화
mg2+ 수송의 진화는 다소 복잡했던 것으로 보인다.MgtE에 기초한 단백질은 박테리아와 메타조아에 존재하지만 곰팡이와 식물에는 없는 반면, CorA와 관련된 것으로 보이는 단백질은 이 모든 그룹에 존재한다.박테리아에 존재하는 두 개의 활성 운반체, MgtA와 MgtB는 상위 유기체에서 어떠한 동질성도 가지고 있지 않은 것으로 보인다.또한 상위 유기체에서만 발견되는 Mg2+ 수송 시스템도 있다.null
종류들
Mg를2+ 운반하는 단백질이 아직 많이 남아 있다.가장 잘 연구된 eukaryote, 효모에서도 Borrelly는[16] 연관 단백질이2+ 없는 Mg+/H 교환기를 보고했는데, 이것은 아마도 골기에 국부화되었을 것이다.적어도 효모 안에 있는 다른 주요 Mg2+ 트랜스포터는 아직 밝혀지지 않았으며, 효모 바쿠올 안과 밖으로 Mg2+ 운송에 영향을 미치는 트랜스포터는 아직 밝혀지지 않았다.더 높은 다세포 유기체에서는 단백질을 운반하는 많은 Mg가2+ 발견을 기다리는 것처럼 보인다.null
CorA 도메인 포함 Mg2+ 트랜스포터(CorA, Alr-like 및 Mrs2-like)는 부등분 계수에 대한 유사하지만 동일하지는 않다.실제로 이 관측은 지금까지 파악된 모든 mg2+ 운반체까지 확대될 수 있다.이러한 유사성은 Mg의2+ 기본 특성이 인식과 운송의 가능한 메커니즘에 강하게 영향을 미친다는 것을 시사한다.그러나 이러한 관측은 또한 다른 금속 이온을 Mg2+ 흡수를 위한 추적기로 사용하는 것이 반드시 Mg를2+ 운반하는 트랜스포터의 능력에 필적하는 결과를 만들지는 않을 것임을 시사한다. 이상적으로는 Mg를2+ 직접 측정해야 한다.[17]null
Mg는2+ 사실상 얻을 수 없기 때문에 여러 전달체를 직접 비교하려면 기존 데이터의 상당 부분을 Mg2+ 수송을 측정하기 위한 새로운 도구로 재해석해야 할 것이다.mag-fura 2를 이용한 Kolisek와[18] Froschauer의[19] 선구적인 연구는 일부 시스템에서는 자유2+ Mg를 생체 내에서 신뢰성 있게 측정할 수 있다는 것을 보여주었다.이 새로운 도구로 CorA 분석으로 돌아가 새로운2+ Mg 운송 시스템 분석을 위한 중요한 기준선을 발견했다.단, 운반능력의 비교를 하려면 막에 존재하는 운반체의 양을 정확하게 파악하는 것이 중요하다.이 박테리아 시스템은 진핵생물 Mg2+ 이동단백질 분석에 약간의 효용성을 제공할 수도 있지만, 원핵생물 및 진핵생물의 생물학적 시스템 차이는 어떤 실험에서도 고려되어야 할 것이다.null
함수
특징화된 Mg2+ 운반 단백질의 기능을 비교하는 것은, 비록 그 단백질들이 다른 방법론과 기술을 사용하여 다른 생물학적 시스템에서 조사되었음에도 불구하고, 현재 거의 불가능하다.모든 단백질을 직접 비교할 수 있는 시스템을 찾는 것이 큰 발전이 될 것이다.만약 단백질이 박테리아(S.typhimurium)에서, 그리고 기능적인 것으로 나타날 수 있mag-fura 2개의 단백질, 봉투를 막으로 수량화, 그리고 단백질의 구조(X선 크리스탈 혹은 cryo-TEM)의 기술의 조합 기본 메커니즘은 Mg2+하와이 말똥가리의 인식과 운송에서 관련자들의 결정 될 것입니다.n그러나, 아마도 가장 좋은 발전은 인공 막을 사용한 패치 클램프 시스템에서 단백질의 기능을 측정할 수 있는 방법의 개발일 것이다.null
박테리아
초기연구
1968년 루스크는[20] Mg 빈약 매체에서2+ 박테리아(대장균) 성장의 한계를 설명하면서 박테리아가 Mg를2+ 필요로 하며 이 이 이온을 환경으로부터 적극적으로 섭취할 가능성이 있음을 시사했다.이듬해에는 같은 group[21]와 또 다른 그룹, Silver,[22]독립적으로 신진 대사로 활동적인 E대장 균의 세포 28Mg2+을 사용하여 Mg2+의 빨아들이고 유출을 묘사했다.1971년 말까지 두 논문 Co2+, Ni2+과 Mn2+의 Mg2+의 Ecoli[23]과 Aerobacter 양기성 균과 간균 megaterium에서 전송에 간섭을 설명하는 출간되었어요.[24]전달체를 인코딩하는 유전자의 복제 전 마지막 주요 개발에서, 첫 번째 시스템과 유사한 친화력과 이동동력을 보이는 두 번째 Mg흡입2+ 시스템이 있었지만, 양이온을 방해하는 민감성의 범위가 다르다는 것이 밝혀졌다.이 시스템은 또한 높은 세포외 농도의 Mg에2+ 의해 억제될 수 있었다.[25][26]
코라
CorA 유전자와 그에 상응하는 단백질은 어떤 유기체에서든 가장 철저하게 연구된 Mg2+ 수송 시스템이다.CorA 유전자에 대해 발표된 대부분의 문헌은 M. E. Maguire의 실험실에서 나온 것이다.최근 R. J. 슈바이엔의 그룹은 CorA에 의한 Mg2+ 운송에 대한 이해에 상당한 영향을 주었다.이 유전자는 원래 이 유전자의 불활성화로 인해 발생한 대장균의 코발트 저항성 표현형의 이름을 따서 명명되었다.[25]null
이 유전자는 박씨 등에 의해 대장균에서 유전적으로 확인되었지만, 하이엘 [2]등이 살모넬라 장티푸륨(S. 장티푸륨) 호몰로뉴를 분리하기 전까지는 복제되지 않았다.[26]나중에 Smith와 Maguire에[27] 의해 17 그램 음성 박테리아에 CorA 유전자가 존재한다는 것이 증명될 것이다.현재 원핵생물에 사용할 수 있는 완전한 게놈 서열 수가 많은 상황에서, 코라는 에우박테리아 중에서도 사실상 어디에나 있는 것으로 나타났으며, 고고학자들 사이에서도 널리 분포하고 있는 것으로 나타났다.[28]대장균의 CorA 로쿠스에는 948개의 뉴클레오티드의 단 한 개의 개방형 판독 프레임이 들어 있어 316개의 아미노산 단백질을 생성한다.이 단백질은 에우박테리아와 고세아 사이에 잘 보존되어 있다.대장균과 장티푸륨 사이에서는 단백질이 98% 동일하지만, 좀 더 멀리 연관성이 있는 종에서는 유사성이 15~20%[28]로 떨어진다.좀 더 멀리 연관되어 있는 유전자의 경우 유사성은 단백질 C단자 부분에만 국한되는 경우가 많으며, 이 지역 내에서 짧은 아미노산 모티브 GMN은 매우 보존성이 높다.pFAM 보존 단백질 도메인 데이터베이스(http://webarchive.loc.gov/all/20110506030957/http%3A//pfam.sanger.ac.uk/),에서도 PF01544로 알려진 CorA 도메인은 광범위한 상위 유기체에 추가로 존재하며, 이러한 전달체들은 아래에서 검토될 것이다.null
CorA 유전자는 광범위한 외부 Mg2+ 농도 하에서 S. 장티푸륨으로 구성된다.[29]그러나 최근의 증거는 단백질의 활동이 PhoPQ 2요소 규제 시스템에 의해 규제될 수 있다는 것을 암시한다.[30]이 센서는 인체 내 S. 장티푸리움 감염 과정 중 낮은 외부 Mg2+ 농도에 반응한다.[31]낮은 외부 Mg2+ 조건에서 PhoPQ 시스템은 CorA의 기능을 억제하는 것으로 보고되었으며, 이러한 조건에서는 대체 Mg2+ transports MgTA와 MgtB의 전사가 활성화되어 있는 것으로 이미 확인되었다.[29]Cham농폴과 Groisman은 이를 통해 다른 이온, 특히 Mg2+.[30] Papp과 Maguire가 없는 상태에서 CorA에 의한 Fe(II)의 수송에 의해 발생하는 금속 이온 독성을 벗어날 수 있다고 제안한다.[32]null
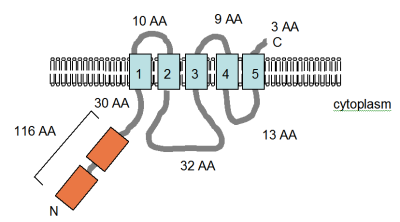
그림(확대하지 않음)은 스미드 외 연구진이 결정한 바와 같이 단백질의 C-단자 부분(파란색으로 표시)에 3개의 막경간 영역이 있다고 하는 S. 티티푸륨 CorA 단백질의 원래 발행된 투과영역(TM) 영역 토폴로지를 나타낸다.[33]코라가 호모테트라머 역할을 한다는 증거는 워렌 외 연구진에 의해 2004년에 발표되었다.[34]2005년 12월에 CorA 채널의 결정 구조가 RSCB 단백질 구조 데이터베이스에 게시되었다.그 결과 이 단백질은 2개의 TM 도메인을 가지고 있으며 이전 보고서와 직접 충돌하여 호모펜타머로 존재한다.이 링크를 따라 3D로 구조를 확인하십시오.단백질의 수용성 세포내부는 양전하 31개와 음전하 53개의 잔류물을 함유하여 높은 충전량을 가진다.반대로 TM 영역에는 충전된 아미노산이 1개만 들어 있는데, 이는 트랜스포터의 활동에서 중요하지 않은 것으로 나타났다.[35]돌연변이 유발 실험에서, Mg2+ 수송의 화학 물질은 수송 모공 내부에 줄지어 있는 히드록실 그룹에 의존하는 것으로 보인다; 또한 GMN 모티브에 대한 절대적인 요구사항이 있다(빨간색으로 표시됨).[35][36]null
CorA의 활동을 체내 연구할 수 있기 전에 박테리아 숙주의 다른2+ Mg 이송 시스템을 식별하여 비활성화하거나 삭제해야 했다(아래 참조).기능성 CorA 유전자가 들어 있지만 MgtA와 MgtB가 부족한 S. 장티푸륨 변종이 생성되었으며[37](아래 참조) 트랜스포터의 흡수 운동학을 분석하였다.[38]이 변종은 표준 매체(50μMMG2+)에서는 거의 정상적인 성장률을 보였으나, 세 유전자를 모두 제거하여 정상 성장을 위해서는 100mM 외부 Mg가2+ 필요한 박테리아 변종을 만들어냈다.[37]null
Mg는2+ 이전 논문에서 설명한 Mg2+ 흡수율과 유사한 운동 및 양이온 민감도를 가진 CorA 수송 시스템만 포함하는 셀로 운송되며, 추가로 정량화되었다[38](표 참조).Mg의2+ 섭취는 이전 연구에서와 같이 고원화되는 것으로 보였으며, 수송량 감소를 위한 실제 메커니즘이 결정되지 않았으므로 단백질이 비활성화된 것으로 가정되어 왔다.[19]Co와2+ Ni는2+ 기능성 CorA 단백질을 함유한 S. 장티푸리움 세포에 독성이 있으며, 이러한 독성은 Mg흡입2+(경쟁 억제)의 차단과 세포 내부에 이러한 이온이 축적되는 데서 비롯된다.[2]Co와2+ Ni는2+ Mg2+(표 참조)에 비해 친화도(km)와 속도(Vmax)가 낮지만 방사능 추적 분석을 통해 CorA에 의해 이송되는 것으로 나타났다.[2][39]Co와2+ Ni의2+ km 값은 정상 환경에서의 세포가 겪을 것으로 예상되는 값보다 훨씬 높기 때문에, CorA 수송 시스템이 자연 조건 하에서 이러한 이온의 흡수를 매개할 가능성은 낮다.[2]현재까지 CorA에 의한 Mn2+ 수송에 대한 증거는 대장균에 한정되어 있다.[26]null
| MG2+ | Co2+ | 니2+ | |
|---|---|---|---|
| km (μM) | 15 | 30 | 240 |
| Vmax(pmol/min/10개8 셀) | 250 | 500 | 360 |
| Ki (μM) - Mg | - | - | 10 |
| Ki (μM) - Co | 50 | - | 20 |
| Ki(μM) - Mn | 30 | - | - |
| Ki(μM) - Ni | 300 | - | 300 |
표에는 CorA Mg2+ 운송 시스템의 운송 동력학이 열거되어 있다.이 테이블의 출판물에서 편집되어 있Snavely(알.(1989b)[38]깁슨(알.(1991년)[39]과 스미스(알.(1998a)[35]과 summarises가 운동 데이터에 대한 CorA 수송 단백질을 표시했다에서 야생형 프로모터의 박테리아 부족한 MgtA과 MgtB.km속도가 강성하여에서 20°C로 이해의 Mg2+에서 37°C너무ra.pid에 measur정확히null
최근 외부 Mg에 대응하여 S. 장티푸리움 세포의 자유 Mg2+2+ 함량을 측정하기 위해 Mg 의존2+ 형광이 사용되었는데, 이는 CorA가 박테리아에서 Mg의2+ 주요 흡수 시스템임을 보여주었다.[19]저자들은 또한 세포의 플라스마 막 전체에 걸친 전위(Δδ)의 변화가 Mg흡수율과2+ 세포의 자유 Mg2+ 함량 모두에 영향을 미친다는 것을 처음으로 보여주었다; 탈극화는 수송을 억제하는 반면, 초극화는 수송을 증가시켰다.이동 동역학은 세포 내에서의 자유 Mg의2+ 변화 속도(250 μM−1 s)에 의해서만 정의되었다.멤브레인 내 CorA 단백질 양에 대한 정량화가 이루어지지 않았기 때문에 이 값은 Mg2+ 전달체에 대한 다른 실험과 비교할 수 없다.[18]null
박테리아 세포에서 Mg의2+ 유출은 Lusk와 Kennedy(1969년)[21]에 의해 처음 관찰되었으며, 세포외 Mg의2+ 높은 농도가 존재하는 상태에서 CorA Mg2+ 수송 시스템에 의해 매개된다.[38]배출은2+ Co2+, Mn, Ni에2+ 의해 유발될 수 있지만, Mg와2+ 같은 정도는 아니다.[23] CorA 운송 시스템을 통한 배출은 관찰되지2+ 않았다.Mg2+ 유출 과정에는 추가로 CorB, CorC 또는 CorD 유전자 중 하나가 필요하다.[39]이 유전자들 중 어떤 하나의 돌연변이도 코라 돌연변이가 제공하는 것의 절반도 안 되는 Co2+ 저항으로 이어진다.이러한 영향은 높은 수준의 Co가2+ 존재할 때 발생할 수 있는2+ Mg 손실의 억제 때문일 수 있다.현재 CorBCD 유전자를 삭제할 때 mg가2+ 더 독성이 있는지 여부는 알려지지 않았다.null
Mg2+ 이온은 처음에는 수화 껍질을 통해 어떤 운반 단백질과도 상호작용할 것으로 추측되어 왔다.[40]코발트(III) 헥사암미네이트, Co(III)Hex는 Mg를2+ 포함한 여러 개의 분위 양이온에 대한 첫 번째 수화 껍데기의 공동 결합(비레이블) 아날로그다.Co(III)Hex 분자의 반지름은 244pm으로 Mg의2+ 첫 번째 수화 껍질의 250pm 반경과 매우 유사하다. 이 아날로그는 Mg2+, Co2+ 또는 Ni보다 더 많은2+ CorA 수송 시스템의 강력한 억제제다.[41]Co(III)Hex 억제의 추가 강도는 단백질이 기질을 '탈수화'할 수 없기 때문에 운반 모공 막힘에서 발생할 수 있다.또한 Co(III)Hex가 세포 안으로 운반되지 않은 것으로 나타나 정상 기질(Mg2+)의 운반에 적어도 부분 탈수증이 필요할 것임을 시사했다.[41]니켈(II) 헥사암민은 반지름이 255 pm인 CorA 전송 시스템을 억제하지 않았으며, 이는 CorA 기질 이온 결합에 대한 최대 크기 제한이 있음을 시사한다.[41]이러한 결과는 CorA가 Mg를2+ 인식하는 데 관여하는 중요한 성질이 첫 번째 수화 껍데기를 가진 이온의 크기라는 것을 암시한다.따라서 일반적으로 두 번째 수화 구역을 포함한 500배 이상의 베어-수화 Mg2+ 이온에 대해 인용되는 부피 변화는 생물학적으로 관련이 없을 수 있으며, 56배의 첫 번째 구 체적 변화가 더 일반적으로 사용되는 이유가 될 수 있다.null
MgTA 및 MgtB
이 두 유전자의 존재는 넬슨과 케네디(1972)가 [25]대장균에 Mg-repressible2+ 및 non-repressible Mg2+ uptake 시스템이 있다는 것을 보여주었을 때 처음 의심되었다.Mg의2+ 회복 불가능한 섭취는 CorA 단백질에 의해 매개된다.S. 장티푸륨에서 억제성 Mg의2+ 섭취는 결국 MgtA와 MgtB 단백질을 통해 나타났다.[37]null
MgtA와 MgtB는 모두 PhoPQ 시스템에 의해 규제되며, S. 장티푸륨에 의한 인간 환자 감염 과정 중에 활발히 기록된다.[31][42][43]비록 어느 유전자도 병원성에는 필요하지 않지만, MgtB 단백질은 세포 내 병원체의 장기 생존을 강화시킨다.[44]이 유전자는2+ 또한 Mg 농도가 50μM 이하로 떨어질 때 체외에서 조절된다(Snavely et al., 1991a).비록 단백질이 CorA와 유사한 km 값을 가지고 있고 이동 속도가 약 10배 낮지만, 이 유전자는 Mg2+ 청소 시스템의 일부일 수 있다.Cham농폴과 Groisman(2002)은 이러한 단백질의 역할이 PhoPQ규정에 의한 CorA 단백질의 불활성화를 보상하는 것일 수 있다는 증거를 제시한다.[30]저자들은 CorA 단백질이 감염2+ 후 세포에 의해 영향을 받는 낮은 Mg 환경에서 단백질을 통해 금속 독성을 회피할 수 있도록 비활성화할 것을 제안한다.null
이 단백질들은 둘 다 P형 ATPases이고[38] 두 유전자 모두 CorA와 유사성을 보이지 않는다.MgtA와 MgtB 단백질은 75%(50% 동일) 유사하지만, MgtB는 살모넬라 병균성 섬 3의 일부로서 수평 유전자 전달에 의해 획득되었을 가능성이 있다.[45][46]MgtB 단백질의 TM 토폴로지는 실험적으로 결정되었는데, 단백질이 세포질 내에 단백질의 종단부가 있는 10개의 TM-스패닝 나선형을 가지고 있음을 보여준다(그림 참조).MgtA는 널리 분산된 박테리아에 존재하지만 CorA만큼 흔하지는 않지만, MgtB는 분포가 상당히 제한되어 있는 것으로 보인다.[47]특이한 분포에 대한 가설은 제시되지 않았다.null
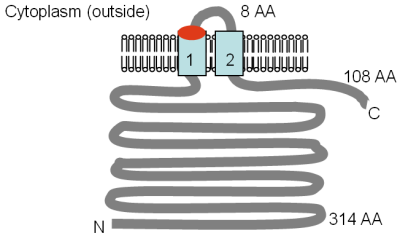
스미스 외 연구진(1993b)에서 개조한 그림은 S. 장티푸륨에서 MgtB 단백질의 실험적으로 결정된 막 위상이다.[48]TM 도메인은 연한 청색으로 표시되며, 멤브레인 내 방향과 N- 및 C-termini의 위치가 표시된다.그 그림은 축척에 맞지 않는다.null
MgtA와 MgtB 단백질은 매우 유사하지만, 그것들은 활동에서 약간의 차이를 보여준다.MgtB는 온도에 매우 민감하여 (Mg 운송과 관련하여2+) 20°C의 온도에서 모든 활동을 상실한다.[38]또한 MgtB와 MgtA는 다른 계량 범위에 의해 억제된다(표 A10.1[38]).null
표에는 37 °C에서 MgtA 및 MgtB 운반 단백질의 운동 데이터와 더불어 S. 장티푸륨 내 MgtA 및 MgtB 운반 단백질의 양이온 전달 특성이 나열되어 있다.[38]괄호 안에 나열된 Vmax 번호는 20 °C에서 흡수할 수 있는 번호들이다.MgtA를 통한 Mn에2+ 의한 Mg2+ 운송 억제는 특이한 운동학적 특성을 보였다(Snavely 등, 1989b의[38] 그림 1 참조).
| MG2+ | Co2+ | ||||
|---|---|---|---|---|---|
| km (μM) | Vmax(pmol/min/10개8 셀) | Ki (μM) | |||
| Co2+ | Mn2+ | 니2+ | |||
| MGTA | 29 | 115(24) | 40 | x | 30 |
| MgtB | 6 | 75(<2) | 8 | 40 | 13 |
MgTA와 MgtB 단백질은 ATPases로 운반 주기당 ATP 분자를 사용하지만, CorA를 통한 Mg2+ uptake는 단순히 전기 화학적으로 유리하다.Cham농폴과 Groisman(2002)은 MgtA와 MgtB 단백질이 금속 독성 회피 시스템의 일부를 형성할 것을 제안했다.[30]또는 대부분의 P형 ATPases가 방류 매개 전달체 역할을 하기 때문에 MgTA와 MgtB 단백질이 현재 미확인 양이온에 대한 방류 단백질 역할을 하며, Mg2+ 이송은 비특이적이거나 수송 과정의 전기중립성을 유지하기 위해 교환되는 것으로 제안되었다.[49]이들 단백질의 생리적 기능을 규정하기 위해서는 추가 실험이 필요할 것이다.null
MgtE
| MgtE | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 식별자 | |||||||||
| 기호 | MgtE | ||||||||
| Pfam | PF01769 | ||||||||
| 인터프로 | IPR006667 | ||||||||
| TCDB | 1.A.26 | ||||||||
| OPM단백질 | 2yvx | ||||||||
| |||||||||
두 논문에서는 MgTA/B 또는 CorA와 무관한 박테리아에서 네 번째 MgtE2+ 흡수 단백질인 MgTE에 대해 설명한다.[3][4]이 유전자의 염기서열이 결정되었고, 크기가 312개의 아미노산인 단백질은 단백질의 C-단자 부분에 밀접하게 배열된 4-5개의 TM 스패닝 영역을 포함할 것으로 예측된다(그림 참조).단백질의 이 부위는 Pfam 데이터베이스에서 보존 단백질 영역(PF01769)으로 확인되었으며, 이 단백질 영역을 가진 단백질을 함유한 종은 CorA의 분포에 비해 상당히 드물지만 Eubacteria와 Arcoga 전체에서 대략 균등하게 분포하고 있다.그러나, 그 영역을 포함하는 단백질의 다양성은 CorA 영역의 다양성보다 현저하게 크다.Pfam 데이터베이스에는 단백질을 포함하는 7개의 MgtE 도메인의 구별되는 그룹이 나열되어 있으며, 그 중 6개는 고대 또는 eubacterial 구성원을 포함하고 있다.MgtE의 표현은 보존된 RNA 구조인 YkoK 리더나 M-box에 의해 자주 제어된다.[51]null
스미스 외 연구진(1995)[4]과 PFAM 데이터베이스 항목에서 각색된 그림(오른쪽)은 바실러스 firmus OF4에 있는 MgtE 단백질의 컴퓨터가 예측한 멤브레인 토폴로지를 보여준다.TM 도메인은 밝은 파란색으로 표시된다.주황색으로 표시된 시스타티오닌-베타 싱타아제에서 식별된 단백질을 위해 명명된 CBS 도메인은 Pfam 데이터베이스에서 규제 영역으로 식별되지만, 작용 메커니즘은 아직 설명되지 않았다.그것들은 몇 개의 전압에 의한 염화수단에서 발견된다.[52]멤브레인 내 방향과 N- 및 C-termini의 위치가 표시된다.이 그림은 저울에 그려지지 않는다.이 트랜스포터는 최근 x-ray 결정학으로 구조를 해결했다.[53]null
MgtE 유전자는 Smith 등(1995)이 박테리아 내 CorA와 같은 단백질을 스크린에서 처음 확인했으며 Mg-uptake-defincipient2+ S. 티티푸륨 변형률 MM281(CorA mgtA mgtB)을 보완해 표준 매체에서 야생형 성장을 복원했다.[4]단백질에2+ 대한 Mg2+ 수송의 운동성은 Mg를 사용할 수 없었기 때문에 결정되지 않았다.대안으로 Co의2+ 흡수량을 측정하여 1km 82μM, Vmax는 354 pmol min−1 10셀인8−1 것으로 나타났다.Mg는2+ Ki가 50μM인 경쟁 억제제였다. CorA를 통한 Co2+2+ uptake 억제 Ki는 10μM이다.[2]MgtA와 CorA에 사용할 수 있는 운동 데이터의 비교가 표에 나와 있다.분명히 MgTE는 Co를2+ CorA와 같은 정도로 수송하지 않으며, Mg에2+ 의한 수송억제 역시 효율성이 떨어지기 때문에 Mg에2+ 대한 MgTE의 친화력이 CorA에 비해 낮다는 것을 알 수 있다.Co2+ uptake의 가장 강력한 억제제는 Zn으로2+, Ki는 20μM이었다.[4]이 단백질에 의한 Zn의2+ 수송은 Mg만큼2+ 중요할 수 있다.
| MG2+ | Co2+ | ||||
|---|---|---|---|---|---|
| km (μM) | Vmax(pmol/min/10개8 셀) | km (μM) | Vmax(pmol/min/10개8 셀) | Ki(Mg2+) (μM) | |
| MgtE | - | - | 82[4](37°C에서) | 354[4](37°C에서) | 50[4](37°C에서) |
| 코라 | 15[38](20°C에서) | 250[38](20°C에서) | 30[2](22°C에서) | 500[2](22°C에서) | 10[2](22°C에서) |
표에는 MgtE와 CorA의 전송동력학을 비교한 내용이 수록되어 있으며, 이들에 대한 키 운동 매개변수 값이 나열되어 있다.표시된 것처럼 데이터는 서로 다른 배양 온도에서 생성되었다.km과 Ki는 배양 온도의 차이로 인해 크게 변화하지 않는다.반대로 Vmax는 온도와 강한 양의 상관 관계를 보여 MgtE에 대한 Co2+ Vmax 값은 CorA 값과 직접 비교되지 않는다.null
효모
초기연구
효모가 Mg를2+ 차지한다는 것을 보여주는 초기 연구는 슈미트 외 연구진(1949년)에 의해 이루어진 것으로 보인다.그러나 이들 저자들은 논문 내 표에 변화된 효모 Mg2+ 함량만을 보여주었고, 보고서의 결론은 전적으로 인산염의 신진대사를 다루었다.로스테인에[54][55] 의한 일련의 실험은 효모가 다음 친화력 시리즈인 Mg2+, Co2+, Zn2+ > Mn2+ > Ni2+ > Ca2+ > Sr로2+ 양이온을 차지한다는 것을 보여주면서 금속 양이온의 섭취 쪽으로 초점을 더 이동시켰다.또한, 다른 양이온의 운송은 박테리아와 매우 유사한 상황인 동일한 운송 시스템에[55][56][57][58] 의해 매개될 것을 제안했다.null
1998년 맥디아미드와 가드너는 마침내 사카로마이오스 세레비시아아에서 관찰된 양이온전달 표현형을 책임지는 단백질을 확인했다.[5]이 시스템과 유전자가 복제된 후 기능적으로 상당히 확인된 제2의 미토콘드리아 Mg2+ 수송 시스템에 관련된 유전자는 아래 절에 설명되어 있다.null
ALR1 및 ALR2
두 유전자인 ALR1과 ALR2는 효모 속의 알3+ 내성(저항)을 위한 화면에서 격리되었다.[5]효모 게놈 DNA를 함유한 과표현 구조물은 야생형 효모에 도입되었고 변형 물질은 알의3+ 독성 수준에서 성장을 위해 검사되었다.플라스미드를 함유한 ALR1과 ALR2는 이러한 조건에서 효모의 성장을 허용했다.null
Alr1p와 Alr2p 단백질은 각각 859와 858개의 아미노산으로 구성되며 70%가 동일하다.C-단자 내의 한 지역에서, 이러한 단백질의 절반은 약하게 전체 CorA 단백질과 유사하다.Alr1p의 컴퓨터가 예측한 TM 토폴로지를 그림에 나타낸다.세 번째 TM 도메인의 존재는 맥디아미드와 가드너(1998년)[5]가 시퀀스 호몰로지 강도에 대해 제안했고, 더 최근에는 리와 가드너(2006년)[59]가 돌연변이 유발 연구의 강도에 대해 제안해 이들 단백질의 TM 위상이 CorA와 더 유사하게 만들었다(그림 참조).또한, Alr1p는 TM 2 (TM 2')의 바깥쪽 끝에 보존된 GMN 모티브를 포함하고 있으며, 이 모티브의 메티오닌(M)이 류신(L)에 변이되어 운반능력의 상실로 이어졌다.[59]null
그림은 Alr1p의 가능한 TM 토폴로지를 보여준다.그림의 파트 A는 효모에 들어있는 Alr1p 단백질의 컴퓨터 예측 막 위상, 파트 B는 Lee와 Gardner(2006)의 실험 결과를 바탕으로 Alr1p의 위상이다.[59]GMN 모티브 위치는 빨간색으로 표시되고 TM 도메인은 밝은 파란색으로 표시된다.멤브레인 내 방향과 N- 및 C-termini의 위치가 표시되며, 수용성 영역의 다양한 크기는 아미노산(AA)으로 제공되며, TM 영역은 CorA와 유사하여 번호가 매겨진다.TM 도메인이 누락된 경우 나머지 도메인에는 소수 번호가 부여된다.그 그림은 축척에 맞지 않는다.세 번째 ALR과 같은 유전자가 S. 세레비시아에 존재하며, 정신분열증균 퐁베와 뉴로스포라 크라사에는 모두 두 개의 동질 유전자가 있다.이 단백질들은 두 번째 N. Crassa 유전자를 제외하고 CorA와 같은 GMN 모티브를 포함하고 있다.ALR과 같은 유전자는 곰팡이 외의 종에서 확인되지 않았다.null
막 분율 및 녹색 형광 단백질(GFP) 융합 연구는 Alr1p가 혈장 막에 국소화된다는 것을 규명했다.[60][61]Alr1p의 국소화는 세포외 양이온에 반응하여 vacuole에서 내부화되고 분해되는 것으로 관찰되었다.매우 낮은 세포외 농도(100μM; 표준 매체 Mg2+ 함량의 10%)에서 Mg와2+ Co2+, Mn은2+ 비교적 높은 농도(>표준 매체)에서 Alr1p 단백질 국소화의 변화를 유도하였고, 그 효과는 기능적 편재화, 내포증, 좌심 분해에 의존하였다.[60]이 메커니즘은 효모에 의한 Mg2+ 흡수 규제를 허용하기 위해 제안되었다.그러나, 최근의 한 보고서는 Stadler 등이 수행한 여러 관측치가 재현할 수 없다는 것을 보여준다.[60][61]예를 들어, Mg2+공급에 의해 ALR1 mRNA축적의 규제, 그 Alr1 단백질의 안정성 과도한 Mg2+에 대한 노출에 의해 감소되지 않았지 않았다.그 Alr1 단백질의 정상low-Mg 조건에서Mg-dependent 축적의 원래었지만, 이 효과가 되는 공예품을 추가로 인한 공개되었다 반복됐다.단백질에 대한 작은 펩타이드(펩타이드)의 이온을 검출할 수 있도록 한다.이러한 문제에도 불구하고, Alr1 활동은 Mg 공급에 반응하는 것으로 입증되었으며,[61] 이는 일부 박테리아 CorA 단백질에 대해 관찰된 바와 같이 단백질의 활성도가 직접 조절된다는 것을 암시한다.[19]null
표준 조건(4 mM Mg2+[5])에서 S. 세레비시아 성장에는 기능 Alr1p(야생형) 또는 Alr2p(과다압압축)가 필요하며, Alr1p는 30μM의 낮은 농도에서도2+ 정상 성장을 지원할 수 있다.[60]57Co는2+ 77~105μM의 km로 Alr1p 단백질을 통해 효모에 흡수되지만(;[56] C. MacDiarmid 및 R. C. C. Gardner, 미발표 데이터) 이 수송에 대한 Ki for Mg2+ 억제는 현재 알려져 있지 않다.Alr1p 단백질에 의한 다른 양이온의 운반은 효모 생장의 억제 때문에 분석되었다.Alr1p의 과도한 압착은 Ca2+, Co2+, Cu2+, La3+, Mn2+, Ni2+, Zn에2+ 대한 민감도를 증가시켰는데, Ca, Co, Cu, La, Mn, Ni, Zn은 CorA와 같은 수송 시스템에 의해 효모로 운반되는 것으로 보이는 것과 유사한 계량이다.[5]트랜스포터가 존재하는 상태에서 양이온의 독성이 증가한 것은 세포 내부의 양이온 축적이 증가했기 때문으로 추정된다.null
Alr1p가 주로 Mg2+ 트랜스포터라는 증거는 Alr1p의 손실이 Mg의2+ 총 세포 함량 감소로 이어지지만 다른 양이온의 감소로 이어지지 않는다는 것이다.또한, 효모나 Xenopus 난모세포에서 Alr1p가 생산된 두 개의 전기생리학 연구는 단백질이 존재하는 상태에서 Mg에2+ 의존하는 전류를 보여주었다;[62] Salih et al., prep.null
Alr1p에 의한 Mg2+ uptake의 운동학들은 전체 효모세포에 대한 전기생리학 기법에 의해 연구되어 왔다.[62]그 결과는 Alr1p가 이온 선택 채널의 역할을 할 가능성이 매우 높다는 것을 시사했다.같은 논문에서 저자들은 Alr1p에 의한 Mg2+ 수송은 200 pA에서 1500 pA까지 다양하며 평균 전류는 264 pA라고 보고했다.전류를 생성하는 단백질의 양에 대한 정량화가 제시되지 않았기 때문에, 그 결과는 박테리아 Mg2+ 운반 단백질과의 비교가능성이 부족하다.null
Mg2+ radiotracer 분석과 Mg2+ uptake 측정을 위한 mag-fura 2의 대체 기법은 아직 Alr1p와 함께 사용되지 않았다.28Mg는2+ 현재 사용할 수 없으며 mag-fura 2 시스템은 효모에 간단한 흡수 데이터를 제공할 가능성이 낮다.효모세포는 효모 내부의 여러 시스템이 Mg를2+ 저장실로 운반하고 있음을 암시하는 Mg의2+[63] 이질적인 분포를 유지한다.이 내부 운송은 흡수 과정을 가릴 가능성이 매우 높다.Mg흡입2+ 유전자가 없는 S. 장티푸륨에서 ALR1의 발현이 대안이 될 수도 있지만, 앞에서 설명한 바와 같이 이질적 발현체계의 영향을 고려할 필요가 있을 것이다.null
MNR2
MNR2 유전자는 Alr 단백질과 밀접하게 관련된 단백질을 암호화하고 있지만, 진균 게놈에서 CorA 단백질의 구별되는 부분군을 정의하는 보존된 특징을 포함하고 있어 Mg홈스타시스에서2+ 뚜렷한 역할을 시사하고 있다.alr1 돌연변이와 마찬가지로 mnr2 돌연변이의 생장은 mg-definition에2+ 민감했지만, mnr2 돌연변이는 이러한 조건 하에서 야생형 변종보다 mg이2+ 더 많이 축적되는 것이 관찰되었다.[64]이러한 표현형태는 Mnr2가 세포내 구획 내의 Mg2+ 저장을 조절할 수 있음을 시사했다.이러한 해석과 일관되게 Mnr2 단백질은 효모에 의한 과잉 미네랄 영양소의 저장에 관여하는 내부 구획인 바쿠올의 막에 국부화되었다.Mg2+ 운송에서 Mnr2의 직접적인 역할은 일부 Mnr2 단백질을 세포 표면으로 리디렉션한 Mnr2의 증가된 표현도 alr1 alr2 이중 돌연변이 변종의 Mg-필수를2+ 억제한다는 관찰에 의해 제시되었다.mnr2 돌연변이는 또한 이 돌연변이가 Alr 유전자 발현이나 단백질 활동을 증가시킬 수 있다는 것을 암시하면서, 다른 이분법들의 축적을 변화시켰다.최근 연구는 Mnr2 돌연변이 변종에서 Alr1 활성도가 증가했으며, 돌연변이가 Mnr2 야생형 변종에서 관찰된 것보다 더 높은 외부 Mg 농도에서의 Alr1 활동 유도와 관련이 있다는 것을 보여줌으로써 이 모델을 뒷받침했다.이러한 영향은 Alr1 단백질 축적의 변화 없이 관찰되었으며, 다시 말해 Alr1 활성도가 세포 내의 Mg 농도에 의해 직접 조절될 수 있음을 나타낸다.null
MISS2 및 Lpe10
ALR 유전자와 마찬가지로 MG2+ 트랜스포터로 식별되기 전에 MISS2 유전자를 복제하여 염기서열 처리하였다.MISS2 유전자는 미토콘드리아 유전자 RNA 스플리싱 돌연변이의 억제기 화면에서 효모의 핵 게놈에서 확인되었고,[65] 비센버거 외 연구진(1992)에 의해 복제되어 염기서열화되었다.[66]Mrs2p는 Bui 외 연구진(1999년)이 있을 때까지 Putpative Mg2+ 트랜스포터로 확인되지 않았다.[6]그레건 외(2001a) MISS2에 대한 호몰로 LPE10을 식별하고 LPE10과 MISS2 돌연변이가 효모 미토콘드리아의 Mg2+ 함량을 변경하고 오르가넬의 RNA 스플리싱 활동에 영향을 미친다는 것을 보여주었다.[67][68]Mg2+ 운송은 Mrs2p에 의해 직접 매개되는 것으로 나타났지만 [18]Lpe10p에 대해서는 그렇지 않다.null
Mrs2p와 Lpe10p 단백질은 각각 크기가 470, 413개의 아미노산 잔류물이며, 단백질 가운데 250~300개의 아미노산 부위는 전체 CorA 단백질과 유사성이 약한 것으로 나타났다.Mrs2p 및 Lpe10p 단백질의 TM 토폴로지는 프로테아제 보호 검사를[6][67] 사용하여 평가되었으며 그림에 나와 있다.TM 1과 2는 CorA 단백질의 TM 2와 3에 해당한다.보존된 GMN 모티브는 첫 번째 TM 도메인의 바깥쪽 끝에 있으며, 이 모티브의 글리신(G)이 Mrs2p에서 시스틴(C)으로 변이되면서 Mg2+ 운송이 강하게 줄어들었다.[18]null
그림은 Bui 외 연구진(1999년)[6]과 Gregan 외 연구진에서 채택한 Mrs2p와 Lpe10p의 실험적으로 결정된 위상이다.(2001a).[67]GMN 모티브 위치는 빨간색으로 표시되고 TM 도메인은 밝은 파란색으로 표시된다.멤브레인 내 방향과 N- 및 C-termini의 위치가 표시된다.수용성 도메인의 다양한 크기는 아미노산(AA)으로 주어지고 TM 도메인에는 번호가 매겨지며, 수치는 스케일로 그려지지 않는다.null
Mrs2p는 세포하분열과 면역검출에[6] 의해 미토콘드리아 내막으로 국부화되었고, Lpe10p는 미토콘드리아로 옮겨졌다.[67]Mrs2p가 부족한 미토콘드리아는 Mg의2+ 빠른 흡수를 보여주지 않고, 단지 느린 '약탈'을 보일 뿐이며, Mrs2p의 과대산화는 초기 흡수율의 증가로 이어진다.[18]또한 CorA는 Mrs2p의 미토콘드리아 리더 시퀀스에 융합되었을 때 Mrs2p 또는 Lpe10p의 상실에 의해 부여된 미토콘드리아 결함을 부분적으로 보완할 수 있다.따라서 Mrs2p 및/또는 Lpe10p는 미토콘드리아에 대한 주요2+ Mg흡입 시스템일 수 있다.단백질은 (과다 눌렸을 때) 어느 것도 다른 단백질의 상실을 완전히 보완할 수 없기 때문에 단백질은 이단체를 형성할 가능성이 있다.[67]null
Mrs2p에 의한 고립된 미토콘드리아에서의 Mg2+ uptake의 특성은 mag-fura 2를 사용하여 정량화되었다.[18]Mrs2p에 의한 Mg의2+ 획득은 CorA와 많은 속성을 공유했다.첫째, Mg2+ 흡수는 경계막을 가로지르는 전위(Δδ)에 직접 의존하였다.둘째, Δδ 이론적으로 허용한 것보다 훨씬 낮은 흡수율이기 때문에 Mg2p부인에 의한 Mg의2+ 수송은 CorA와 유사한 방식으로 규제될 가능성이 높으며, 단백질의 불활성화에 의해서도 가능하다.셋째, Mg2+ 유방은 Valinomycin에 의한 미토콘드리아 막의 인공 탈분극화 시 Mrs2p를 통해 관찰되었다.마지막으로, Mrs2p를2+ 통한 Mg 플럭스는 코발트(III) 헥사암미네이트에 의해 억제된다.[18]null
Mrs2p에 의한 Mg2+ uptake의 동역학은 Froschauer 등지에서 결정되었다.(2004) CorA에 대한 박테리아 종이.[19]자유 Mg2+ 농도의 초기 변화는 야생형의 경우 150 μM s-1, 효모 과다압축으로 인한 미토콘드리아의 경우 750 μM s-1이었다. MISS2. 관측된 이송량을 존재하는 이송량까지 스케일링하려는 시도가 없었다.null
원생동물 (파라메슘)
Mg의2+ 파라메치움으로의 수송은 주로 R. R. Preston과 그의 동료들에 의해 특징지어졌다.헤인즈 외 연구진에 의해 유전자가 복제되기 전에 일련의[69][70][71][72] 논문에서 Mg2+ 전류를 식별하고 특성화하는 데 파라메슘 전체의 전기생리학 기법이 사용되었다.(2002).[7]null
XNTA 유전자의 개방형 판독 프레임은 크기가 1707bp이며 2개의 인트론을 포함하고 있으며 550개의 아미노산 예측 단백질을 생성한다.[7]단백질은 11개의 TM 도메인을 포함할 것으로 예측되었으며, 또한 SLC8(Na+/Ca2+ 교환기[73])과 SLC24(K+ 종속 Na+/Ca2+ 교환기[74])의 α1 및 α2 모티브(그림 참조)를 포함하고 있다.XntAp는 아미노산 염기서열로 SLC8, SLC24 단백질 계열과 동등하게 유사하지만, 예측 TM 위상은 SLC24와 더 비슷하지만 유사성이 기껏해야 약하고 관계가 매우 멀다.[7]식물에서 추출한 AtMHX 단백질은 또한 SLC8 단백질과 원거리 관계를 공유한다.null
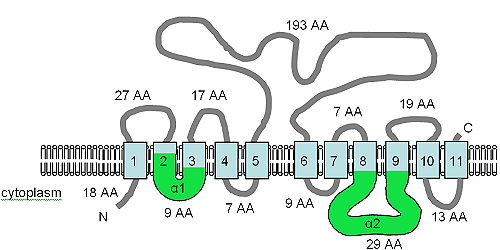
그림은 XntAp의 예측 TM 토폴로지를 보여준다.헤인즈 외 연구진으로부터 개조되었다.([7]2002) 이 그림은 파라메슘의 XntAp의 컴퓨터 예측 막 위상이다.막의 방향은 HMMTOP을 사용하여 결정되었다.[75][76]TM 도메인은 옅은 청색으로 표시되고, α1 및 α2 도메인은 녹색으로 표시된다.멤브레인 내 방향과 N- 및 C-termini의 위치가 표시되며 스케일에 따라 그림이 그려지지 않는다.null
XntAp가 운반하는 Mg 의존2+ 전류는 채널 단백질의 그것과 운동학적으로 유사하며, 이온 선택성 순서는 Mg2+ > Co2+, Mn2+ > Ca이며2+, 이온 선택성 순서는 다시 CorA와 매우 유사하다.[72]지금까지 보고된 다른 이송 단백질과 달리 XntAp는 세포내 Ca에2+ 의존한다.또한 이송은 Δψ에 의존하지만, 다시 Mg는2+ 평형상태로 이송되지 않고 세포질에서 약 0.4 mM 자유 Mg로2+ 제한된다.그 결과 자유농도 Mg2+(8mM)가 훨씬 높은 세포내 구획의 존재가 뒷받침되었다.null
동물
인간을 포함한 동물에서의 mg에2+ 대한 조사는 박테리아와 효모에 있어서 그것보다 뒤쳐졌다.이것은 크게 관련 시스템의 복잡성 때문이기도 하지만, 또한 Mg가2+ 모든 세포에서 높은 수준으로 유지되고 외부의 영향에 의해 변하지 않는다는 분야 내의 인상 때문이기도 하다.지난 25년 동안만 이 관점에 도전하기 시작한 일련의 보고서가 있는데, 새로운 방법론에서 자유로운 Mg2+ 함량이 세포 대사에 영향을 미칠 수 있는 수준으로 유지된다는 것을 발견했다.[77]null
MISS2
시퀀스 데이터베이스를 생물정보적으로 검색한 결과, 메타존스 범위에서 효모 MISS2 유전자의 한 동음이의어가 확인되었다.[8]단백질은 효모 단백질과 매우 유사한 염기서열로 TM 위상이 예측되었으며, GMN 모티브는 첫 번째 TM 도메인의 끝부분에 온전하다.인간 단백질인 hsaMrs2p는 GFP 융합 단백질을 사용하여 쥐 세포의 미토콘드리아 막에 국소화되었다.null
포유류에서 단백질의 Mg2+ 이동 특성에 대해서는 거의 알려져 있지 않지만, Zsurka 등은 알려져 있다.(2001) 인간 Mrs2p는 효모 미토콘드리아 Mg의2+ 흡수 시스템에서 mrs2 돌연변이를 보완한다는 것을 보여주었다.[8]null
SLC41(MgtE)
메타조아에서 이 유전자 계열의 식별은 분비 단백질과 막 단백질을 분리하기 위한 신호 시퀀스 트랩 방식에서 시작되었다.[9]신원 확인의 상당 부분은 생물정보분석에서 나온 것이다.결국 인간에게서 세 개의 유전자가 확인되었고, 또 다른 유전자는 생쥐에서 세 개, 선충에서 세 개가 확인되었으며, 아노펠레스 감비아에서 한 개의 유전자가 확인되었다.pFAM 데이터베이스는 MgtE 도메인을 pFAM01769로 나열하고 Drosopila 멜라노가스터에서 MgtE 도메인 함유 단백질을 추가로 식별한다.MgtE 도메인을 포함하는 단백질은 각 단백질에서 식별할 수 있는 도메인의 유형과 조직을 사용하여 pFAM이 정의한 7가지 등급으로 나눌 수 있다.메타조아 단백질은 7개 그룹 중 3개 그룹에 존재한다.메타조아 단백질은 모두 2개의 MgtE 도메인을 포함하고 있지만, 이 중 일부는 문맥 인식(코인, 베이트만, 더빈, 미발표)만으로 예측되어 왔다.자세한 내용은 pFAM 웹 사이트를 참조하십시오.)null
인간 SLC41A1 단백질은 PF01769 컨센서스 시퀀스와 유사도가 각각 52%와 46%인 2개의 MgtE 도메인을 포함하고 있으며 각 MgtE 도메인에 5개씩 10개의 TM 도메인을 포함할 것으로 예측된다(그림 참조). 이는 박테리아의 MgtE 단백질이 조광기로 작용할 수 있음을 시사한다.null
Wabakken 등으로부터 개조됨.(2003)[9] 및 pFAM 데이터베이스는 H. 사피엔스에서 MgtE의 컴퓨터 예측 멤브레인 토폴로지를 보여준다.TM 영역은 연한 청색으로 표시되고, 막의 방향과 N- 및 C-termini의 위치가 표시되며, 그림은 스케일로 그려지지 않는다.null
와바켄 외(2003) [9]SLC41A1 유전자의 대본이 모든 인체 조직에서 시험되었지만 다양한 수준에서 심장과 고환이 유전자의 가장 높은 발현을 가지고 있다는 것을 발견했다.Mg와2+ 관련된 생리학에 관해서는 표현 패턴에 대한 어떠한 설명도 제시되지 않았다.null
SLC41 단백질이 Mg를2+ 운반하는지는, 실험 시스템에서 Mg2+ 운반 돌연변이를 보완하는지는 밝혀지지 않았다.다만 MgTE 단백질은 다른 알려진 기능이 없어 세균에 있는 만큼 메타조아 내 Mg2+ 전달체일 가능성이 높다는 의견이 제기됐다.[9]이것은 Mg2+ 운송을 검사하기 위해 현재 표준 실험 시스템 중 하나를 사용하여 검증해야 할 것이다.null
TRPM6/ TRPM7
인간 세포에 있는 TRPM 유전자와 단백질에 대한 조사는 최근 격렬한 연구와 때로는 논쟁의 영역이다.몬텔 외(2002) [78]TRP 유전자에 대한 연구를 검토했으며, Montell(2003)[79]의 두 번째 리뷰는 TRPM 유전자에 대한 연구를 검토했다.null
이온 채널의 TRPM 계열은 메타조아 전역에 멤버를 가지고 있다.TRPM6와 TRPM7 단백질은 이온 채널 영역과 키나제 영역(그림 1.7)을 모두 포함하고 있어 매우 특이하며, 그 역할이 가장 뜨거운 논쟁을 불러일으킨다.[79]null
이 두 단백질의 활동은 수량화하기 매우 어려웠다.TRPM7 자체로는 Ca2+[80] 채널로 보이지만 TRPM6가 존재하는 경우 이송된 양이온의 선호도 시리즈는 Ca보다2+ Mg가2+ 높다.[10][81]보고된 전도성의 차이는 이러한 유전자의 표현 패턴에 의해 야기되었다.TRPM7은 지금까지 테스트한 모든 세포 유형에서 표현되는 반면, TRPM6는 표현 패턴이 더 제한되어 있다.[82]Voets 외, (2004)[83]의 불행한 실험 시스템 선택은 TRPM6가 기능적인 Mg2+ 트랜스포터라는 결론으로 이어졌다.그러나 추바노프 외 연구원의 후일 작업.(2004)[82]은 TRPM6 활동에 TRPM7이 필요하며 Voets 등의 결과가 실험에서 Voets 등이 사용하는 실험 세포 라인에서 TRPM7의 표현으로 설명된다는 것을 명확히 보여주었다.TRPM6가 그 자체로 기능하는지는 아직 결정되지 않았다.null
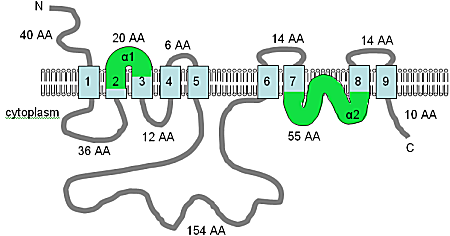
TPRM6와 TRPM7 단백질의 예측 TM 위상은 Nadler 등으로부터 채택되었다.(2001),[10] Runnels 등(2001)[84] 및 몬텔 외(2002) [78]이 그림은 호모 사피엔스의 TRPM6와 TRPM7 단백질의 컴퓨터 예측 막 위상이다.이때 표시된 위상은 가설로 간주해야 한다.TM 도메인은 연한 청색으로, 모공 루프는 보라색으로, TRP 모티브는 빨간색, 키나제 도메인은 녹색으로 표시된다.멤브레인 내 방향과 N- 및 C-termini의 위치가 표시되며 스케일에 따라 그림이 그려지지 않는다.null
Voets 등의 결론.(2004)[83] 용지는 Mg2+ 종속 전류를 TRPM7에만 귀속시키는 것이 잘못될 수 있으며, 이들의 운동 데이터는 결합된 TRPM7/TRM6 채널을 반영할 가능성이 있다.이 보고서는 전기생리학 기법과 세포질 자유2+ Mg의 변화를 결정하기 위한 mag-fura 2에 기초하여 Mg를2+ 통과하는 채널과 같은 활동과 일치하는 데이터의 강력한 컬렉션을 제시한다.
파라셀룰러 수송
클라우딘은 파라셀룰러 경로를 통한 Mg 수송을 허용한다. 즉, 그것은2+ 상피 세포층을 형성하는 세포들 사이의 촘촘한 결합을 통해 이온의 수송을 매개한다.특히 클라우딘-16은 인간 신장에서 Mg의2+ 선택적 재흡수를 허용한다.CLDN19 유전자에 돌연변이가 있는 일부 환자들도 마그네슘 운반에 변화를 주었다.[85][86]null
클라우딘-16 유전자는 사이먼 외 연구진(1999년)에 의해 복제되었지만,[12] 일련의 보고가 있은 후에야 유전자나 단백질이 없는 Mg2+ 플럭스 그 자체를 기술했다.[87][88][89]유전자의 발현 패턴은 RT-PCR에 의해 결정되었으며, 대수적으로 두꺼운 하행 사지에서 원위적 난관까지 이어지는 신장관절의 연속적인 부위에 매우 밀접하게 국한되어 있는 것으로 나타났다.[12]이러한 국소화는 신장에 의한 Mg2+ 재흡수 위치에 대한 이전의 보고와 일치했다.복제에 이어 고칼슘혈증과 네프로칼시노스를 동반한 가족성 저혈당증 환자에서 유전자의 돌연변이가 확인돼 유전자와 Mg의2+ 섭취 사이의 연관성을 강화했다.[90][91]
식물
식물에서 Mg2+ 수송을 위한 분자 메커니즘에 대한 현재의 지식은 매우 제한적이며, 단지 3개의 간행물만이 식물에서 Mg2+ 수송을 위한 분자 기준을 보고하고 있다.[13][14][15]그러나 식물에 대한 Mg의2+ 중요성은 잘 설명되어 있으며, Mg의2+ 효과에 대한 생리학적, 생태학적 연구는 수없이 많다.이 절에서는 CorA와 먼 관계가 있는 식물에서 확인된 유전자 계열의 지식을 요약한다.이 유전자 계열 및 CorA와도 관련이 없는 또 다른 유전자 Mg2+/H+ 교환기(ATMHX[15])는 vacuolar membrane에 국소화되며, 마지막으로 설명될 것이다.null
AtMISS2 유전자군
쇼크 외(2000) 효모의 MISS2 유전자와 유전자의 유사성을 근거로 하여 AtMISS2 계열을 식별하고 이름을 붙였다.[13]저자들은 또한 AtMISS2-1 유전자가 ΔMRS2 효모 돌연변이 표현형을 보완할 수 있다는 것을 보여주었다.독립적으로, Li et al.([14]2001) 가족을 식별하고 두 명의 추가 구성원이 S. 장티푸리움 및 S. 세레비시아에 있는 Mg2+ 운송 결핍 돌연변이를 보완할 수 있다는 보고서를 발표했다.null
그동안 mg를2+ 운반하는 것으로 밝혀진 유전자는 atMISS2-1, atMISS2-10, atMISS2-11로 이들 유전자는 각각 442개, 443개, 459개의 아미노산 단백질을 생산한다.각각의 단백질은 효모의 Mrs2p와 상당한 유사성과 박테리아의 CorA와 약한 유사성을 보이며, 첫 번째 TM 도메인의 바깥쪽 끝에 보존된 GMN 아미노산 모티브를 포함하고 있으며, 두 개의 TM 도메인을 가질 것으로 예측된다.null
AtMASS2-1 유전자는 MISS2 프로모터의 효모로 표현되고 Mrs2p 단백질의 처음 95개 아미노산에 C-단자적으로 융합되었을 때 미토콘드리아로 향했고, 거기서 Δmrs2 돌연변이(mitochondrial RNA 스플라이싱이 복원되었다)와 오르간젤의 Mg2+ 함유량을 모두 보완했다.[13]수송의 동력학에 대한 데이터는 제시되지 않았다.AtMISS2-11 유전자는 효모(alr1 alr2 변종)에서 분석되었으며, 여기서 유전자 발현이 총 세포 Mg2+ 함량의 불꽃 원자 흡수 분광법을 사용하여 측정했을 때 제어기에 대한 Mg의2+ 굶주린 세포 흡수율을 유의하게 증가시킨 것으로 나타났다.그러나 Alr1p는 낮은 세포외 농도로 Mg를2+ 운반하는데 현저하게 더 효과가 있는 것으로 나타나 Mg에2+ 대한 AtMISS2-11의 친화력이 Alr1p에 비해 낮음을 시사했다.[14]Xenopus 난모세포의 AtMUSR2-11 단백질에 대한 전기생리학(전압 클램프) 분석 결과 내부 막전위(Δψ)에서 Mg 의존2+ 전류가 확인되었다.[92]이러한 값은 식물의 여러 막이 이 범위에서 Δ³을 유지하므로 생리학적으로 유의하다.그러나 저자는 AtMISS2-11 단백질을 함유한 난모세포의 명백한 '사망'으로 인해 이러한 결과를 재현하는 데 어려움을 겪었으므로 이러한 결과는 주의 깊게 보아야 한다.null
AtMISS2-10 트랜스포터는 방사능 추적기 흡수 분석을 사용하여 분석하였다.[14]63Ni는2+ 대체 이온으로 사용되었고 Mg는2+ 20μM의 Ki로 63Ni의2+ 흡수를 억제하는 것으로 나타났다.또한 업테이크는 Co(III)Hex와 다른 분음 계수에 의해 억제되었다.Co와2+ Cu만2+ 1mM 미만의 Ki 값을 가진 운송을 금지했다.null
AtMISS2-10 단백질이 GFP에 융합되어 혈장 막에 국소화된 것으로 나타났다.[14]쇼크 외 연구진에서도 비슷한 실험이 시도했다.([13]2000) 종이 그러나 관찰된 국소화는 사용되지 않은 GFP에서 본 것과 크게 다르지 않았다.Schock 등 논문에서 AtMISS2-1에 대한 명확한 국소화가 없는 가장 유력한 이유는 저자들이 단백질에서 TM 도메인을 제거하여 멤브레인 삽입을 방해하기 때문이다.null
식물의 AtMISS2-1과 AtMISS2-10 단백질의 정확한 생리학적 중요성은 아직 명확히 밝혀지지 않았다.A. Thaliana에서 AtMISS2-11 유전자는 (CaMV 35S 프로모터로부터) 과도하게 압박되어 왔다.[92]유전자 변형 라인은 높은 수준의 AtMISS2-11 대본을 축적하는 것으로 나타났다.강력한 Mg2+ 결핍 표현형(잎 위의 난점, 아래 1.5장 참조)은 동형체 검사 과정에서 기록되었으나(T1세대와 T2세대 모두) T3세대에서 이 표현형은 소실되어 이전 세대가 두 번째 검사를 받았을 때 재현할 수 없었다.저자는 일관성 없는 표현형의 원인이 환경적 효과일 가능성이 크다고 제시했다.null
앳MHX
모든 다세포 유기체에 격리된 최초의 마그네슘 운반체 AtMHX는 이전에 격리된 Mg2+ 운반 단백질과 유사하지 않다.[15]이 유전자는 처음에 A. thaliana 유전자의 DNA 시퀀스 데이터베이스에서 인간의 Na+/Ca2+ 교환기 유전자의 SLC8 계열과 유사하여 확인되었다.null
1990 bp의 cDNA 염기서열은 539-아미노산 단백질을 생산할 것으로 예측된다.AtMHX는 아미노산 수준에서 SLC8 계열과 상당히 밀접하게 관련되어 있으며 11개의 예상 TM 도메인과 위상(그림 A10.5)을 공유한다.긴 embranal 루프(그림 A10.5 참조)가 AtMHX 단백질에서는 148개의 아미노산이지만 SLC8 단백질에서는 500개의 아미노산이라는 점에서 시퀀스에는 큰 차이가 있다.단, 이 루프는 잘 보존되지 않아 SLC8 계열의 운송 기능에는 필요하지 않다.[15]null
AtMHX 유전자는 발전소 전체에 걸쳐 표현되지만 혈관 조직에서 가장 강하게 표현된다.[15]저자들은 단백질의 생리학적 역할은 Mg를2+ 나중에 필요할 때 방출할 수 있도록 이러한 조직에 저장하는 것이라고 제안한다.vacuolar membrane에 대한 단백질 국소화는 이 제안을 뒷받침한다(1.5장 참조).null
단백질은 전기생리학 기법에 의해 증명된 바와 같이 Mg를2+ vacuolar 공간과 H를 밖으로+ 운반한다.[15]운반은 H-ATPase에+ 의해 좌심 공간(pH 4.5~5.9)과 세포질(pH 7.3~7.6) 사이에서 유지되는 ΔpH에 의해 구동된다.[93][94]단백질에 의한 Mg의2+ 운반방법은 결정되지 않았다.전류는 단백질을 양방향으로 통과하는 것으로 관찰되었지만 Mg2+ 출력 전류는 '사이토플라즘' pH 5.5를 필요로 했는데, 이는 정상적인 상황에서 식물 세포에서는 발견되지 않는 조건이다.Mg의2+ 운반 외에, Shaul 외 연구진(1999)[15]은 단백질이2+ Zn과2+ Fe를 운반할 수 있다는 것을 보여주었지만, 다른 분량(예: Co와2+ Ni2+)을 운반할 수 있는 단백질의 용량이나 코발트(III) 헥사민에 의한 억제 감수성에 대해서는 보고하지 않았다.null
AtMHX에 대한 Mg2+ 운송의 상세 동력은 결정되지 않았다.그러나 생리적 효과는 입증되었다.A.aliana 식물이 CaMV 35S 추진자에 의해 추진된 AtMHX 유전자의 과다압축 구조로 변형되었을 때, 그 식물들은 단백질을 과다하게 축적했고 잎에 괴사성 병변의 표현형을 보였는데, 그것은 그들의 관찰로 볼 때, 저자들이 제안하는 바쿠올의 정상적 기능의 붕괴에 의한 것이다.식물의 l Mg2+(또는 Zn2+) 함량은 유전자이전 식물에서 변경되지 않았다.null
이미지는 샤울 외 연구진(1999년)[15]과 퀘드나우 외 연구진으로부터 개조되었다.(2004)[73] HMMTOP을 사용한 분석과 결합하여 이 그림은 아라비도피스 탈리아나에서 AtMHX 단백질의 컴퓨터 예측 막 위상이다.이때 표시된 위상은 가설로 간주해야 한다.TM 영역은 연한 청색으로 표시되고, 막의 방향과 N- 및 C-termini의 위치가 표시되며, 그림은 스케일로 그려지지 않는다.녹색으로 표시된 α1과 α2 영역은 둘 다 상당히 소수성이 강하며 둘 다 막에 삽입될 수 있다.null
참조
- ^ Subramani, Saranya; Perdreau-Dahl, Harmonie; Morth, Jens Preben (2016-01-01). "The magnesium transporter A is activated by cardiolipin and is highly sensitive to free magnesium in vitro". eLife. 5. doi:10.7554/eLife.11407. ISSN 2050-084X. PMC 4758953. PMID 26780187.
- ^ a b c d e f g h i Hmiel SP, Snavely MD, Miller CG, Maguire ME (Dec 1986). "Magnesium transport in Salmonella typhimurium: characterization of magnesium influx and cloning of a transport gene". Journal of Bacteriology. 168 (3): 1444–50. doi:10.1128/jb.168.3.1444-1450.1986. PMC 213658. PMID 3536881.
- ^ a b Townsend DE, Esenwine AJ, George J, Bross D, Maguire ME, Smith RL (Sep 1995). "Cloning of the mgtE Mg2+ transporter from Providencia stuartii and the distribution of mgtE in gram-negative and gram-positive bacteria". Journal of Bacteriology. 177 (18): 5350–4. doi:10.1128/jb.177.18.5350-5354.1995. PMC 177332. PMID 7665526.
- ^ a b c d e f g h Smith RL, Thompson LJ, Maguire ME (Mar 1995). "Cloning and characterization of MgtE, a putative new class of Mg2+ transporter from Bacillus firmus OF4". Journal of Bacteriology. 177 (5): 1233–8. doi:10.1128/jb.177.5.1233-1238.1995. PMC 176728. PMID 7868596.
- ^ a b c d e f MacDiarmid CW, Gardner RC (Jan 1998). "Overexpression of the Saccharomyces cerevisiae magnesium transport system confers resistance to aluminum ion". The Journal of Biological Chemistry. 273 (3): 1727–32. doi:10.1074/jbc.273.3.1727. PMID 9430719.
- ^ a b c d e Bui DM, Gregan J, Jarosch E, Ragnini A, Schweyen RJ (Jul 1999). "The bacterial magnesium transporter CorA can functionally substitute for its putative homologue Mrs2p in the yeast inner mitochondrial membrane". The Journal of Biological Chemistry. 274 (29): 20438–43. doi:10.1074/jbc.274.29.20438. PMID 10400670.
- ^ a b c d e Haynes WJ, Kung C, Saimi Y, Preston RR (Nov 2002). "An exchanger-like protein underlies the large Mg2+ current in Paramecium". Proceedings of the National Academy of Sciences of the United States of America. 99 (24): 15717–22. Bibcode:2002PNAS...9915717H. doi:10.1073/pnas.242603999. PMC 137782. PMID 12422021.
- ^ a b c Zsurka G, Gregán J, Schweyen RJ (Mar 2001). "The human mitochondrial Mrs2 protein functionally substitutes for its yeast homologue, a candidate magnesium transporter". Genomics. 72 (2): 158–68. doi:10.1006/geno.2000.6407. PMID 11401429.
- ^ a b c d e Wabakken T, Rian E, Kveine M, Aasheim HC (Jul 2003). "The human solute carrier SLC41A1 belongs to a novel eukaryotic subfamily with homology to prokaryotic MgtE Mg2+ transporters". Biochemical and Biophysical Research Communications. 306 (3): 718–24. doi:10.1016/S0006-291X(03)01030-1. PMID 12810078.
- ^ a b c Nadler MJ, Hermosura MC, Inabe K, Perraud AL, Zhu Q, Stokes AJ, Kurosaki T, Kinet JP, Penner R, Scharenberg AM, Fleig A (May 2001). "LTRPC7 is a Mg.ATP-regulated divalent cation channel required for cell viability". Nature. 411 (6837): 590–5. Bibcode:2001Natur.411..590N. doi:10.1038/35079092. PMID 11385574. S2CID 4426202.
- ^ Walder RY, Landau D, Meyer P, Shalev H, Tsolia M, Borochowitz Z, Boettger MB, Beck GE, Englehardt RK, Carmi R, Sheffield VC (Jun 2002). "Mutation of TRPM6 causes familial hypomagnesemia with secondary hypocalcemia". Nature Genetics. 31 (2): 171–4. doi:10.1038/ng901. PMID 12032570. S2CID 33192419.
- ^ a b c Simon DB, Lu Y, Choate KA, Velazquez H, Al-Sabban E, Praga M, Casari G, Bettinelli A, Colussi G, Rodriguez-Soriano J, McCredie D, Milford D, Sanjad S, Lifton RP (Jul 1999). "Paracellin-1, a renal tight junction protein required for paracellular Mg2+ resorption". Science. 285 (5424): 103–6. doi:10.1126/science.285.5424.103. PMID 10390358.
- ^ a b c d e Schock I, Gregan J, Steinhauser S, Schweyen R, Brennicke A, Knoop V (Nov 2000). "A member of a novel Arabidopsis thaliana gene family of candidate Mg2+ ion transporters complements a yeast mitochondrial group II intron-splicing mutant". The Plant Journal. 24 (4): 489–501. doi:10.1046/j.1365-313x.2000.00895.x. PMID 11115130.
- ^ a b c d e f Li L, Tutone AF, Drummond RS, Gardner RC, Luan S (Dec 2001). "A novel family of magnesium transport genes in Arabidopsis". The Plant Cell. 13 (12): 2761–75. doi:10.1105/tpc.13.12.2761. PMC 139487. PMID 11752386.
- ^ a b c d e f g h i Shaul O, Hilgemann DW, de-Almeida-Engler J, Van Montagu M, Inz D, Galili G (Jul 1999). "Cloning and characterization of a novel Mg(2+)/H(+) exchanger". The EMBO Journal. 18 (14): 3973–80. doi:10.1093/emboj/18.14.3973. PMC 1171473. PMID 10406802.
- ^ Borrelly G, Boyer JC, Touraine B, Szponarski W, Rambier M, Gibrat R (Aug 2001). "The yeast mutant vps5Delta affected in the recycling of Golgi membrane proteins displays an enhanced vacuolar Mg2+/H+ exchange activity". Proceedings of the National Academy of Sciences of the United States of America. 98 (17): 9660–5. doi:10.1073/pnas.161215198. PMC 55508. PMID 11493679.
- ^ Tevelev A, Cowan J (1995). "Metal substitution as a probe of the biological chemistry of magnesium ion.". In Cowan J (ed.). The Biological Chemistry of Magnesium. New York: VCH. ISBN 978-0-471-18583-3.
- ^ a b c d e f g Kolisek M, Zsurka G, Samaj J, Weghuber J, Schweyen RJ, Schweigel M (Mar 2003). "Mrs2p is an essential component of the major electrophoretic Mg2+ influx system in mitochondria". The EMBO Journal. 22 (6): 1235–44. doi:10.1093/emboj/cdg122. PMC 151051. PMID 12628916.
- ^ a b c d e Froschauer EM, Kolisek M, Dieterich F, Schweigel M, Schweyen RJ (Aug 2004). "Fluorescence measurements of free [Mg2+] by use of mag-fura 2 in Salmonella enterica". FEMS Microbiology Letters. 237 (1): 49–55. doi:10.1016/j.femsle.2004.06.013. PMID 15268937.
- ^ Lusk JE, Williams RJ, Kennedy EP (May 1968). "Magnesium and the growth of Escherichia coli". The Journal of Biological Chemistry. 243 (10): 2618–24. doi:10.1016/S0021-9258(18)93417-4. PMID 4968384.
- ^ a b Lusk JE, Kennedy EP (Mar 1969). "Magneisum transport in Escherichia coli". The Journal of Biological Chemistry. 244 (6): 1653–5. doi:10.1016/S0021-9258(18)91809-0. PMID 4886311.
- ^ Silver S (Mar 1969). "Active transport of magnesium in escherichia coli". Proceedings of the National Academy of Sciences of the United States of America. 62 (3): 764–71. Bibcode:1969PNAS...62..764S. doi:10.1073/pnas.62.3.764. PMC 223664. PMID 4895213.
- ^ a b Nelson DL, Kennedy EP (May 1971). "Magnesium transport in Escherichia coli. Inhibition by cobaltous ion". The Journal of Biological Chemistry. 246 (9): 3042–9. doi:10.1016/S0021-9258(18)62288-4. PMID 4928897.
- ^ Webb, M. (1970). "Interrelationships between the utilization of magnesium and the uptake of other bivalent cations by bacteria". Biochimica et Biophysica Acta (BBA) - General Subjects. 222 (2): 428–440. doi:10.1016/0304-4165(70)90133-9. PMID 4992522.
- ^ a b c Nelson DL, Kennedy EP (May 1972). "Transport of magnesium by a repressible and a nonrepressible system in Escherichia coli". Proceedings of the National Academy of Sciences of the United States of America. 69 (5): 1091–3. Bibcode:1972PNAS...69.1091N. doi:10.1073/pnas.69.5.1091. PMC 426636. PMID 4556454.
- ^ a b c Park MH, Wong BB, Lusk JE (Jun 1976). "Mutants in three genes affecting transport of magnesium in Escherichia coli: genetics and physiology". Journal of Bacteriology. 126 (3): 1096–103. doi:10.1128/JB.126.3.1096-1103.1976. PMC 233130. PMID 780341.
- ^ Smith RL, Maguire ME (Mar 1995). "Distribution of the CorA Mg2+ transport system in gram-negative bacteria". Journal of Bacteriology. 177 (6): 1638–40. doi:10.1128/jb.177.6.1638-1640.1995. PMC 176786. PMID 7883724.
- ^ a b Kehres DG, Lawyer CH, Maguire ME (1998). "The CorA magnesium transporter gene family". Microbial & Comparative Genomics. 3 (3): 151–69. doi:10.1089/omi.1.1998.3.151. PMID 9775386.
- ^ a b c d Chamnongpol S, Groisman EA (Apr 2002). "Mg2+ homeostasis and avoidance of metal toxicity". Molecular Microbiology. 44 (2): 561–71. doi:10.1046/j.1365-2958.2002.02917.x. PMID 11972791. S2CID 23345853.
- ^ a b Groisman EA (Mar 2001). "The pleiotropic two-component regulatory system PhoP-PhoQ". Journal of Bacteriology. 183 (6): 1835–42. doi:10.1128/JB.183.6.1835-1842.2001. PMC 95077. PMID 11222580.
- ^ Papp KM, Maguire ME (Nov 2004). "The CorA Mg2+ transporter does not transport Fe2+". Journal of Bacteriology. 186 (22): 7653–8. doi:10.1128/JB.186.22.7653-7658.2004. PMC 524906. PMID 15516579.
- ^ Smith RL, Banks JL, Snavely MD, Maguire ME (Jul 1993). "Sequence and topology of the CorA magnesium transport systems of Salmonella typhimurium and Escherichia coli. Identification of a new class of transport protein". The Journal of Biological Chemistry. 268 (19): 14071–80. doi:10.1016/S0021-9258(19)85210-9. PMID 8314774.
- ^ Warren MA, Kucharski LM, Veenstra A, Shi L, Grulich PF, Maguire ME (Jul 2004). "The CorA Mg2+ transporter is a homotetramer". Journal of Bacteriology. 186 (14): 4605–12. doi:10.1128/JB.186.14.4605-4612.2004. PMC 438605. PMID 15231793.
- ^ a b c Smith RL, Szegedy MA, Kucharski LM, Walker C, Wiet RM, Redpath A, Kaczmarek MT, Maguire ME (Oct 1998). "The CorA Mg2+ transport protein of Salmonella typhimurium. Mutagenesis of conserved residues in the third membrane domain identifies a Mg2+ pore". The Journal of Biological Chemistry. 273 (44): 28663–9. doi:10.1074/jbc.273.44.28663. PMID 9786860.
- ^ Szegedy MA, Maguire ME (Dec 1999). "The CorA Mg(2+) transport protein of Salmonella typhimurium. Mutagenesis of conserved residues in the second membrane domain". The Journal of Biological Chemistry. 274 (52): 36973–9. doi:10.1074/jbc.274.52.36973. PMID 10601252.
- ^ a b c Hmiel SP, Snavely MD, Florer JB, Maguire ME, Miller CG (Sep 1989). "Magnesium transport in Salmonella typhimurium: genetic characterization and cloning of three magnesium transport loci". Journal of Bacteriology. 171 (9): 4742–51. doi:10.1128/jb.171.9.4742-4751.1989. PMC 210275. PMID 2548998.
- ^ a b c Gibson MM, Bagga DA, Miller CG, Maguire ME (Nov 1991). "Magnesium transport in Salmonella typhimurium: the influence of new mutations conferring Co2+ resistance on the CorA Mg2+ transport system". Molecular Microbiology. 5 (11): 2753–62. doi:10.1111/j.1365-2958.1991.tb01984.x. PMID 1779764. S2CID 25464328.
- ^ Smith R, Maguire M (1995). "Genetics and molecular biology of magnesium transport systems". In Cowan J (ed.). The Biological Chemistry of Magnesium. New York: VCH. pp. 211–234. ISBN 978-0-471-18583-3.
- ^ a b c Kucharski LM, Lubbe WJ, Maguire ME (Jun 2000). "Cation hexaammines are selective and potent inhibitors of the CorA magnesium transport system". The Journal of Biological Chemistry. 275 (22): 16767–73. doi:10.1074/jbc.M001507200. PMID 10748031.
- ^ Smith RL, Kaczmarek MT, Kucharski LM, Maguire ME (Jul 1998). "Magnesium transport in Salmonella typhimurium: regulation of mgtA and mgtCB during invasion of epithelial and macrophage cells". Microbiology. 144 (7): 1835–43. doi:10.1099/00221287-144-7-1835. PMID 9695916.
- ^ Moncrief MB, Maguire ME (Oct 1999). "Magnesium transport in prokaryotes". Journal of Biological Inorganic Chemistry. 4 (5): 523–7. doi:10.1007/s007750050374. PMID 10550680. S2CID 25825329.
- ^ a b Tao T, Snavely MD, Farr SG, Maguire ME (May 1995). "Magnesium transport in Salmonella typhimurium: mgtA encodes a P-type ATPase and is regulated by Mg2+ in a manner similar to that of the mgtB P-type ATPase". Journal of Bacteriology. 177 (10): 2654–62. doi:10.1128/jb.177.10.2654-2662.1995. PMC 176934. PMID 7751273.
- ^ Blanc-Potard AB, Groisman EA (Sep 1997). "The Salmonella selC locus contains a pathogenicity island mediating intramacrophage survival". The EMBO Journal. 16 (17): 5376–85. doi:10.1093/emboj/16.17.5376. PMC 1170169. PMID 9311997.
- ^ Smith DL, Tao T, Maguire ME (Oct 1993). "Membrane topology of a P-type ATPase. The MgtB magnesium transport protein of Salmonella typhimurium". The Journal of Biological Chemistry. 268 (30): 22469–79. doi:10.1016/S0021-9258(18)41553-0. PMID 8226755.
- ^ Kehres DG, Maguire ME (Sep 2002). "Structure, properties and regulation of magnesium transport proteins". Biometals. 15 (3): 261–70. doi:10.1023/A:1016078832697. PMID 12206392. S2CID 30291849.
- ^ Hattori M, Iwase N, Furuya N, Tanaka Y, Tsukazaki T, Ishitani R, Maguire ME, Ito K, Maturana A, Nureki O (Nov 2009). "Mg(2+)-dependent gating of bacterial MgtE channel underlies Mg(2+) homeostasis". The EMBO Journal. 28 (22): 3602–12. doi:10.1038/emboj.2009.288. PMC 2782099. PMID 19798051.
- ^ Barrick JE, Corbino KA, Winkler WC, Nahvi A, Mandal M, Collins J, Lee M, Roth A, Sudarsan N, Jona I, Wickiser JK, Breaker RR (Apr 2004). "New RNA motifs suggest an expanded scope for riboswitches in bacterial genetic control". Proceedings of the National Academy of Sciences of the United States of America. 101 (17): 6421–6. Bibcode:2004PNAS..101.6421B. doi:10.1073/pnas.0308014101. PMC 404060. PMID 15096624.
- ^ Ponting CP (Mar 1997). "CBS domains in CIC chloride channels implicated in myotonia and nephrolithiasis (kidney stones)". Journal of Molecular Medicine. 75 (3): 160–3. PMID 9106071.
- ^ Hattori M, Tanaka Y, Fukai S, Ishitani R, Nureki O (2007). "Crystal structure of the MgtE Mg2+ transporter". Nature. 448 (7157): 1072–1075. Bibcode:2007Natur.448.1072H. doi:10.1038/nature06093. PMID 17700703. S2CID 4396170.
- ^ Rothstein A, Hayes A, Jennings D, Hooper D (Jan 1958). "The active transport of Mg++ and Mn++ into the yeast cell". The Journal of General Physiology. 41 (3): 585–94. CiteSeerX 10.1.1.283.3914. doi:10.1085/jgp.41.3.585. PMC 2194844. PMID 13491823.
- ^ a b Fuhrmann GF, Rothstein A (Nov 1968). "The transport of Zn2+, Co2+ and Ni2+ into yeast cells". Biochimica et Biophysica Acta (BBA) - Biomembranes. 163 (3): 325–30. doi:10.1016/0005-2736(68)90117-X. PMID 5721896.
- ^ a b Norris P, Kelly, D.P. (1977). "Accumulation of cadmium and cobalt by Saccharomyces cerevisiae". Journal of General Microbiology. 99 (2): 317–324. doi:10.1099/00221287-99-2-317.
- ^ Okorokov LA, Lichko LP, Kadomtseva VM, Kholodenko VP, Titovsky VT, Kulaev IS (May 1977). "Energy-dependent transport of manganese into yeast cells and distribution of accumulated ions". European Journal of Biochemistry. 75 (2): 373–7. doi:10.1111/j.1432-1033.1977.tb11538.x. PMID 328273.
- ^ Conklin DS, Kung C, Culbertson MR (Apr 1993). "The COT2 gene is required for glucose-dependent divalent cation transport in Saccharomyces cerevisiae". Molecular and Cellular Biology. 13 (4): 2041–9. doi:10.1128/mcb.13.4.2041. PMC 359525. PMID 8455597.
- ^ a b c Lee JM, Gardner RC (Jan 2006). "Residues of the yeast ALR1 protein that are critical for magnesium uptake". Current Genetics. 49 (1): 7–20. doi:10.1007/s00294-005-0037-y. PMID 16328501. S2CID 29578323.
- ^ a b c d Graschopf A, Stadler JA, Hoellerer MK, Eder S, Sieghardt M, Kohlwein SD, Schweyen RJ (May 2001). "The yeast plasma membrane protein Alr1 controls Mg2+ homeostasis and is subject to Mg2+-dependent control of its synthesis and degradation". The Journal of Biological Chemistry. 276 (19): 16216–22. doi:10.1074/jbc.M101504200. PMID 11279208.
- ^ a b c d e Lim PH, Pisat NP, Gadhia N, Pandey A, Donovan FX, Stein L, Salt DE, Eide DJ, MacDiarmid CW (2011). "Regulation of Alr1 Mg transporter activity by intracellular magnesium". PLOS ONE. 6 (6): e20896. Bibcode:2011PLoSO...620896L. doi:10.1371/journal.pone.0020896. PMC 3125163. PMID 21738593.
- ^ a b Liu GJ, Martin DK, Gardner RC, Ryan PR (Aug 2002). "Large Mg(2+)-dependent currents are associated with the increased expression of ALR1 in Saccharomyces cerevisiae". FEMS Microbiology Letters. 213 (2): 231–7. doi:10.1111/j.1574-6968.2002.tb11311.x. PMID 12167543.
- ^ Zhang A, Cheng TP, Wu XY, Altura BT, Altura BM (Jan 1997). "Extracellular Mg2+ regulates intracellular Mg2+ and its subcellular compartmentation in fission yeast, Schizosaccharomyces pombe". Cellular and Molecular Life Sciences. 53 (1): 69–72. doi:10.1007/PL00000581. PMID 9117998. S2CID 21460552.
- ^ Pisat NP, Pandey A, Macdiarmid CW (Nov 2009). "MNR2 regulates intracellular magnesium storage in Saccharomyces cerevisiae". Genetics. 183 (3): 873–84. doi:10.1534/genetics.109.106419. PMC 2778983. PMID 19720860.
- ^ Koll H, Schmidt C, Wiesenberger G, Schmelzer C (1987). "Three nuclear genes suppress a yeast mitochondrial splice defect when present in high copy number". Current Genetics. 12 (7): 503–9. doi:10.1007/BF00419559. PMID 2452028. S2CID 38971326.
- ^ Wiesenberger G, Waldherr M, Schweyen RJ (Apr 1992). "The nuclear gene MRS2 is essential for the excision of group II introns from yeast mitochondrial transcripts in vivo". The Journal of Biological Chemistry. 267 (10): 6963–9. doi:10.1016/S0021-9258(19)50522-1. PMID 1551905.
- ^ a b c d e Gregan J, Bui DM, Pillich R, Fink M, Zsurka G, Schweyen RJ (Feb 2001). "The mitochondrial inner membrane protein Lpe10p, a homologue of Mrs2p, is essential for magnesium homeostasis and group II intron splicing in yeast". Molecular & General Genetics. 264 (6): 773–81. doi:10.1007/s004380000366. PMID 11254124. S2CID 490016.
- ^ Gregan J, Kolisek M, Schweyen RJ (Sep 2001). "Mitochondrial Mg(2+) homeostasis is critical for group II intron splicing in vivo". Genes & Development. 15 (17): 2229–37. doi:10.1101/gad.201301. PMC 312778. PMID 11544180.
- ^ Preston RR (Oct 1990). "A magnesium current in Paramecium". Science. 250 (4978): 285–8. Bibcode:1990Sci...250..285P. doi:10.1126/science.2218533. PMID 2218533.
- ^ Preston RR, Kung C (May 1994). "Inhibition of Mg2+ current by single-gene mutation in Paramecium". The Journal of Membrane Biology. 139 (3): 203–13. doi:10.1007/bf00232624. PMID 7538166. S2CID 29747892.
- ^ Preston RR, Kung C (Jul 1994). "Isolation and characterization of paramecium mutants defective in their response to magnesium". Genetics. 137 (3): 759–69. doi:10.1093/genetics/137.3.759. PMC 1206036. PMID 8088522.
- ^ a b Preston RR (Jul 1998). "Transmembrane Mg2+ currents and intracellular free Mg2+ concentration in Paramecium tetraurelia". The Journal of Membrane Biology. 164 (1): 11–24. doi:10.1007/s002329900389. PMID 9636240. S2CID 919015.
- ^ a b Quednau BD, Nicoll DA, Philipson KD (Feb 2004). "The sodium/calcium exchanger family-SLC8". Pflügers Archiv. 447 (5): 543–8. doi:10.1007/s00424-003-1065-4. PMID 12734757. S2CID 26502273.
- ^ Schnetkamp PP (Feb 2004). "The SLC24 Na+/Ca2+-K+ exchanger family: vision and beyond". Pflügers Archiv. 447 (5): 683–8. doi:10.1007/s00424-003-1069-0. PMID 14770312. S2CID 37553960.
- ^ Tusnády GE, Simon I (Oct 1998). "Principles governing amino acid composition of integral membrane proteins: application to topology prediction". Journal of Molecular Biology. 283 (2): 489–506. doi:10.1006/jmbi.1998.2107. PMID 9769220.
- ^ Tusnády GE, Simon I (Sep 2001). "The HMMTOP transmembrane topology prediction server". Bioinformatics. 17 (9): 849–50. doi:10.1093/bioinformatics/17.9.849. PMID 11590105.
- ^ Romani AM, Maguire ME (Sep 2002). "Hormonal regulation of Mg2+ transport and homeostasis in eukaryotic cells". Biometals. 15 (3): 271–83. doi:10.1023/A:1016082900838. PMID 12206393. S2CID 20835803.
- ^ a b Montell C, Birnbaumer L, Flockerzi V (Mar 2002). "The TRP channels, a remarkably functional family". Cell. 108 (5): 595–8. doi:10.1016/S0092-8674(02)00670-0. PMID 11893331. S2CID 18575588.
- ^ a b Montell C (Oct 2003). "Mg2+ homeostasis: the Mg2+nificent TRPM chanzymes". Current Biology. 13 (20): R799–801. doi:10.1016/j.cub.2003.09.048. PMID 14561419. S2CID 15221656.
- ^ Runnels LW, Yue L, Clapham DE (May 2002). "The TRPM7 channel is inactivated by PIP(2) hydrolysis". Nature Cell Biology. 4 (5): 329–36. doi:10.1038/ncb781. PMID 11941371. S2CID 21592843.
- ^ Monteilh-Zoller MK, Hermosura MC, Nadler MJ, Scharenberg AM, Penner R, Fleig A (Jan 2003). "TRPM7 provides an ion channel mechanism for cellular entry of trace metal ions". The Journal of General Physiology. 121 (1): 49–60. doi:10.1085/jgp.20028740. PMC 2217320. PMID 12508053.
- ^ a b Chubanov V, Waldegger S, Mederos y Schnitzler M, Vitzthum H, Sassen MC, Seyberth HW, Konrad M, Gudermann T (Mar 2004). "Disruption of TRPM6/TRPM7 complex formation by a mutation in the TRPM6 gene causes hypomagnesemia with secondary hypocalcemia". Proceedings of the National Academy of Sciences of the United States of America. 101 (9): 2894–9. Bibcode:2004PNAS..101.2894C. doi:10.1073/pnas.0305252101. PMC 365716. PMID 14976260.
- ^ a b Voets T, Nilius B, Hoefs S, van der Kemp AW, Droogmans G, Bindels RJ, Hoenderop JG (Jan 2004). "TRPM6 forms the Mg2+ influx channel involved in intestinal and renal Mg2+ absorption". The Journal of Biological Chemistry. 279 (1): 19–25. doi:10.1074/jbc.M311201200. PMID 14576148.
- ^ Runnels LW, Yue L, Clapham DE (Feb 2001). "TRP-PLIK, a bifunctional protein with kinase and ion channel activities". Science. 291 (5506): 1043–7. Bibcode:2001Sci...291.1043R. doi:10.1126/science.1058519. PMID 11161216. S2CID 30327400.
- ^ Naeem M, Hussain S, Akhtar N (2011). "Mutation in the tight-junction gene claudin 19 (CLDN19) and familial hypomagnesemia, hypercalciuria, nephrocalcinosis (FHHNC) and severe ocular disease". American Journal of Nephrology. 34 (3): 241–8. doi:10.1159/000330854. PMID 21791920.
- ^ Konrad M, Schaller A, Seelow D, Pandey AV, Waldegger S, Lesslauer A, Vitzthum H, Suzuki Y, Luk JM, Becker C, Schlingmann KP, Schmid M, Rodriguez-Soriano J, Ariceta G, Cano F, Enriquez R, Juppner H, Bakkaloglu SA, Hediger MA, Gallati S, Neuhauss SC, Nurnberg P, Weber S (Nov 2006). "Mutations in the tight-junction gene claudin 19 (CLDN19) are associated with renal magnesium wasting, renal failure, and severe ocular involvement". American Journal of Human Genetics. 79 (5): 949–57. doi:10.1086/508617. PMC 1698561. PMID 17033971.
- ^ Di Stefano A, Roinel N, de Rouffignac C, Wittner M (1993). "Transepithelial Ca2+ and Mg2+ transport in the cortical thick ascending limb of Henle's loop of the mouse is a voltage-dependent process". Renal Physiology and Biochemistry. 16 (4): 157–66. doi:10.1159/000173762. PMID 7689239.
- ^ de Rouffignac C, Quamme G (Apr 1994). "Renal magnesium handling and its hormonal control". Physiological Reviews. 74 (2): 305–22. doi:10.1152/physrev.1994.74.2.305. PMID 8171116.
- ^ Weber S, Hoffmann K, Jeck N, Saar K, Boeswald M, Kuwertz-Broeking E, Meij II, Knoers NV, Cochat P, Suláková T, Bonzel KE, Soergel M, Manz F, Schaerer K, Seyberth HW, Reis A, Konrad M (Jun 2000). "Familial hypomagnesaemia with hypercalciuria and nephrocalcinosis maps to chromosome 3q27 and is associated with mutations in the PCLN-1 gene". European Journal of Human Genetics. 8 (6): 414–22. doi:10.1038/sj.ejhg.5200475. PMID 10878661.
- ^ Weber S, Schneider L, Peters M, Misselwitz J, Rönnefarth G, Böswald M, Bonzel KE, Seeman T, Suláková T, Kuwertz-Bröking E, Gregoric A, Palcoux JB, Tasic V, Manz F, Schärer K, Seyberth HW, Konrad M (Sep 2001). "Novel paracellin-1 mutations in 25 families with familial hypomagnesemia with hypercalciuria and nephrocalcinosis". Journal of the American Society of Nephrology. 12 (9): 1872–81. doi:10.1681/ASN.V1291872. PMID 11518780.
- ^ a b Tutone A (2004). Cloning and chararcterisation of the Mg2+ transport gene from A. thaliana (Thesis). School of Biological Sciences (Auckland: University of Auckland).
- ^ Kurkdjian A, Guern, J. (1989). "Intracellular pH: measurement and importance in cell activity". Annual Review of Plant Physiology and Plant Molecular Biology. 40: 271–303. doi:10.1146/annurev.pp.40.060189.001415.
- ^ Marschner H (1995). Mineral Nutrition in Higher Plants. (San Diego: Academic Press).