알로세트론
Alosetron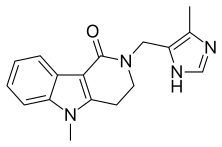 | |
 | |
| 임상 데이터 | |
|---|---|
| 상호 | 로트로넥스 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a601230 |
| 루트 행정부. | 구두(태블릿) |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 |
|
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 50–60% |
| 단백질 결합 | 82% |
| 대사 | 간(CYP2C9, CYP3A4, CYP1A2 포함) |
| 반감기 제거 | 1.5~1.7시간 |
| 배설물 | 신장 73%, 대변 24% |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| 화학 및 물리 데이터 | |
| 공식 | C17H18N4O |
| 몰 질량 | 294.358 g/120−1 |
| 3D 모델(JSmol) | |
| |
| |
| (표준) | |
로트로넥스라는 브랜드명으로 판매되는 알로세트론은 여성들에게만 심한 설사-과민성 대장증후군(IBS)을 관리하기 위해 사용되는 5-HT3 길항제입니다.
그것은 1987년에 특허를 받았으며 [1]2002년에 의료용으로 승인되었다.현재 프로메테우스 연구소(샌디에이고)가 판매하고 있다.알로세트론은 생명을 위협하는 심각한 위장 부작용의 발생으로 2000년 시장에서 철수했지만, 2002년 가용성과 사용이 제한되면서 다시 도입되었다.
의료 용도
알로세트론은 심한 설사-소민성 과민성 대장 증후군(IBS-D)을 가진 여성들에게만 투여된다.
- 만성 IBS 증상(일반적으로 6개월 이상 지속),
- 위장관의 해부학적 또는 생화학적 이상이 제외되었고,
- 전통적인 치료법에 적절하게 반응하지 않았습니다.
중증 IBS-D에는 설사와 다음 중 하나 이상이 포함됩니다.
- 빈번하고 심각한 복통/불안감
- 잦은 장긴급이나 변실금,
- IBS로 [2]인한 일상 활동의 장애 또는 제한.
유효성
승인을 위한 단계 III 시험은 2000년에 업계에서 자금을 지원받은 무작위 플라시보 대조 시험(PCT)으로 발행되었다.저자들은 1mg 알로세트론이 12주 동안 매일 2회 경구 복용 시 12%(CI 4.7-19.2)의 복통 및 설사 전증 [3]환자와 관련된 불쾌감 완화 효과가 있다는 것을 발견했다.알로세트론의 처방은 현재 미국에서 0.5와 [4]1mg으로 승인되었다.
1999년 11월 4일자 FDA Medical Officer's Review는 다음과 같이 지적했다. "설사를 유발하는 아형에 적합하도록 조사자에 의해 고려된 환자들은 기준선에 도달했다.느슨하거나 묽지 않은 변의 일관성 값입니다."[5]FDA의 위장약 자문위원회는 이 약의 효능을 "최소한"이라고 언급하면서 위약이 여성의 [4]40-50%에게 주요 결과 측정치를 완화시켰다고 강조했다.
금지 사항
Lotronex의 처방 정보 브로셔에는 알로세트론을 변비 환자에게 투여해서는 안 된다고 명시되어 있다.기타 금기사항은 만성 또는 중증 변비 또는 변비의 후유증, 장폐색, 협착, 독성 메가콜론, 위장 천공 및/또는 유착, 허혈성 대장염, 장순환 장애, 혈전성 대장염 또는 고응고성 상태, 크론병 또는 궤양성 대장염이다.s; 심각한 간 장애.플루복사민의 병용 또한 [2]금지된다.
부작용
알로세트론은 생명을 위협하는 심각한 위장 부작용을 가진 알로세트론의 연관성에 따라 2000년에 철회되었다.허혈성 대장염의 누적 발병률은 1000명 중 2명이고, 변비로 인한 심각한 합병증(폐색, 천공, 충돌, 독성 메가콜론, 2차 대장성 허혈증, 사망)은 1000명 [2]중 1명이었다.1999년 FDA 의료책임자 존 시니어(John Senior)가 수행한 리뷰에 따르면 환자의 27%가 [6]변비를 경험했다고 한다.3단계 임상시험에서는 알로세트론과 플라시보 그룹의 환자 중 각각 30%와 3%에서 변비가 발생했다고 보고했다.그것은 환자들이 연구를 [3]중단하는 가장 중요한 이유로 꼽혔다.
작용 메커니즘
알로세트론은 위장관의 장신경계의 5-HT3 수용체에 대해 길항제 작용을 한다.온단세트론과 같은 5-HT3 길항제이지만 구토제로 분류되거나 승인되지 않았다.5-HT3 수용체의 자극은 위장 운동성과 양의 상관관계가 있기 때문에 알로세트론의 5-HT3 길항작용은 대장을 통한 분변 물질의 이동을 느리게 하여 수분 흡수 정도를 증가시키고 나머지 [2]노폐물의 수분과 부피를 감소시킨다.
역사
알로세트론은 7개월간의 [8]검토 끝에 2000년 [7]2월 9일 미국 식품의약국(FDA)의 승인을 받았다.최초 승인 당시 미국 식품의약국(FDA)의 검토자들은 알로세트론이 [9]환자의 10-20%에서 증상을 개선한다는 것을 발견했다.
약국 출하는 2000년 3월에 시작되었습니다.7월 17일, 한 건강 전문가가 장간막 허혈로 고생한 50세 여성의 죽음에 대한 보고서를 FDA에 제출했다.보고서는 알로세트론을 이번 [6]사망의 '주요 용의자'로 지목했다.
알로세트론은 5명의 사망자와 추가적인 장 [8]수술을 포함한 심각한 위장관 부작용의 발생으로 인해 2000년 11월 28일 글락소 웰컴에 의해 시장에서 자발적으로 철수되었다.FDA는 허혈성 대장염 49건과 심각한 변비 21건이 보고됐으며 70명 중 10명은 수술을 받았고 34명은 병원에서 검사를 받고 수술을 받지 않고 퇴원했다고 밝혔다.2000년 11월 17일까지 약사들은 알로세트론을 [8]474,115개 처방했다.심각한 부작용은 계속 보고되었으며, 최종 총 84건의 허혈성 대장염, 113건의 심각한 변비, 143건의 입원, 7명의 [10]사망자가 발생했다.
환자 옹호 단체, 특히 Lotronex Action Group과 International Foundation for Functional Disorders(IFFGD)는 이 약물의 반환을 위해 로비를 벌였다.또 다른 환자 옹호 단체인 Public Citizen Health Research Group은 재도입에 [11][4]반대했다.
2002년 6월 7일 FDA는 Lotronex(염산알로세트론)의 제한된 판매를 허용하는 보충 신약 애플리케이션(sNDA)의 승인을 발표했다. 이는 심각한 설사-선발성 과민성 대장 증후군(IBS)[2][12][13]을 가진 여성만 치료하기 위한 것이다.2002년에 처음 도입된 엄격한 처방 가이드라인은 2016년에 다소 완화되어 전자처방이 가능해졌다.
알로세트론이 EU에 등록을 신청했는지 여부는 알려지지 않았다.
GSK는 2007년 [14]말 로트로넥스를 캘리포니아 주식회사 프로메테우스에 매각했다.
2015년 이후 미국에서는 일반 버전의 알로세트론이 판매되고 있으며, Actavis Pharma Company, Prometheus Laboratories 및 Sebela Pharmacuticals Inc.를 포함한 여러 회사가 판매하고 있습니다.
FDA에 대한 비판
2001년, 유명한 의학 저널 "랜싯"의 편집자인 리차드 호튼은 FDA의 알로세트론 취급을 이례적으로 날카로운 [15]언어로 비판했다.Horton은 치명적이지 않은 상태의 치료는 잠재적으로 치명적인 부작용을 가진 약물의 사용을 정당화하지 않으며, 시판 후 감시를 통해 많은 환자들이 수술적 개입과 허혈성 대장염을 필요로 하는 변비를 겪었다는 것이 밝혀졌을 때 FDA는 알로세트론의 승인을 더 빨리 취소했어야 했다고 주장했다.그는 FDA 관계자들이 의약품 제조사가 지불한 사용자 요금으로 FDA의 의약품 평가 연구 센터가 자금을 지원받기 때문에 알로세트론 승인을 유지하고 복원하도록 부적절하게 동기를 부여받았으며 알로세트론의 복원은 대표자들과의 비밀 회의로 협상되었다고 주장했다.글락소스미스클라인의 아이브스
영국 의학 저널(BMJ)에 실린 한 기사는 "자체 조건에 따라 심각하고 중대한 공중 보건 문제를 제기하는 약인 알로세트론의 판매를 허용함으로써 FDA는 [16]임무에 실패했다"고 지적했다.다른 사람들은 Lotronex의 승인 과정이 규제 [4]포기의 한 예라고 주장했다.
레퍼런스
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 448. ISBN 9783527607495.
- ^ a b c d e "Lotronex (alosetron hydrochloride) Tablets. Full Prescribing Information" (PDF). Prometheus Laboratories Inc., 9410 Carroll Park Drive, San Diego, CA 92121. Archived from the original (PDF) on 22 February 2016. Retrieved 14 February 2016.
- ^ a b Camilleri M, Northcutt AR, Kong S, Dukes GE, McSorley D, Mangel AW (March 2000). "Efficacy and safety of alosetron in women with irritable bowel syndrome: a randomised, placebo-controlled trial". Lancet. 355 (9209): 1035–40. doi:10.1016/S0140-6736(00)02033-X. PMID 10744088. S2CID 31290668.
- ^ a b c d Moynihan R (September 2002). "Alosetron: a case study in regulatory capture, or a victory for patients' rights?". BMJ. 325 (7364): 592–5. doi:10.1136/bmj.325.7364.592. PMC 1124108. PMID 12228140.
- ^ Barbehenn E, Lurie P, Wolfe SM (December 2000). "Alosetron for irritable bowel syndrome". Lancet. 356 (9246): 2009–10. doi:10.1016/S0140-6736(05)72978-0. PMID 11130544. S2CID 30340322.
- ^ a b Willman D (2 November 2000). "FDA Minimized Issue of Lotronex's Safety". The Los Angeles Times. Retrieved 11 December 2012.
- ^ U.S. Food and Drug Administration. "Drug Details". Retrieved 11 December 2012.
- ^ a b c Willman D (29 November 2000). "Drug Lotronex Pulled Over Safety Fears". The Los Angeles Times. Retrieved 11 December 2012.
- ^ Willman D (20 December 2000). "Officer Foresaw Deadly Effects". The Los Angeles Times. Retrieved 11 December 2012.
- ^ Center for Drug Evaluation and Research (23 April 2002). "Gastrointestinal Drugs Advisory Committee and Drug Safety and Risk Management Subcommittee of the Advisory Committee for Pharmaceutical Science" (PDF). U.S. Food and Drug Administration. Retrieved 11 December 2012.
- ^ Grady D (23 April 2002). "Appeals Prompt U.S. Agency to Consider Allowing Sales of Diarrhea Drug Linked to Deaths". The New York Times. Retrieved 11 December 2012.
- ^ Pollack A (2006-03-09). "F.D.A. Panel Recommends M.S. Drug Despite Lethal Risk". The New York Times. Retrieved 2008-03-13.
- ^ Grady D (8 June 2002). "U.S. Lets Drug Tied to Deaths Back on Market". The New York Times. Retrieved 11 December 2012.
- ^ 프로메테우스 연구소2007년 11월 7일 프레스 릴리즈2012-07-14 아카이브.오늘 2008년 8월 27일에 취득.
- ^ Horton R (May 2001). "Lotronex and the FDA: a fatal erosion of integrity". Lancet. 357 (9268): 1544–5. doi:10.1016/S0140-6736(00)04776-0. PMID 11377636. S2CID 10886502.
- ^ Lièvre M (September 2002). "Alosetron for irritable bowel syndrome". BMJ. 325 (7364): 555–6. doi:10.1136/bmj.325.7364.555. PMC 1124090. PMID 12228116.


