가져오기
Importin| 카리오페린 서브 유닛 알파 1 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | KPNA1 | ||||||
| 엔씨비유전자 | 3836 | ||||||
| HGNC | 6394 | ||||||
| 오밈 | 600686 | ||||||
| RefSeq | NP_002255 | ||||||
| 유니프로트 | P52294 | ||||||
| 기타자료 | |||||||
| 로커스 | 3번 씨 Q21.1 | ||||||
| |||||||
| 카리오페린 서브유닛 베타 1 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | KPNB1 | ||||||
| 엔씨비유전자 | 3837 | ||||||
| HGNC | 6400 | ||||||
| 오밈 | 602738 | ||||||
| RefSeq | NP_002256 | ||||||
| 유니프로트 | Q14974 | ||||||
| 기타자료 | |||||||
| 로커스 | 17번 씨 Q21.32 | ||||||
| |||||||
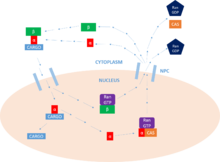
임베렉틴은 세포의 세포질에서 핵으로 단백질 분자를 운반하는 카리오페린의[1] 일종이다. 그것은 핵 국산화 시퀀스(NLS)라고 불리는 특정 인식 시퀀스에 결합함으로써 그렇게 한다.
임포린은 두 개의 서브유닛, 즉 임포틴 α와 임포틴 β를 가지고 있다. 수입-β 계열의 구성원은 스스로 화물을 묶고 운송할 수 있으며, 수입-α로 이단체를 형성할 수 있다. 이단계의 일부로서 임베딘-β는 모공 복합체와의 상호작용을 매개하는 반면, 임베딘-α는 화물에 대한 핵 국산화 신호(NLS)를 결합하는 어댑터 단백질 역할을 한다. NLS-Importin α-Importin β 트리머는 핵 안에 있는 Ran GTP에 결합한 후 분리되며,[2] 두 개의 임포틴 단백질이 세포질에 재활용되어 추가 사용을 위해 사용된다.
디스커버리
임포틴은 임포틴-α/β의 이질체 또는 임포틴-β의 모노머로 존재할 수 있다. 임베린α는 1994년 막스 델브뤼크 분자의학 센터에 근거지를 둔 엔노 하트만을 포함한 그룹에 의해 처음 격리되었다.[1] 핵단백질 수입과정은 이미 이전의 검토에서 특징지어졌지만,[3] 관련된 핵심 단백질은 그 시점까지 해명되지 않았다. 단백질을 핵으로 수입하는 데 필수적이며, SRP1p에 대한 44% 시퀀스 아이덴티티를 가진 60kDa 세포질 단백질이 제노푸스 알에서 정제되었다. 복제, 배열, E.coli로 표현되었으며 신호 의존적 전송을 완전히 재구성하기 위해서는 Ran(TC4)과 결합해야 했다. 다른 주요 자극 요인도 연구에서 발견되었다.[1]
임포틴-β는 임포틴-α와 달리 효모에 직접적인 호몰로겐 없지만, 90-95 kDa 단백질로 정제되어 여러 가지 다른 경우에서 임포틴-α로 이단체를 형성하는 것을 발견했다. 여기에는 마이클 렉사흐가[4] 주도한 연구와 더크 괴를리히의 추가 연구가 포함되었다.[5] 이들 집단은 임포틴α가 기능하기 위해서는 또 다른 단백질인 임포틴-β가 필요하며, 함께 핵 국산화 신호(NLS)의 수용체를 형성하여 핵으로의 이동을 허용한다는 것을 발견했다. 1994년과 1995년에 이러한 초기 발견 이후, IPO4와 IPO7과 같은 다수의 임페린 유전자가 구조와 지역성이 다르기 때문에 약간 다른 화물 단백질의 수입을 용이하게 하는 것이 발견되었다.
구조
임베린α
수입산-α 어댑터 단백질의 많은 비율은 여러 아르마딜로 반복(ARM)으로 이루어져 있다. 이러한 반복은 함께 쌓여서 곡선 형태의 구조를 형성할 수 있으며, 이는 특정 화물 단백질의 NLS에 결합하는 것을 용이하게 한다. 주요 NLS 바인딩 사이트는 N-terminus를 향해 발견되며, C-terminus에서 마이너 사이트가 발견된다. ARM 구조뿐만 아니라 Importin-α는 또한 90개의 아미노산 N-단자 영역을 포함하며, Importin-β 바인딩(IBB) 도메인으로 알려진 Importin-β에 바인딩을 담당한다.[6] 이곳은 또한 자동침입의 현장이며,[7] 수입 α가 핵에 도달하면 화물을 방출하는 것과 관련이 있다.[8]
임베린-β
수입-β는 카리오페린 계열의 대형 슈퍼패밀리의 전형적인 구조물이다. 구조물의 기본은 HEAT 모티브의 18-20 tandem 반복이다. 이러한 반복은 각각 턴에 의해 연결된 두 개의 항타렐 알파 나선형을 포함하고 있는데, 이 나선은 함께 쌓여서 단백질의 전체적인 구조를 형성한다.[9]
핵으로 화물을 운반하기 위해서는 반드시 수입-β가 핵 모공 복합체와 연관되어야 한다. 다양한 FG(Phe-Gly) 모티브에 뉴클레오폴린과 약하고 일시적인 결합을 형성하여 이를 실현한다. 결정학적 분석은 이러한 모티브가 표면에서 발견되는 얕은 소수성 주머니에서 수입-β에 결합한다는 것을 보여주었다.[10]
핵단백질수입주기
임포틴의 1차적인 기능은 핵단백질 수입주기라고 알려진 과정에서 핵공기복합체(NPC)를 통해 핵으로 핵 국산화 신호를 가진 단백질의 변환을 중재하는 것이다.
화물 바인딩
이 주기의 첫 번째 단계는 화물의 결합이다. 임포린은 단층 임포틴-β 단백질로서 이 기능을 수행할 수 있지만, 일반적으로 (NLS와의 상호작용을 통해) 화물 단백질에 대한 어댑터 역할을 하는 임포틴-α의 존재가 필요하다. NLS는 단백질을 핵으로 향하는 화물로 분류하는 일련의 기본 아미노산이다. 화물 단백질은 이러한 모티브 중 하나 또는 두 개를 포함할 수 있으며, 이는 수입 α의 주요 및/또는 사소한 결합 사이트에 바인딩된다.[11]
화물운송
일단 화물 단백질이 결합되면, importin-β는 NPC와 상호작용하고, 복합체는 세포질에서 핵으로 확산된다. 확산 속도는 세포질 내에 존재하는 수입 α의 농도와 화물에 대한 수입 α의 결합 친화력에 따라 달라진다. 일단 핵 안에 들어가면 복합체는 Ras-family GTPase, Ran-GTP와 상호작용한다. 이는 임포틴-β의 순응을 변경하여 복합체의 분리를 유도한다. Importin-β는 Ran-GTP에 바인딩되어 재활용이 준비된다.[11]
화물해제
이제 수입-α/카고 콤플렉스에 수입-β가 없기 때문에 화물 단백질을 핵으로 방출할 수 있다. importin-α의 N-terminal importin-β-binding(IBB) 영역에는 NLS 모티브를 모방한 자동 규제 영역이 포함되어 있다. [7] importin-β의 방출을 통해 이 지역을 자유롭게 하고, 다시 순환하여 주요 NLS 결합 현장에서 화물 단백질과의 결합을 위해 경쟁할 수 있다. 이 경쟁은 단백질의 방출로 이어진다. 경우에 따라서는 Nup2나 Nup50과 같은 구체적인 방출 인자를 채용하여 화물의 출하를 도울 수도 있다.[11]
재활용
마지막으로 세포질로 돌아가기 위해서는 negin-α가 핵에서 빠져나오는 것을 용이하게 하는 Ran-GTP/CAS(핵 수출 인자) 복합체와 연관되어야 한다. CAS(cellular apoptosis susceptibility prote)는 카리오페린의 수입-β 슈퍼 패밀리의 일부로서 핵 수출 인자로 정의된다. Importin-β는 여전히 Ran-GTP에 묶여 있는 세포질로 되돌아간다. 일단 세포질 속에 들어가면, Ran-GTP는 Ran-GAP에 의해 가수 분해되어 Ran-GDP를 형성하고, 추가적인 활동을 위해 두 개의 임포틴을 방출한다. 사이클 전체를 위한 에너지를 제공하는 것은 GTP의 이러한 가수분해다. 핵에서 GEF는 Ran을 GTP 분자로 충전할 것이며, 이 분자는 위에서 설명한 바와 같이 세포질 내의 GAP에 의해 가수 분해된다. 단방향으로 단백질을 운반할 수 있게 하는 것이 바로 란의 이러한 활동이다.[11]
병
importin-α 및 importin-β의 돌연변이 또는 표현상의 변화와 관련된 여러 질병 상태와 병리학이 있다.
임베린은 생식 발생과 발생 발생 과정에서 필수적인 조절 단백질이다. 그 결과, 수입 α의 표현 패턴이 흐트러지면서 드로소필라 멜라노가스터에 생식력 결함을 일으키는 것으로 나타났다.[12]
변경된 수입-α를 일부 암 사례와 연관시키는 연구도 있다. 유방암 연구는 NLS 결합 영역이 없는 잘린 형태의 수입-α와 관련이 있다.[13] 또한, 수입-α는 종양 억제 유전자 BRCA1(최소암 타입 1 수용성 단백질)을 핵으로 운반하는 것으로 나타났다. 수입 α의 과도한 압박은 또한 특정 흑색종 환자에서 볼 수 있는 낮은 생존율과 관련이 있다.[14]
임포틴 활동은 또한 몇몇 바이러스 병리학과도 연관되어 있다. 예를 들어 에볼라 바이러스의 감염 경로에서 핵심 단계는 PY-STAT1의 핵 수입 억제다. 이것은 바이러스가 세포질에서 수입 α를 분리함으로써 달성되는데, 이것은 그것이 더 이상 NLS에서 화물을 묶을 수 없다는 것을 의미한다.[15] 결과적으로, 임베린은 기능을 할 수 없고 화물 단백질은 세포질 내에 머무른다.
화물의 종류
많은 다른 화물 단백질들은 수입에 의해 핵으로 운반될 수 있다. 흔히 서로 다른 단백질은 번역하기 위해 α와 β의 다른 조합을 필요로 한다. 다른 화물의 몇 가지 예는 아래에 열거되어 있다.
| 화물 | 수신기 가져오기 |
|---|---|
| SV40 | 가져오기in-β 및 가져오기in-α |
| 뉴클레오플라스민 | 가져오기in-β 및 가져오기in-α |
| STAT1 | Importin-β 및 NPI-1(importin-α의 유형) |
| 티피아 | 가져오기인α가 필요하지 않음 |
| U1A | 가져오기인α가 필요하지 않음 |
인간 임포틴 유전자
임포틴-α와 임포틴-β는 전체적으로 임포틴을 설명하기 위해 사용되지만, 실제로는 유사한 구조와 기능을 공유하는 더 큰 단백질군을 나타낸다. α와 β 모두에 대해 다양한 다른 유전자가 확인되었으며, 그 중 일부는 아래에 열거되어 있다. 종종 카리오페린과 임포틴이 서로 교환하여 사용된다는 점에 유의한다.
- 수입: IPO4, IPO5, IPO7, IPO8, IPO9, IPO11, IPO13
- 카리오페린-α: KPNA1, KPNA2, KPNA3, KPNA4, KPNA5, KPNA6
- 카리오페린-β: KPNB1
참고 항목
참조
- ^ a b c Görlich D, Prehn S, Laskey RA, Hartmann E (December 1994). "Isolation of a protein that is essential for the first step of nuclear protein import". Cell. 79 (5): 767–78. doi:10.1016/0092-8674(94)90067-1. PMID 8001116. S2CID 7539929.
- ^ Mattaj IW, Englmeier L (1998). "Nucleocytoplasmic transport: the soluble phase". Annual Review of Biochemistry. 67: 265–306. doi:10.1146/annurev.biochem.67.1.265. PMID 9759490.
- ^ Garcia-Bustos J, Heitman J, Hall MN (March 1991). "Nuclear protein localization". Biochim. Biophys. Acta. 1071 (1): 83–101. doi:10.1016/0304-4157(91)90013-m. PMID 2004116.
- ^ Enenkel C, Blobel G, Rexach M (July 1995). "Identification of a yeast karyopherin heterodimer that targets import substrate to mammalian nuclear pore complexes". J. Biol. Chem. 270 (28): 16499–502. doi:10.1074/jbc.270.28.16499. PMID 7622450.
- ^ Görlich D, Kostka S, Kraft R, Dingwall C, Laskey RA, Hartmann E, Prehn S (April 1995). "Two different subunits of importin cooperate to recognize nuclear localization signals and bind them to the nuclear envelope". Current Biology. 5 (4): 383–92. doi:10.1016/s0960-9822(95)00079-0. hdl:11858/00-001M-0000-002D-1CBD-2. PMID 7627554. S2CID 6055941.
- ^ Lott K, Cingolani G (September 2011). "The importin β binding domain as a master regulator of nucleocytoplasmic transport". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1813 (9): 1578–92. doi:10.1016/j.bbamcr.2010.10.012. PMC 3037977. PMID 21029753.
- ^ a b Pufall MA, Graves BJ (2002). "Autoinhibitory domains: modular effectors of cellular regulation". Annual Review of Cell and Developmental Biology. 18: 421–62. doi:10.1146/annurev.cellbio.18.031502.133614. PMID 12142282.
- ^ Conti E, Uy M, Leighton L, Blobel G, Kuriyan J (July 1998). "Crystallographic analysis of the recognition of a nuclear localization signal by the nuclear import factor karyopherin alpha". Cell. 94 (2): 193–204. doi:10.1016/s0092-8674(00)81419-1. PMID 9695948. S2CID 16230174.
- ^ Lee SJ, Matsuura Y, Liu SM, Stewart M (June 2005). "Structural basis for nuclear import complex dissociation by RanGTP". Nature. 435 (7042): 693–6. Bibcode:2005Natur.435..693L. doi:10.1038/nature03578. PMID 15864302. S2CID 4304731.
- ^ Bayliss R, Littlewood T, Stewart M (July 2000). "Structural basis for the interaction between FxFG nucleoporin repeats and importin-beta in nuclear trafficking". Cell. 102 (1): 99–108. doi:10.1016/s0092-8674(00)00014-3. PMID 10929717. S2CID 17495979.
- ^ a b c d Weis K (February 2003). "Regulating access to the genome: nucleocytoplasmic transport throughout the cell cycle". Cell. 112 (4): 441–51. doi:10.1016/s0092-8674(03)00082-5. PMID 12600309. S2CID 17664108.
- ^ Terry LJ, Shows EB, Wente SR (November 2007). "Crossing the nuclear envelope: hierarchical regulation of nucleocytoplasmic transport". Science. 318 (5855): 1412–6. Bibcode:2007Sci...318.1412T. doi:10.1126/science.1142204. PMID 18048681. S2CID 163986.
- ^ Kim IS, Kim DH, Han SM, Chin MU, Nam HJ, Cho HP, Choi SY, Song BJ, Kim ER, Bae YS, Moon YH (July 2000). "Truncated form of importin alpha identified in breast cancer cell inhibits nuclear import of p53". The Journal of Biological Chemistry. 275 (30): 23139–45. doi:10.1074/jbc.M909256199. PMID 10930427.
- ^ Winnepenninckx V, Lazar V, Michiels S, Dessen P, Stas M, Alonso SR, Avril MF, Ortiz Romero PL, Robert T, Balacescu O, Eggermont AM, Lenoir G, Sarasin A, Tursz T, van den Oord JJ, Spatz A (April 2006). "Gene expression profiling of primary cutaneous melanoma and clinical outcome". Journal of the National Cancer Institute. 98 (7): 472–82. doi:10.1093/jnci/djj103. PMID 16595783.
- ^ Sekimoto T, Imamoto N, Nakajima K, Hirano T, Yoneda Y (December 1997). "Extracellular signal-dependent nuclear import of Stat1 is mediated by nuclear pore-targeting complex formation with NPI-1, but not Rch1". The EMBO Journal. 16 (23): 7067–77. doi:10.1093/emboj/16.23.7067. PMC 1170309. PMID 9384585.