노레피네프린 트랜스포터
Norepinephrine transporter| SLC6A2 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||||||||||||||||||
| 별칭 | SLC6A2, NAT1, NET, NET, NET1, SLC6A5, 솔루트 캐리어 패밀리 6 멤버 2, 노레피네프린 트랜스포터, 노레피네프린 트랜스포터 유전자 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 163970 MGI: 1270850 호몰로진: 816 GeneCard: SLC6A2 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 위치(UCSC) | Cr 16: 55.66 – 55.71Mb | Chr 8: 92.96 – 93Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
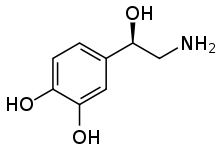
노르아드레날린 트랜스포터(NAT)와 솔루트 캐리어 패밀리 6 멤버 2(SLC6A2)로도 알려진 노레피네프린 트랜스포터(NET)는 인체에서 SLC6A2 유전자에 의해 암호화된 단백질이다.[5]
NET는 모노아민 수송기로 노르아드레날린이라고도 하는 세포외 노레피네프린(NE)의 나트륨-염소화합물(Na+/Cl−) 의존적 재흡수를 담당한다. NET는 또한 세포외 도파민(DA)을 재흡수할 수 있다. 이 두 신경전달물질의 재흡수는 시냅스 구분의 농도를 조절하는데 필수적이다. 다른 모노아민 전달체와 함께 네트는 많은 항우울제와 레크리에이션 약물의 표적이다. 또한, 과도한 NET은 ADHD와 연관되어 있다.[6][7] NET유전자(SLC6A2)의 단일 뉴클레오티드 다형성(single-nucleotide polymorphism)이 이러한 장애의 일부에 근본적인 요인이 될 수 있다는 증거가 있다.[7]
유전자
노레피네프린 트랜스포터 유전자 SLC6A2는 인간 염색체 16 locus 16q12.2에 위치한다. 이 유전자는 14 exons로 암호화되어 있다.[7] NET 트랜스포터는 뉴클레오티드와 아미노산 염기서열을 기반으로 12개의 멤브레인 스패닝 도메인을 가진 617개의 아미노산으로 구성된다. NET의 구조조직은 도파민, 에피네프린, 세로토닌, GABA 전달체 등 신경전달물질 전달체들의 나트륨/염소화합성 계열의 다른 구성원들에게 매우 동질적이다.[7]
단일 뉴클레오티드 다형성
단일 뉴클레오티드 다형성(SNP)은 단일 뉴클레오티드(A, T, C 또는 G)에 의해 게놈 서열이 변형되는 유전적 변화다. 변형된 아미노산 염기서열을 가진 NET 단백질(더 구체적으로는, 오식 돌연변이)은 잠재적으로 NET 기능 변화로 인해 노레피네프린 혈장 수치가 비정상적으로 높거나 낮은 것을 수반하는 다양한 질병과 연관될 수 있다. NET SNP와 다양한 질병과의 가능한 연관성은 많은 연구 프로젝트에서 중점적인 영역이다. NET SNPs와 ADHD[7][8] 정신 질환,[7] 자세 빈맥[7][9], 정형 과민증과 같은 다양한 질환 사이의 관계를 암시하는 증거가 있다.[7][9] SNPs rs3785143 및 rs11568324는 주의력 결핍 과잉행동 장애와 관련이 있다.[10] 그러나 지금까지 SNP와 임상 조건 사이에 확인된 유일한 직접적 연관성은 SNP, Ala457Pro, 정형외과적 과민증이다.[7] 지금까지 13개의 NET 오감 돌연변이가 발견되었다.[7]
| 위치 | 아미노산 변종 | TMD(알고 있는 경우) | 관련 질병 |
|---|---|---|---|
| 엑손 2 | 발69일레 | TMD 1 | 없음 |
| 엑손 3 | 스르99Ile | TMD 2 | 없음 |
| 엑손5길 | 발245Ile | TMD 4 | 없음 |
| 엑손 6 | Asn292Thr | n/a | 없음 |
| 엑손 8 | Val356Leu | n/a | 없음 |
| 엑손 8 | 알라369프로 | n/a | 없음 |
| 엑손 8 | Asn375Ser | n/a | 없음 |
| 엑손 10 | 발449Ile | TMD 9 | 없음 |
| 엑손 10 | 알라457프로 | TMD 9 | 직교성 과민증 |
| 엑손 10 | 리스463아르크 | n/a | 없음 |
| 엑손11길 | 글리478서 | TMD 10 | 없음 |
| 엑손12길 | 페528시스 | n/a | 없음 |
| 엑손13길 | 티르548히스 | n/a | 없음 |
위의 표는 표준 아미노산 약어 표를 참조하십시오. 다음에 대한 이 표기법
돌연변이를 감지하지 못하고 발69를 잡는다.일레(Ile)는 아미노산 발69가 일레(Ile)로 바뀌었음을 나타낸다.
유전적 변이
노르아드레날린(노레피네프린) 수송기의 발현을 감소시키고 결과적으로 노레피네프린의 손상된 뉴런 재흡수의 표현형을 초래하는 후생유전학적 메커니즘(NET 유전자 촉진 부위 내 CpG섬의 하이퍼메틸레이션)이 자세직교정맥증후군과 공황장애 모두에 관여되어 왔다.[12]
구조
노레피네프린 트랜스포터는 12개의 트랜섬브레인 도메인(TMD)으로 구성되어 있다. 세포 내 부분은 아미노(-NH
2) 그룹과 카복실(-COOH) 그룹을 포함한다. 또한 TMD 3과 4 사이에 큰 세포외 루프가 위치한다.[13][6][14] 단백질은 617개의 아미노산으로 구성되어 있다.[13]
함수
시냅스로 방출된 노레피네프린(Norepinephrine)을 전 시냅스 뉴런으로 다시 운반하는 NET 기능. 방출된 노레피네프린의 90%는 NET. NET 기능에 의해 세포에 다시 흡수될 것이다. Na/Cl− (Na+/Cl)의 유입과 노레피네프린 수송을 결합하여. 이것은 1:1:1의 고정 비율에서 발생한다.[15] NET와 도파민 트랜스포터(DAT)는 모두 노레피네프린과 도파민을 운반할 수 있다. 노레피네프린과 도파민의 재흡수는 시냅스 구분의 모노아민 신경전달물질 농도를 조절하는데 필수적이다. 트랜스포터는 또한 사전 시냅스 뉴런의 운동성 균형을 유지하는데 도움을 준다.[16]
노레피네프린(NE)은 CNS와 PNS를 모두 내향적으로 만드는 노라드레날린 뉴런에서 방출된다.노라드레날린(NA)으로도 알려진 NE는 기분, 흥분, 기억, 학습, 통증 지각 조절에 중요한 역할을 한다. NE는 교감신경계의 일부분이다.[6][17] NET에 의한 노레피네프린 제거의 불충분한 규제는 아래에서 논의되는 많은 신경정신과 질환과 관련이 있다. 또한 많은 항우울제와 레크리에이션 약물이 NE와 NE의 결합을 위해 경쟁한다.[13]
운송 메커니즘
노레피네프린을 다시 시냅스 세포로 운반하는 것은 Na와+ Cl과− 함께 cotransport에 의해 가능하다. 이온의 순차적 결합은 결국 노레피네프린 재흡수를 초래한다. Na와+ Cl의− 이온 구배는 이 리웁타케를 활기차게 유리하게 만든다. 구배는 Na+/K+-ATPase에 의해 생성되며, Na+/K+-ATPase는 세 개의 나트륨 이온과 두 개의 칼륨 이온을 세포로 전송한다.[16] NET는 리간드 게이트 이온 채널과 유사한 전도성을 가지고 있다. NET의 표현은 누설 채널 활동을 초래한다.[15][16]
신경계 내 위치
NET는 노라드레날린 뉴런으로 제한되며 도파민이나 에피네프린 등을 방출하는 뉴런에는 존재하지 않는다.[6][14][16] 전달체는 뉴런의 세포체, 액손, 덴드라이트를 따라 발견될 수 있다.[6] NETs는 시냅스로부터 떨어져 있으며, 노레피네프린이 방출된다. 그것들은 세포의 혈장 막에서 더 가까이에서 발견된다. 이를 위해서는 노레피네프린(Norepinephrine)이 재흡수를 위해 트랜스포터로 방출되는 부위에서 분산되어야 한다.[16] 노레피네프린 전달체는 교감계의 뉴런에 국한되며, 부신질, 폐, 태반 등을 내향적으로 하는 전달체들이 있다.[16]
규정
NET 기능 규제는 복잡하고 현재 연구의 초점이다. NET는 세포와 분자 수준의 변환 후 모두에서 조절된다. 가장 잘 이해되는 메커니즘은 두 번째 메신저 단백질 키나아제 C(PKC)에 의한 인산화 작용이 있다.[14] PKC는 플라즈마 막에서 트랜스포터를 분리하여 NET 기능을 억제하는 것으로 나타났다.[18] NET의 아미노산 염기서열은 단백질 키나제 인산화 관련 여러 부위가 나타났다.[16] 변환 후 수정은 NET 함유 베시클과 플라즈마 막의 융합 속도, 트랜스포터 회전율 등 NET의 기능에 광범위한 영향을 미칠 수 있다.[18]
임상적 유의성
직교성 과민증
정교성 과민증(OI)은 서 있을 때 증상이 시작되는 것이 특징인 자율신경계(이형자신의 하위 범주)의 장애다. 증상으로는 피로, 가벼운 머리, 두통, 허약, 심박수/심장 두근거림 증가, 불안, 시력 변화 등이 있다.[7] 흔히 환자는 서 있을 때 교감유출과 관련하여 혈장 노레피네프린(NE) 농도(최소 600pg/ml)가 높은 경우가 많은데, 이는 OI가 초경화성 질환임을 시사한다.[7][9] OI를 앓고 있는 일란성 쌍둥이 자매의 발견은 이 질환의 유전적 근거를 제시하였다.[7][9] NET유전자(SLC6A2)에서 알라닌 잔류물이 전달체의 보존도가 높은 지역에서 프롤라인 잔류물(Ala457Pro)으로 대체된 오감 변이가 발견됐다.[7] 환자의 결함 있는 NET는 야생형 유전자의 활성도가 2%에 불과했다.[7] NET 단백질의 유전적 결함은 OI에서 비정상적으로 높은 NE 혈장 수준을 설명할 수 있는 NET 활성 감소를 초래한다. 그러나 다른 40명의 OI 환자들은 동일한 오감 돌연변이를 가지고 있지 않았으며, 이는 일란성 쌍둥이의 표현형에 다른 요소들이 기여했음을 보여준다.[7] 노레피네프린 재흡수 활성을 감소시키고 정형성 과민증을 초래하는 NET 돌연변이와의 연관성을 발견한 것은 결함이 있는 NE흡수 메커니즘이 심혈관 질환에 기여할 수 있음을 시사한다.[19]
치료 용도
노레피네프린 트랜스포터(NET) 억제는 주의력결핍과잉행동장애(ADHD), 약물 남용, 신경퇴행장애(예: 알츠하이머병(AD)와 파킨슨병(PD) 및 임상우울증 치료에 잠재적 치료적 응용이 있다.[17]
주요 우울증
Certain antidepressant medications act to raise noradrenaline, such as serotonin-norepinephrine reuptake inhibitors (SNRIs), norepinephrine-dopamine reuptake inhibitors (NDRIs), norepinephrine reuptake inhibitors (NRIs or NERIs) and the tricyclic antidepressants (TCAs). 이러한 약물들이 작용하는 메커니즘은 재흡수 억제제가 사전 시냅스 뉴런에 의한 세로토닌과 노르에피네프린 재흡수를 막아 NET의 정상적인 기능을 마비시키는 것이다. 동시에 시냅스에서 5-HT의 높은 레벨이 유지되어 후자의 신경전달물질의 농도를 증가시킨다. 노르아드레날린 트랜스포터가 전두엽 피질의 도파민 간극을 대부분 담당하기 때문에 SNRI도 도파민의 재흡수를 차단해 시냅스에 도파민이 축적된다.[20] 그러나 도파민이 세포 밖으로 운반되는 일차적인 방법인 DAT는 NET가 차단되었을 때 시냅스에서 도파민 농도를 낮추는 작용을 할 수 있다.[21] 여러 해 동안 우울증과 같은 기분장애를 치료하는데 있어서 가장 큰 선택은 데시프라민(노르프라민), 노르트라인(아렌틸, 파멜로), 프로티라인(비박틸), 아목사핀(아센딘)과 같은 TCA의 투여를 통해서였다.[17] 주로 세로토닌을 조절하는 SSRIs는 허용성이 좋고 부작용 발생률이 낮기 때문에 우울증에 대한 주된 치료 옵션으로 트리사이클릭스를 대체했다.[22]
ADHD
ADHD 치료에는 많은 약물이 존재한다. Dextroamphetamine (Dexedrine, Dextrostat), Adderall, methylphenidate (Ritalin, Metadate, Concerta, Daytrana), and lisdexamfetamine (Vyvanse) block reabsorption of the catecholamines dopamine and norepinephrine through monoamine transporters (including NET), thereby increasing levels of these neurotransmitters in the brain. 강력한 선택적 노레피네프린 재흡수 억제제(NRI), 아토모세틴(Strattera)이 미국 식품의약국(FDA)으로부터 성인 ADHD 치료를 승인받았다.[23][24] ADHD에서 NET의 역할은 우울증 증상 완화에 효과가 있는 것과 비슷하다. NET는 아토모세틴에 의해 차단되고 뇌의 NE 수치를 증가시킨다. 그것은 ADHD로 고통 받는 어린이와 성인 모두에게 집중력을 높이고, 충동성을 줄이며, 과잉 활동을 줄이는 데 효과가 있다.[25]
정신운동제
코카인
코카인은 강력한 정신 자극제로 가장 널리 남용되는 물질 중 하나로 알려져 있다.[26] 코카인은 노레피네프린, 세로토닌, 도파민 전달체의 비선택적 재흡수 억제제다. 이것은 이러한 화학 물질들의 사전 시냅스 단자로의[26] 흡수를 방해하고, 많은 도파민, 세로토닌, 노레피네프린 농도를 시냅스 구획에 쌓이게 한다. 코카인 중독의 가능성은 코카인의 생명을 위협하는 심혈관 효과에 교감 및 CNS 자율 시냅스에서의 NET 억제가 수반될 수 있다는 의견이 제시된 반면, CNS의 도파민 전달체에 미치는 영향의 결과라고 생각된다.[27]
암페타민
암페타민은 둘 다 뇌의 NE 수치를 증가시킨다는 점에서 코카인과 유사한 노레피네프린 수치에 영향을 미친다.[28] 암페타민성 약물(암페타민성 약물)은 신경전달물질 운반 방향에서 역전을 일으키는 NET를 포함한 모노아민 전달체용 기판이다.[16][29] 암페타민은 세포외 NE의 큰 축적을 일으킨다.[28] 뇌에서 높은 수준의 NE는 경각성과 무뇨극, 기관차, 동정적 효과를 포함한 암페타민의 심오한 효과의 대부분을 차지한다.[28] 그러나 암페타민이 뇌에 미치는 영향은 코카인이 뇌에 미치는 영향보다 느리지만 오래 지속된다.[28] MDMA(3,4-메틸렌디오옥시메탐페타민 또는 "에크스타시")는 레크리에이션 사용이 넓은 암페타민이다. 한 연구는 NET 억제제 리복세틴이 인간에게 미치는 MDMA의 자극제 효과를 감소시켜, NET가 MDMA의 심혈관계 및 자극제 유사효과에 있어 중요한 역할을 한다는 것을 보여준다고 보고했다.[30]
추가 연구
많은 뇌 질환에서 NET의 역할은 트랜스포터의 (dys) 규제를 이해하는 것의 중요성에 기초한다. 전달체와 연관된 단백질의 완전한 모델은 정신분열증, 정서장애, 자율장애와 같은 질병에 대한 약물요법을 설계하는데 유용할 것이다. 최근 발견된 NET의 메커니즘은 역방향으로 그리고 이온 채널로서 작용하는 능력을 포함하여 다른 연구 영역을 제공한다.[14][16]
정신분열증
정신분열증에서 NE의 역할은 완전히 이해되지는 않았지만, 이 주제에 대한 연구를 자극했다.[31][32][33][34] 연구자들 사이에 이해되어 온 유일한 관계는 뇌와 척수액(CSF)의 증가된 NE 수치와 정신분열증의 활동 사이에 긍정적인 상관관계가 있다는 것이다.[31][32][33][34] 한 연구에서 ADHD, 고혈압 등 의학적 상태를 치료하는 데 사용되는 약물인 클로니딘은 정상 대조군 그룹에서 NE의 대사물인 혈장 수치 MHPG(3-methoxy-4-hydroxyphenylglycol)가 현저하게 감소하는 것으로 나타났지만 정신분열증 환자군에서는 그렇지 않았다.[33] 이는 조현병에서 사전 시냅스 억제 수용체인 알파-2 아드레날린 수용체는 정상적으로 작동하는 알파-2 수용체에 비해 민감도가 낮을 수 있으므로 장애의 NE 수치 상승과 관련이 있음을 시사한다.[33] 뇌와 CSF의 NE 수치 증가 외에도, MHPG의 증가된 수치는 조현병 진단과 관련이 있다.[34] 정신분열증의 손상된 NE 규제는 연구자들에게 관심 영역이었고 이 주제에 대한 연구는 여전히 진행 중이다.[33][34]
이미징
양전자 방출 단층 촬영 영상 기법을 통해 NET을 선별적으로 조사하였으며, 11C ME@HAPTHI와 18F-MENER는 PET 영상 촬영을 위한 NET 선택형 무선 추적기 2종이다.[35] 이송체용 형광 기판은 임상 영상에 적합하지 않지만 격리된 장기나 조직의 이송 속도를 감시하는 데도 사용할 수 있다.[36][37]
참고 항목
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000103546 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000055368 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Pacholczyk T, Blakely RD, Amara SG (March 1991). "Expression cloning of a cocaine- and antidepressant-sensitive human noradrenaline transporter". Nature. 350 (6316): 350–4. Bibcode:1991Natur.350..350P. doi:10.1038/350350a0. PMID 2008212. S2CID 4333895.
- ^ a b c d e Schroeter S, Apparsundaram S, Wiley RG, Miner LH, Sesack SR, Blakely RD (May 2000). "Immunolocalization of the cocaine- and antidepressant-sensitive l-norepinephrine transporter". The Journal of Comparative Neurology. 420 (2): 211–32. doi:10.1002/(SICI)1096-9861(20000501)420:2<211::AID-CNE5>3.0.CO;2-3. PMID 10753308.
- ^ a b c d e f g h i j k l m n o p q Tellioglu T, Robertson D (November 2001). "Genetic or acquired deficits in the norepinephrine transporter: current understanding of clinical implications". Expert Reviews in Molecular Medicine. 2001 (29): 1–10. doi:10.1017/S1462399401003878. PMID 14987367.
- ^ Kim CH, Hahn MK, Joung Y, Anderson SL, Steele AH, Mazei-Robinson MS, Gizer I, Teicher MH, Cohen BM, Robertson D, Waldman ID, Blakely RD, Kim KS (December 2006). "A polymorphism in the norepinephrine transporter gene alters promoter activity and is associated with attention-deficit hyperactivity disorder". Proceedings of the National Academy of Sciences of the United States of America. 103 (50): 19164–9. Bibcode:2006PNAS..10319164K. doi:10.1073/pnas.0510836103. PMC 1748193. PMID 17146058.
- ^ a b c d Shannon JR, Flattem NL, Jordan J, Jacob G, Black BK, Biaggioni I, Blakely RD, Robertson D (February 2000). "Orthostatic intolerance and tachycardia associated with norepinephrine-transporter deficiency". The New England Journal of Medicine. 342 (8): 541–9. doi:10.1056/NEJM200002243420803. PMID 10684912.
- ^ Kim JW, Biederman J, McGrath CL, Doyle AE, Mick E, Fagerness J, Purcell S, Smoller JW, Sklar P, Faraone SV (June 2008). "Further evidence of association between two NET single-nucleotide polymorphisms with ADHD". Molecular Psychiatry. 13 (6): 624–30. doi:10.1038/sj.mp.4002090. PMID 17876324. S2CID 8341997.
- ^ Maarten E. A. Reith (2002). Neurotransmitter transporters: structure, function, and regulation. Humana Press. p. 120. ISBN 978-0-89603-945-2. Retrieved 27 October 2011.
- ^ Esler M, Alvarenga M, Pier C, Richards J, El-Osta A, Barton D, Haikerwal D, Kaye D, Schlaich M, Guo L, Jennings G, Socratous F, Lambert G (July 2006). "The neuronal noradrenaline transporter, anxiety and cardiovascular disease". Journal of Psychopharmacology. 20 (4 Suppl): 60–6. doi:10.1177/1359786806066055. PMID 16785272. S2CID 10728780.
- ^ a b c Stöber G, Nöthen MM, Pörzgen P, Brüss M, Bönisch H, Knapp M, Beckmann H, Propping P (November 1996). "Systematic search for variation in the human norepinephrine transporter gene: identification of five naturally occurring missense mutations and study of association with major psychiatric disorders". American Journal of Medical Genetics. 67 (6): 523–32. doi:10.1002/(SICI)1096-8628(19961122)67:6<523::AID-AJMG3>3.0.CO;2-I. PMID 8950409.
- ^ a b c d Sager JJ, Torres GE (August 2011). "Proteins interacting with monoamine transporters: current state and future challenges". Biochemistry. 50 (34): 7295–310. doi:10.1021/bi200405c. PMID 21797260.
- ^ a b Galli A, DeFelice LJ, Duke BJ, Moore KR, Blakely RD (October 1995). "Sodium-dependent norepinephrine-induced currents in norepinephrine-transporter-transfected HEK-293 cells blocked by cocaine and antidepressants". The Journal of Experimental Biology. 198 (Pt 10): 2197–212. doi:10.1242/jeb.198.10.2197. PMID 7500004.
- ^ a b c d e f g h i Torres GE, Gainetdinov RR, Caron MG (January 2003). "Plasma membrane monoamine transporters: structure, regulation and function". Nature Reviews. Neuroscience. 4 (1): 13–25. doi:10.1038/nrn1008. PMID 12511858. S2CID 21545649.
- ^ a b c Zhou J (December 2004). "Norepinephrine transporter inhibitors and their therapeutic potential". Drugs of the Future. 29 (12): 1235–1244. doi:10.1358/dof.2004.029.12.855246. PMC 1518795. PMID 16871320.
- ^ a b Gether U, Andersen PH, Larsson OM, Schousboe A (July 2006). "Neurotransmitter transporters: molecular function of important drug targets". Trends in Pharmacological Sciences. 27 (7): 375–83. doi:10.1016/j.tips.2006.05.003. PMID 16762425.
- ^ Schroeder C, Tank J, Boschmann M, Diedrich A, Sharma AM, Biaggioni I, Luft FC, Jordan J (January 2002). "Selective norepinephrine reuptake inhibition as a human model of orthostatic intolerance". Circulation. 105 (3): 347–53. doi:10.1161/hc0302.102597. PMID 11804991.
- ^ Morón JA, Brockington A, Wise RA, Rocha BA, Hope BT (January 2002). "Dopamine uptake through the norepinephrine transporter in brain regions with low levels of the dopamine transporter: evidence from knock-out mouse lines". The Journal of Neuroscience. 22 (2): 389–95. doi:10.1523/JNEUROSCI.22-02-00389.2002. PMC 6758674. PMID 11784783.
- ^ Yavich L, Forsberg MM, Karayiorgou M, Gogos JA, Männistö PT (September 2007). "Site-specific role of catechol-O-methyltransferase in dopamine overflow within prefrontal cortex and dorsal striatum". The Journal of Neuroscience. 27 (38): 10196–209. doi:10.1523/JNEUROSCI.0665-07.2007. PMC 6672678. PMID 17881525.
- ^ SSRI의 임상 약리학: 그룹으로서의 SSRI가 TCA, Preskorn과 어떻게 다른지
- ^ "What medications are used to treat ADHD?". National Institutes of Mental Health.
- ^ Simpson D, Plosker GL (2004). "Atomoxetine: a review of its use in adults with attention deficit hyperactivity disorder". Drugs. 64 (2): 205–22. doi:10.2165/00003495-200464020-00005. PMID 14717619.
- ^ "Atomoxetine -". PubMed Health. Retrieved 2 November 2011.
- ^ a b Macey DJ, Smith HR, Nader MA, Porrino LJ (January 2003). "Chronic cocaine self-administration upregulates the norepinephrine transporter and alters functional activity in the bed nucleus of the stria terminalis of the rhesus monkey". The Journal of Neuroscience. 23 (1): 12–6. doi:10.1523/JNEUROSCI.23-01-00012.2003. PMC 6742134. PMID 12514195.
- ^ Barker EL, Blakely RD (1995). "Norepinephrine and Serotonin Transporters". In Kupfer DJ, Bloom FE (eds.). Psychopharmacology: the fourth generation of progress. New York: Raven Press. ISBN 978-0-7817-0166-2. Retrieved 2 November 2011.
- ^ a b c d Drug and Human Performance Fact Sheets. "Methamphetamine (And Amphetamine)". Archived from the original on 31 October 2011. Retrieved 1 November 2011.
- ^ Sulzer D, Chen TK, Lau YY, Kristensen H, Rayport S, Ewing A (May 1995). "Amphetamine redistributes dopamine from synaptic vesicles to the cytosol and promotes reverse transport". The Journal of Neuroscience. 15 (5 Pt 2): 4102–8. doi:10.1523/JNEUROSCI.15-05-04102.1995. PMC 6578196. PMID 7751968.
- ^ Hysek CM, Simmler LD, Ineichen M, Grouzmann E, Hoener MC, Brenneisen R, Huwyler J, Liechti ME (August 2011). "The norepinephrine transporter inhibitor reboxetine reduces stimulant effects of MDMA ("ecstasy") in humans". Clinical Pharmacology and Therapeutics. 90 (2): 246–55. doi:10.1038/clpt.2011.78. PMID 21677639. S2CID 29087593.
- ^ a b Decaire, Michael. "The neurophysiology of schizophrenia: Etiology and Psychopharmacological treatment". Archived from the original on 17 February 2012. Retrieved 1 November 2011.
- ^ a b Breier A, Wolkowitz OM, Roy A, Potter WZ, Pickar D (November 1990). "Plasma norepinephrine in chronic schizophrenia". The American Journal of Psychiatry. 147 (11): 1467–70. doi:10.1176/ajp.147.11.1467. PMID 2221157.
- ^ a b c d e Sternberg DE, Charney DS, Heninger GR, Leckman JF, Hafstad KM, Landis DH (March 1982). "Impaired presynaptic regulation of norepinephrine in schizophrenia. Effects of clonidine in schizophrenic patients and normal controls". Archives of General Psychiatry. 39 (3): 285–9. doi:10.1001/archpsyc.1982.04290030025004. PMID 6279049.
- ^ a b c d van Kammen DP, Antelman S (April 1984). "Impaired noradrenergic transmission in schizophrenia?". Life Sciences. 34 (15): 1403–13. doi:10.1016/0024-3205(84)90054-7. PMID 6323903.
- ^ Rami-Mark C, Berroterán-Infante N, Philippe C, Foltin S, Vraka C, Hoepping A, et al. (December 2015). "Radiosynthesis and first preclinical evaluation of the novel norepinephrine transporter pet-ligand [(11)C]ME@HAPTHI". EJNMMI Research. 5 (1): 113. doi:10.1186/s13550-015-0113-3. PMC 4467816. PMID 26061602.
- ^ Cao LL, Holmes AP, Marshall JM, Fabritz L, Brain KL (January 2020). "Dynamic monitoring of single-terminal norepinephrine transporter rate in the rodent cardiovascular system: A novel fluorescence imaging method". Autonomic Neuroscience. 223: 102611. doi:10.1016/j.autneu.2019.102611. PMC 6977090. PMID 31901784.
- ^ Parker LK, Shanks JA, Kennard JA, Brain KL (February 2010). "Dynamic monitoring of NET activity in mature murine sympathetic terminals using a fluorescent substrate". British Journal of Pharmacology. 159 (4): 797–807. doi:10.1111/j.1476-5381.2009.00574.x. PMC 2829205. PMID 20136837.
외부 링크
- 미국 국립 의학 도서관의 노레피네프린+트랜스포터(MSH)