미각수용체
Taste receptor| 미각 수용체 2 | |
|---|---|
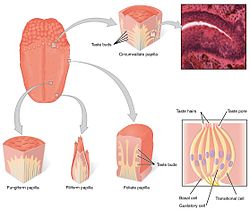 혀의 미각 수용체는 유두의 미뢰에 존재한다. | |
| 식별자 | |
| FMA | 84662 |
| 해부학 용어 | |
미각 수용체 또는 미각제는 미각을 촉진하는 세포 수용체의 한 종류이다.음식이나 다른 물질들이 입 안으로 들어가면, 분자는 침과 상호작용을 하고 구강과 다른 위치에 있는 미각 수용체와 결합하게 된다.미각을 주는 분자는 "비린내 나는"[1] 것으로 여겨진다.
척추동물의 미각수용체는 두 개의 [citation needed]과로 나뉜다.
- 타입 1, 스위트,[2] 2001년 첫 특징: TAS1R2 – TAS1R3
- 2000년에 [3]처음 특징지어진 2형 쓴맛 수용체: 사람에게는 25개의 다른 쓴맛 수용체가 있습니다.고양이에게는 12개, 닭에는 3개, 쥐에게는 35개의 다른 [4]쓴맛 수용체가 있습니다.
시각적인, 후각적인, "맛에 대한 지각", 3차적인, 그리고 기계적인, 모든 것이 맛에 대한 지각에 기여합니다.이 중 과도수용체 전위 양이온 채널 서브패밀리 V(TRPV1) 바닐로이드 수용체는 캡사이신 등의 일부 분자로부터의 열 인식을 담당하며 CMR1 수용체는 멘톨, 유칼립톨 및 이실린 [1]등의 분자로부터의 냉 인식을 담당한다.
조직 분포
미각 시스템은 미뢰에 있는 미각 수용체 세포로 구성됩니다.다시, 미뢰는 유두라고 불리는 구조물에 포함되어 있다.맛에는 균상 유두, 엽상 유두, 원주 유두의 세 가지 종류가 있습니다.(네 번째 유형인 필라형 유두에는 미뢰가 포함되어 있지 않습니다.유두 너머, 미각 수용체들은 또한 후두와 식도 상부와 같은 구개 및 소화기 계통의 초기 부분에 있습니다.혀에는 미주 신경, 설인 신경, 안면 신경 등 세 가지 뇌신경이 있습니다.TAS1R 및 TAS2R 미각 수용체를 자극하는 안면 신경의 광인두 신경과 척색 팀파니 지점은 광인두 신경은 TAS1R 및 TAS2R 미각 수용체를 자극한다.혀의 미각 수용체 옆에, 내장 상피는 또한 식욕, 면역 반응, 그리고 위장 운동[5] 조절과 관련된 여러 이펙터 시스템에 감각 정보를 전달하는 미묘한 화학 감각 시스템을 갖추고 있다.
2010년, 연구원들은 폐 조직에서 쓴 물질을 만나면 기도가 이완되는 쓴맛의 수용체를 발견했다.그들은 이 메커니즘이 폐 감염을 제거하는데 도움을 주기 때문에 진화적으로 적응할 수 있다고 믿지만, 천식과 만성 폐쇄성 폐질환을 [6]치료하는데도 이용될 수 있다.
단맛 수용체(T1R2/T1R3)는 뇌, 심장, 신장, 방광, 코 호흡 상피 등과 같은 인체 전체의 다양한 구강 외 장기에서 발견될 수 있습니다.대부분의 장기에서 수용체 기능은 [7]불분명하다.내장 및 췌장에서 발견되는 단맛 수용체는 내장 탄수화물 감지 과정의 대사 조절과 인슐린 [8]분비에 중요한 역할을 하는 것으로 밝혀졌다.이 수용체는 방광에서도 발견되는데, 이 수용체를 활성화시키는 인공 감미료의 섭취가 과도한 방광 [9]수축을 일으킬 수 있다는 것을 암시한다.
기능.
미각은 독소를 식별하고, 영양을 유지하며, 식욕, 면역 반응, 그리고 [5]위장 운동을 조절하는데 도움을 줍니다.오늘날에는 짠맛, 단맛, 쓴맛, 신맛, 우마미의 다섯 가지 기본 맛이 알려져 있다.짠맛과 신맛은 모두 이온 채널을 통해 감지됩니다.단맛, 쓴맛, 감칠맛은 G단백질 결합 미각수용체를 [10]통해 검출된다.
또한 단맛을 위한 미라쿨린이나 큐큘린, 쓴맛을 감추기 위한 스테루빈 등의 미각조절제로서 기능하는 약제도 있다.
작용 메커니즘
표준 쓴맛, 단맛 또는 우마미 맛 수용체는 7개의 막 통과 도메인을 가진 G 단백질 결합 수용체이다.미각수용체에서의 리간드 결합은 미각세포를 탈분극시키기 위해 제2의 메신저 캐스케이드를 활성화한다.구스두신은 가장 일반적인 맛의 Gα 서브유닛으로 TAS2R의 쓴맛 리셉션에 중요한 역할을 한다.구스두신은 시력 [11]변환에 관여하는 G단백질인 트랜스신(transducin)의 상동체이다.또한 미각수용체는 TRPM5 이온채널과 포스포리파아제 PLCβ2의 [12]사용을 공유한다.
고소함 또는 글루탐산염(우마미)
TAS1R1+TAS1R3 헤테로디머 수용체는 우마미 수용체로서 기능하며, L-아미노산 결합, 특히 L-글루탐산에 [2]반응한다.우마미 맛은 식품 첨가물인 글루탐산나트륨(MSG)과 가장 자주 관련되며 이노신 일인산(IMP)과 구아노신 일인산([13][14]GMP) 분자의 결합을 통해 강화될 수 있다.세포를 발현하는 TAS1R1+3은 주로 혀 끝과 가장자리에 있는 균상 유두와 [2]입천장에 있는 미각 수용체 세포에 존재한다.이 세포들은 뇌로 신호를 보내기 위해 척색 고막 신경에서 시냅스하는 것으로 보여지지만, 설인 신경의 일부 활성화가 발견되었습니다.[13][15]
대체 후보 우마미미 수용체로는 메타로트로픽 글루탐산 수용체의 스플라이스 변이체, mGluR4 및 mGluR1 및 NMDA [10][16][17][18]수용체가 있다.
노래새의 진화 과정에서 우마미미 수용체는 리간드 결합 부위의 구조적 변화를 겪었고, 이 새들은 이 [19]수용체에 의해 단맛을 감지할 수 있었다.
달콤해

TAS1R2+TAS1R3 헤테로디머 수용체는 다양한 당 및 [2][20]당 대체물에 결합함으로써 단맛 수용체로서 기능한다.세포를 발현하는 TAS1R2+3은 혀 뒤쪽 부근의 유두와 엽상 유두와 [2]입천장 미각 수용체 세포에 존재한다.이 세포들은 [10][15]뇌로 신호를 보내기 위해 고막과 광인두 신경에서 시냅스하는 것으로 보여진다.TAS1R3 호모디머는 TAS1R2+3과 거의 같은 방식으로 감미 수용체로서 기능하지만 감미 물질에 대한 민감도는 감소했습니다.천연당은 설탕 대체물보다 TAS1R3 수용체에 의해 더 쉽게 검출된다.이것은 설탕과 인공 감미료가 맛이 다른 [21]이유를 설명하는데 도움이 될 것이다.TAS1R3의 유전적 다형성은 아프리카계 미국인과 유럽 및 아시아계 [22][23]조상들 사이의 단맛 인식과 설탕 소비의 차이를 부분적으로 설명한다.
단맛에 대한 감각은 다른 동물들의 진화를 통해 변화해왔다.포유류는 단맛 수용체인 헤테로다이머 T1R2/T1R3를 통해 신호를 전달함으로써 단맛을 감지한다.그러나 조류에서는 T1R2 단량체가 존재하지 않고 진화 과정에서 변형을 거친 우마미미 수용체인 헤테로다이머 T1R1/T1R3를 통해 단맛을 감지한다.최근 실시된 연구에 따르면 울새의 진화 단계에 따라 감칠맛의 감칠맛과 단맛의 감칠맛의 증가가 있었던 반면 원시 울새의 부모는 감칠맛의 감칠맛만 느낄 수 있었다.연구자들은 이 현상에 대한 가능한 설명이 단맛 감지와 비감지성 새 사이의 우마미 수용체의 리간드 결합 부위의 구조적 변화라는 것을 발견했다.시간이 지남에 따라 결합 부위의 돌연변이가 발생한 것으로 추정되며, 이로 인해 우마미 미각 [19]수용체를 통해 단맛을 감지할 수 있었다.
쓴
TAS2R 단백질(InterPro: IPR007960)은 쓴맛 [24]수용체로 기능한다.43개의 인간 TAS2R 유전자가 있으며, 각각 (5개의 의사유전자를 제외한) 인트론 [10]및 GPCR 단백질 코드가 없다.이러한 단백질은 TAS1R 단백질과 달리 세포외 도메인이 짧고 유두, 입천장, 엽상 유두 및 후두개 미뢰에 위치하며 균상 [3][10]유두에서 발현을 감소시킨다.하나의 미각 수용체 세포에서 여러 개의 TAS2R이 발현되는 것은 확실하지만, 포유류가 다른 쓴 리간드의 [3][10]맛을 구별할 수 있을지는 여전히 논의되고 있다.그러나 TAS2R 유전자보다 쓴맛이 나는 화합물이 훨씬 더 많기 때문에 일부 중복이 일어나야 한다.일반적인 쓴맛 리간드는 시클로헥시미드, 데나토늄, PROP(6-n-프로필-2-티오우라실), PTC(페닐티오카르바미드) 및 β-글루코피라노시드를 [10]포함한다.
쓴 자극의 신호 전달은 구스두신의 α-서브유닛을 통해 이루어진다.이 G단백질 서브유닛은 미각 포스포디에스테라아제를 활성화하고 순환뉴클레오티드 수치를 낮춥니다.변환 경로의 추가 단계는 아직 알려지지 않았다.구스두신의 β-subunit은 또한 IP(이노시톨 삼인산)와 DAG(디글리세리드)를 활성화하여3 맛을 매개합니다.이러한 두 번째 메신저는 게이트 이온 채널을 열거나 내부 [25]칼슘을 방출할 수 있습니다.모든 TAS2R은 구스두신이 함유된 세포에 위치하지만, 구스두신의 녹아웃은 쓴맛에 대한 민감성을 완전히 없애지 않으며, 쓴맛을[12] 위한 중복 메커니즘을 제시한다(일반적으로 쓴맛은 [12]독소의 존재를 나타낸다).구스두신 비의존성 쓴맛을 위한 하나의 제안된 메커니즘은 특정 쓴맛 리간드에 의한 이온 채널 상호작용을 통해, 신맛과 짠맛 [10]자극의 맛에서 발생하는 이온 채널 상호작용과 유사하다.
가장 잘 연구된 TAS2R 단백질 중 하나는 PROP와 PTC의 맛에 기여하는 TAS2R38이다.그것은 미각 지각의 차이를 일으키는 다형성을 가진 최초의 미각 수용체이다.현재 연구는 그러한 다른 미각 표현형을 결정하는 다형성을 [10]결정하는 데 초점을 맞추고 있다.보다 최근의 연구는 다른 쓴맛 수용체 유전자의 유전적 다형성이 카페인, 퀴닌, 벤조산 [26]데나토늄의 쓴맛 지각에 영향을 미친다는 것을 보여준다.

쓴맛 수용체(TAS2R)는 기도(코와 부비강) 상피 조직의 [27]선천적 면역 체계에서 중요한 역할을 하는 것으로 입증되었다.이 타고난 면역 체계는 물리적 면역 체계 표면 장벽에 "활성 요새"[28]를 추가합니다.이 고정 면역 체계는 특정 수용체에 대한 리간드의 결합에 의해 활성화된다.이러한 천연 배위자는 TAS2R38의 경우 세균 표지자이며, 아실 호모세린 락톤[29] 또는 Pseudomonas aeruginosa에 의해 생성된 퀴놀론이다[30].포식자들로부터 보호하기 위해, 몇몇 식물들은 박테리아 표지를 모방하는 물질을 만들어냈다.이 식물 마임들은 혀와 뇌에 의해 쓴맛으로 해석됩니다.고정 면역 체계 수용체는 쓴맛 수용체인 TAS2R과 동일합니다.쓴맛 물질은 TAS2R 고정 면역 시스템의 작용제이다.[27] 선천적인 면역체계는 박테리아와 바이러스를 [31][32]파괴할 수 있는 일산화질소와 디펜신을 사용한다.(ActiveFortresses) 상기도(코, 굴, 기관지, 기관지)보다 다른 상피 조직의 예를 들어 알려진 이러한 고정된 선천적 면역 시스템:유방(상피 세포 유방), 내장과 인간의 피부 입에서 나온 가시 같은 분자들, 이와 관련된 쓴 미각 수용체, 그리고 쓴 맛의 순서와 상동 모델(keratinocytes)[33]. 유원지eptors는 BitterDB를 통해 이용할 수 있습니다.
시다
역사적으로 신맛은 유리 수소 이온+(H)이 직접적으로 미각 수용체를 탈분극시킬 때만 생성되는 것으로 생각되었다.그러나, 다른 작용 방법들과 함께 신맛에 대한 특정 수용체들이 현재 제안되고 있다.HCN 채널은 순환 뉴클레오티드 게이트 채널이기 때문에 그러한 제안이었다.현재 신맛에 기여하는 것으로 제안된 두 개의 이온 채널은 ASIC2와 TASK-1입니다.

소금.
지질, 복합 탄수화물, 물의 가능한 맛 감지와 함께 짠 맛에 대한 다양한 수용체들도 제안되어 왔다.이러한 수용체에 대한 증거는 대부분의 포유류 연구에서 설득력이 없었다.예를 들어, 나트륨 검출을 위해 제안된 ENaC 수용체는 드로소필라의 [10]나트륨 맛에 기여하는 것만 보여줄 수 있다.그러나 단백질 분해된 형태의 ENaC는 인간의 소금 맛 수용체 역할을 하는 것으로 나타났다.단백질 분해는 단백질이 분해되는 과정이다.ENaC의 성숙한 형태는 단백질 분해된 것으로 생각되지만, 단백질 분해된 형태는 조직이 불완전한 상태로 존재한다.알파, 베타 및 감마 서브유닛으로 구성된 헤테뮬레이트 ENAC를 과잉 발현하기 위해 생성된 세포의 단백질 분해는 단백질 분해 ENAC 대 비 단백질 분해 ENAC의 활성을 선택적으로 증가시키는 화합물을 식별하기 위해 사용되었다.인간의 감각 연구는 단백질 분해 ENAC를 강화시키는 화합물이 식탁용 소금, 즉 염화나트륨의 짠맛을 강화시키는 기능을 한다는 것을 보여주었고, 이는 단백질 분해 ENAC가 최초의 인간 소금 맛 [34]수용체로 확인되었습니다.
탄산화
시어 수용체에 접속된 효소는 탄산수에 [35]관한 정보를 전달한다.
뚱뚱해요.
지방의 가능한 미각 수용체 CD36이 확인되었다.[36]CD36은 미뢰에[37] 존재하며 혀 리파아제가 생성되는 외발산 및 엽산 유두( to頭)에 국소화되어 있으며 연구 결과 CD36 수용체가 긴 사슬 지방산을 [38]결합하는 것으로 나타났다.인간 피험자의 CD36 발현량의 차이는 지방을 [39]맛보는 능력과 관련이 있으며, 지방 맛에 대한 수용체의 관계에 대한 사례를 만들었다.CD36 수용체에 대한 추가 연구는 진정한 지방 맛 수용체의 존재를 결정하는 데 유용할 수 있다.
GPR120 및 GPR40은 구강 [40]지방 반응에 관여하고 있으며, 이들의 부재는 지방 선호도를 낮추고 경구 투여 지방산에 [41]대한 신경 반응을 감소시킨다.
TRPM5는 구강 지방 반응에 관여하는 것으로 나타났고 가능한 구강 지방 수용체로 확인되었지만, 최근의 증거는 TRPM5를 주로 하류 [42][43]작용기로 제시한다.
종류들
인간의 쓴맛 수용체 유전자는 TAS2R1에서 TAS2R64로 명명되며, 존재하지 않는 유전자, 의사유전자 또는 가장 최근의 인간 게놈 조립체에 주석을 달지 않은 제안된 유전자로 인해 많은 차이가 있다.많은 쓴맛 수용체 유전자들은 또한 같은 유전자를 지칭하는 여러 다른 유전자 이름과 혼동되는 동의어 이름을 가지고 있다.인간의 쓴맛 수용체 유전자의 전체 목록은 아래 표를 참조하십시오.
| 학급 | 진 | 동의어 | 에일리어스 | 궤적 | 묘사 |
|---|---|---|---|---|---|
| 유형 1 (스위트) | TAS1R1 | GPR70 | 1p36.23 | ||
| TAS1R2 | GPR71 | 1p36.23 | |||
| TAS1R3 | 1p36 | ||||
| 유형 2 (표준) | TAS2R1 | 5p15 | |||
| TAS2R2 | 7p21.3 | 위 유전자. | |||
| TAS2R3 | 7q31.3-q32 | ||||
| TAS2R4 | 7q31.3-q32 | ||||
| TAS2R5 | 7q31.3-q32 | ||||
| TAS2R6 | 7 | 인간 게놈 어셈블리에 주석이 붙어 있지 않다 | |||
| TAS2R7 | 12p13 | ||||
| TAS2R8 | 12p13 | ||||
| TAS2R9 | 12p13 | ||||
| TAS2R10 | 12p13 | ||||
| TAS2R11 | 인간에게는 없다 | ||||
| TAS2R12 | TAS2R26 | 12p13.2 | 위 유전자. | ||
| TAS2R13 | 12p13 | ||||
| TAS2R14 | 12p13 | ||||
| TAS2R15 | 12p13.2 | 위 유전자. | |||
| TAS2R16 | 7q31.1-q31.3 | ||||
| TAS2R17 | 인간에게는 없다 | ||||
| TAS2R18 | 12p13.2 | 위 유전자. | |||
| TAS2R19 | TAS2R23, TAS2R48 | 12p13.2 | |||
| TAS2R20 | TAS2R49 | 12p13.2 | |||
| TAS2R21 | 인간에게는 없다 | ||||
| TAS2R22 | 12 | 인간 게놈 어셈블리에 주석이 붙어 있지 않다 | |||
| TAS2R24 | 인간에게는 없다 | ||||
| TAS2R25 | 인간에게는 없다 | ||||
| TAS2R27 | 인간에게는 없다 | ||||
| TAS2R28 | 인간에게는 없다 | ||||
| TAS2R29 | 인간에게는 없다 | ||||
| TAS2R30 | TAS2R47 | 12p13.2 | |||
| TAS2R31 | TAS2R44 | 12p13.2 | |||
| TAS2R32 | 인간에게는 없다 | ||||
| TAS2R33 | 12 | 인간 게놈 어셈블리에 주석이 붙어 있지 않다 | |||
| TAS2R34 | 인간에게는 없다 | ||||
| TAS2R35 | 인간에게는 없다 | ||||
| TAS2R36 | 12 | 인간 게놈 어셈블리에 주석이 붙어 있지 않다 | |||
| TAS2R37 | 12 | 인간 게놈 어셈블리에 주석이 붙어 있지 않다 | |||
| TAS2R38 | 34년 7월 | ||||
| TAS2R39 | 34년 7월 | ||||
| TAS2R40 | GPR60 | 34년 7월 | |||
| TAS2R41 | 34년 7월 | ||||
| TAS2R42 | 12p13 | ||||
| TAS2R43 | 12p13.2 | ||||
| TAS2R45 | GPR59 | 12 | |||
| TAS2R46 | 12p13.2 | ||||
| TAS2R50 | TAS2R51 | 12p13.2 | |||
| TAS2R52 | 인간에게는 없다 | ||||
| TAS2R53 | 인간에게는 없다 | ||||
| TAS2R54 | 인간에게는 없다 | ||||
| TAS2R55 | 인간에게는 없다 | ||||
| TAS2R56 | 인간에게는 없다 | ||||
| TAS2R57 | 인간에게는 없다 | ||||
| TAS2R58 | 인간에게는 없다 | ||||
| TAS2R59 | 인간에게는 없다 | ||||
| TAS2R60 | 7 | ||||
| TAS2R62P | 34년 7월 | 위 유전자. | |||
| TAS2R63P | 12p13.2 | 위 유전자. | |||
| TAS2R64P | 12p13.2 | 위 유전자. |
기능 상실
많은 종에서, 미각 수용체는 기능 상실을 보여 왔다.미각 수용체가 기능을 상실하는 진화 과정은 미각 [44]수용체의 전문화와 분리를 촉진하기 위한 먹이 생태와 연관된 적응 진화라고 여겨진다.모든 미각 수용체 중 쓴맛, 단맛, 우마미는 미각 수용체의 불활성화와 먹이행동 [44]사이에 상관관계가 있는 것으로 나타났다.하지만, 어떤 척추동물도 쓴맛 수용체 [44]유전자가 없다는 것을 뒷받침하는 강력한 증거는 없다.
단맛 수용체는 기능이 상실된 미각 수용체 중 하나이다.포유동물에서 주요 단맛 수용체는 Type 1 미각 수용체 Tas1r2/Tas1r3이다.[45]고양이와 흡혈박쥐와 같은 포유류 종들은 [45]단맛을 느낄 수 없다는 것을 보여왔다.이들 종에서 감미수용체 기능 상실의 원인은 Tas1r2의 [45]의사유전화에 기인한다.Tas1r2의 유사유전성은 닭이나 혀가 없는 서양발톱개구리 등 비동물종에서도 관찰되며 단맛을 [45]느낄 수 없는 것으로 나타났다.Tas1r2의 유사유전화는 널리 퍼져 있으며,[45] 카르니보라목에서 독립적이다.미각 수용체의 유사유전화는 개방형 판독 프레임(ORF)[46]의 유해한 돌연변이에 의해 발생한다는 것이 많은 연구에서 밝혀졌다.한 연구에서 비고양이의 육식성 종에서 이 종들은 Tas1r2의 ORF 교란 돌연변이를 보였으며 [45]종들 사이에서 독립적으로 발생했다는 것이 밝혀졌다.그들은 또한 그들의 [45]혈통에서 높은 차이를 보였다.Tas1r2의 유사유전화는 식육종이 식생활행위로 [45]단맛을 내는 능력을 상실한 수렴진화를 통해 발생했다는 가설이다.
우마미는 또한 많은 종에서 기능이 상실된 미각 수용체이다.우마미 미각 수용체는 Tas1r1/Tas1r3이다.[45]돌고래와 바다사자를 포함한 수생 포유류의 2개 계통에서 Tas1r1은 [45]의사유전된 것으로 밝혀졌다.Tas1r1의 유사유전화는 육식성 육식성 [45]종에서도 발견되었다.판다는 육식 동물에 속하지만 식생활의 99%가 대나무로 우마미 [47]맛을 낼 수 없는 초식동물이다.팬더의 게놈 배열에 따르면 Tas1r1 유전자는 [47]유사 유전자이다.한 연구에서, 판다를 제외한 모든 목의 종에서, 열린 읽기 틀이 [47]유지되고 있다는 것이 밝혀졌습니다.판다의 경우 동의어 치환비율이 카르니보라목의 [47]다른 종들보다 훨씬 높은 것으로 밝혀졌다.이 데이터는 판다가 육식동물에서 초식동물로 [45]바뀐 것을 보여주는 화석 기록 날짜와 관련이 있다.따라서 판다의 우마미의 기능 상실은 팬더가 [45]고기에 덜 의존하게 된 식생활의 변화로 인해 발생한다는 가설이 있다.하지만, 이러한 연구들은 Tas1r1 [47]수용체를 보유하고 있는 말이나 소와 같은 초식동물을 설명하지는 않는다.
전체적으로 미각 수용체의 기능 상실은 종의 [46]식생활 변화로 인한 진화 과정이다.
레퍼런스
- ^ a b This, Hervé (2012). "The Science of the Oven - Excerpt from Chapter 1". Retrieved 30 Apr 2014.
- ^ a b c d e Nelson G, Hoon MA, Chandrashekar J, et al. (August 2001). "Mammalian sweet taste receptors". Cell. 106 (3): 381–90. doi:10.1016/S0092-8674(01)00451-2. PMID 11509186. S2CID 11886074.
- ^ a b c Adler E, Hoon MA, Mueller KL, et al. (March 2000). "A novel family of mammalian taste receptors". Cell. 100 (6): 693–702. doi:10.1016/S0092-8674(00)80705-9. PMID 10761934. S2CID 14604586.
- ^ "Browse Receptors". Bitter DB.
- ^ a b Steensels S, Depoortere I (2018). "Chemoreceptors in the Gut". Annual Review of Physiology. 80: 117–141. doi:10.1146/annurev-physiol-021317-121332. PMID 29029594.
- ^ Deshpande DA, Wang WC, McIlmoyle EL, et al. (November 2010). "Bitter taste receptors on airway smooth muscle bronchodilate by localized calcium signaling and reverse obstruction". Nature Medicine. 16 (11): 1299–304. doi:10.1038/nm.2237. PMC 3066567. PMID 20972434.
- ^ Laffitte, Anni; Neiers, Fabrice; Briand, Loïc (July 2014). "Functional roles of the sweet taste receptor in oral and extraoral tissues". Current Opinion in Clinical Nutrition and Metabolic Care. 17 (4): 379–385. doi:10.1097/mco.0000000000000058. ISSN 1363-1950. PMC 4059820. PMID 24763065.
- ^ Henquin, J.-C. (2012-08-21). "Do Pancreatic Cells "Taste" Nutrients to Secrete Insulin?". Science Signaling. 5 (239): pe36. doi:10.1126/scisignal.2003325. ISSN 1945-0877. PMID 22932700. S2CID 206671643.
- ^ Elliott, Ruth A.; Kapoor, Shalini; Tincello, Douglas G. (December 2011). "Expression and Distribution of the Sweet Taste Receptor Isoforms T1R2 and T1R3 in Human and Rat Bladders". Journal of Urology. 186 (6): 2455–2462. doi:10.1016/j.juro.2011.07.083. ISSN 0022-5347. PMID 22019168.
- ^ a b c d e f g h i j Bachmanov AA, Beauchamp GK (2007). "Taste receptor genes". Annual Review of Nutrition. 27: 389–414. doi:10.1146/annurev.nutr.26.061505.111329. PMC 2721271. PMID 17444812.
- ^ Sainz E, Cavenagh MM, LopezJimenez ND, et al. (June 2007). "The G-protein coupling properties of the human sweet and amino acid taste receptors". Developmental Neurobiology. 67 (7): 948–59. doi:10.1002/dneu.20403. PMID 17506496. S2CID 29736077.
- ^ a b c Zhang Y, Hoon MA, Chandrashekar J, et al. (February 2003). "Coding of sweet, bitter, and umami tastes: different receptor cells sharing similar signaling pathways". Cell. 112 (3): 293–301. doi:10.1016/S0092-8674(03)00071-0. PMID 12581520. S2CID 718601.
- ^ a b Nelson G, Chandrashekar J, Hoon MA, et al. (March 2002). "An amino-acid taste receptor". Nature. 416 (6877): 199–202. Bibcode:2002Natur.416..199N. doi:10.1038/nature726. PMID 11894099. S2CID 1730089.
- ^ Delay ER, Beaver AJ, Wagner KA, et al. (October 2000). "Taste preference synergy between glutamate receptor agonists and inosine monophosphate in rats". Chemical Senses. 25 (5): 507–15. doi:10.1093/chemse/25.5.507. PMID 11015322.
- ^ a b Danilova V, Hellekant G (March 2003). "Comparison of the responses of the chorda tympani and glossopharyngeal nerves to taste stimuli in C57BL/6J mice". BMC Neuroscience. 4: 5. doi:10.1186/1471-2202-4-5. PMC 153500. PMID 12617752.
- ^ Brand JG (April 2000). "Receptor and transduction processes for umami taste". The Journal of Nutrition. 130 (4S Suppl): 942S–5S. doi:10.1093/jn/130.4.942S. PMID 10736357.
- ^ Chaudhari N, Landin AM, Roper SD (February 2000). "A metabotropic glutamate receptor variant functions as a taste receptor". Nature Neuroscience. 3 (2): 113–9. doi:10.1038/72053. PMID 10649565. S2CID 16650588.
- ^ Toyono T, Seta Y, Kataoka S, et al. (July 2003). "Expression of metabotropic glutamate receptor group I in rat gustatory papillae". Cell and Tissue Research. 313 (1): 29–35. doi:10.1007/s00441-003-0740-2. PMID 12898387. S2CID 41546387.
- ^ a b Toda, Yasuka; Ko, Meng-Ching; Liang, Qiaoyi; et al. (2021-07-08). "Early origin of sweet perception in the songbird radiation". Science. 373 (6551): 226–231. Bibcode:2021Sci...373..226T. doi:10.1126/science.abf6505. ISSN 0036-8075. PMID 34244416. S2CID 235769720.
- ^ Li X, Staszewski L, Xu H, et al. (April 2002). "Human receptors for sweet and umami taste". Proceedings of the National Academy of Sciences of the United States of America. 99 (7): 4692–6. Bibcode:2002PNAS...99.4692L. doi:10.1073/pnas.072090199. PMC 123709. PMID 11917125.
- ^ Zhao GQ, Zhang Y, Hoon MA, et al. (October 2003). "The receptors for mammalian sweet and umami taste". Cell. 115 (3): 255–66. doi:10.1016/S0092-8674(03)00844-4. PMID 14636554. S2CID 11773362.
- ^ Hwang LD, Lin C, Gharahkhani P, et al. (April 2019). "New insight into human sweet taste: a genome-wide association study of the perception and intake of sweet substances". American Journal of Clinical Nutrition. 109 (6): 1724–1737. doi:10.1093/ajcn/nqz043. PMC 6537940. PMID 31005972.
- ^ Yousif R (March 2020). "Exploring the Molecular Interactions between Neoculin and the Human Sweet Taste Receptors through Computational Approaches" (PDF). Sains Malaysiana. 49 (3): 517–525. doi:10.17576/jsm-2020-4903-06.
- ^ Chandrashekar J, Mueller KL, Hoon MA, et al. (March 2000). "T2Rs function as bitter taste receptors". Cell. 100 (6): 703–11. doi:10.1016/S0092-8674(00)80706-0. PMID 10761935. S2CID 7293493.
- ^ Margolskee RF (January 2002). "Molecular mechanisms of bitter and sweet taste transduction". The Journal of Biological Chemistry. 277 (1): 1–4. doi:10.1074/jbc.R100054200. PMID 11696554.
- ^ Hwang LD, Gharahkhani P, Breslin PA, et al. (September 2018). "Bivariate genome-wide association analysis strengthens the role of bitter receptor clusters on chromosomes 7 and 12 in human bitter taste". BMC Genomics. 19 (1): 678. doi:10.1186/s12864-018-5058-2. PMC 6142396. PMID 30223776.
- ^ a b Lee RJ, Cohen, NA (2015). "Taste receptors in innate immunity". Cell. Mol. Life Sci. 72 (2): 217–236. doi:10.1007/s00018-014-1736-7. PMC 4286424. PMID 25323130.
- ^ "Le système immunitaire fixe, les TAS2R" (in French). September 4, 2020.
- ^ Lee RJ, Cohen, NA (2015). "Role of the bitter taste receptor T2R38 in upper respiratory infection and chronic rhinosinusitis". Current Opinion in Allergy and Clinical Immunology. 15 (1): 14–20. doi:10.1097/ACI.0000000000000120. PMC 5902169. PMID 25304231.
- ^ Freund J, Mansfield CJ, Doghramji LJ, and Lee RJ (2018). "Activation of airway epithelial bitter taste receptors by Pseudomonas aeruginosa quinolones modulates calcium, cyclic-AMP, and nitric oxide signaling". Journal of Biological Chemistry. 293 (25): 9824–9840. doi:10.1074/jbc.RA117.001005. PMC 6016477. PMID 29748385.
- ^ Klotman ME, Chang TL (June 2006). "Defensins in innate antiviral immunity". Nature Reviews. Immunology. 6 (6): 447–56. doi:10.1038/nri1860. PMID 16724099. S2CID 8603587.
- ^ Croen K (1993). "Evidence for antiviral effect of nitric oxide. Inhibition of herpes simplex virus type 1 replication". The Journal of Clinical Investigation. 91 (6): 2446–2452. doi:10.1172/JCI116479. PMC 443304. PMID 8390481.
- ^ Woelfle U, Elsholz F (2015). "Expression and Functional Activity of the Bitter Taste Receptors TAS2R1 and TAS2R38 in Human Keratinocytes". Skin Pharmacology and Physiology. 28 (3): 137–146. doi:10.1159/000367631. PMID 25573083. S2CID 19912094.
- ^ Shekdar K, Langer J, Venkatachalan S, et al. (March 2021). "Cell engineering method using fluorogenic oligonucleotide signaling probes and flow cytometry". Biotechnology Letters. 43 (5): 949–958. doi:10.1007/s10529-021-03101-5. ISSN 0141-5492. PMC 7937778. PMID 33683511.
- ^ "Archived copy". Archived from the original on 2015-07-03. Retrieved 2014-10-06.
{{cite web}}: CS1 maint: 제목으로 아카이브된 복사(링크) - ^ Laugerette F, Passilly-Degrace P, Patris B, et al. (November 2005). "CD36 involvement in orosensory detection of dietary lipids, spontaneous fat preference, and digestive secretions". The Journal of Clinical Investigation. 115 (11): 3177–84. doi:10.1172/JCI25299. PMC 1265871. PMID 16276419.
- ^ Simons PJ, Kummer JA, Luiken JJ, Boon L (December 2011). "Apical CD36 immunolocalization in human and porcine taste buds from circumvallate and foliate papillae". Acta Histochemica. 113 (8): 839–43. doi:10.1016/j.acthis.2010.08.006. PMID 20950842.
- ^ Baillie AG, Coburn CT, Abumrad NA (September 1996). "Reversible binding of long-chain fatty acids to purified FAT, the adipose CD36 homolog". The Journal of Membrane Biology. 153 (1): 75–81. doi:10.1007/s002329900111. PMID 8694909. S2CID 5911289.
- ^ Pepino MY, Love-Gregory L, Klein S, Abumrad NA (March 2012). "The fatty acid translocase gene CD36 and lingual lipase influence oral sensitivity to fat in obese subjects". Journal of Lipid Research. 53 (3): 561–6. doi:10.1194/jlr.M021873. PMC 3276480. PMID 22210925.
- ^ DiPatrizio NV (September 2014). "Is fat taste ready for primetime?". Physiology & Behavior. 136: 145–54. doi:10.1016/j.physbeh.2014.03.002. PMC 4162865. PMID 24631296.
- ^ Cartoni C, Yasumatsu K, Ohkuri T, et al. (June 2010). "Taste preference for fatty acids is mediated by GPR40 and GPR120". The Journal of Neuroscience. 30 (25): 8376–82. doi:10.1523/JNEUROSCI.0496-10.2010. PMC 6634626. PMID 20573884.
- ^ Mattes RD (September 2011). "Accumulating evidence supports a taste component for free fatty acids in humans". Physiology & Behavior. 104 (4): 624–31. doi:10.1016/j.physbeh.2011.05.002. PMC 3139746. PMID 21557960.
- ^ Liu P, Shah BP, Croasdell S, Gilbertson TA (June 2011). "Transient receptor potential channel type M5 is essential for fat taste". The Journal of Neuroscience. 31 (23): 8634–42. doi:10.1523/JNEUROSCI.6273-10.2011. PMC 3125678. PMID 21653867.
- ^ a b c Feng P, Zhao H (June 2013). "Complex evolutionary history of the vertebrate sweet/umami taste receptor genes". Chinese Science Bulletin. 58 (18): 2198–2204. Bibcode:2013ChSBu..58.2198F. doi:10.1007/s11434-013-5811-5.
- ^ a b c d e f g h i j k l m Jiang P, Josue J, Li X, et al. (March 2012). "Major taste loss in carnivorous mammals". Proceedings of the National Academy of Sciences of the United States of America. 109 (13): 4956–61. doi:10.1073/pnas.1118360109. PMC 3324019. PMID 22411809.
- ^ a b Antinucci M, Risso D (2017-11-28). "A Matter of Taste: Lineage-Specific Loss of Function of Taste Receptor Genes in Vertebrates". Frontiers in Molecular Biosciences. 4: 81. doi:10.3389/fmolb.2017.00081. PMC 5712339. PMID 29234667.
- ^ a b c d e Zhao H, Yang JR, Xu H, Zhang J (December 2010). "Pseudogenization of the umami taste receptor gene Tas1r1 in the giant panda coincided with its dietary switch to bamboo". Molecular Biology and Evolution. 27 (12): 2669–73. doi:10.1093/molbev/msq153. PMC 3108379. PMID 20573776.
외부 링크
- Adler E, Hoon MA, Mueller KL, et al. (2000). "A Novel Family of Mammalian Taste Receptors - An Investigative Review". Davidson College Biology Department. Retrieved 2008-08-11.
- 미각+수용체, 미국 국립 의학 도서관(MeSH)의 유형+1
- 미각+수용체, 미국 국립 의학 도서관(MeSH)의 유형+2


