코리-이츠노 저감
Corey–Itsuno reduction| 코리-이츠노 저감 | |
|---|---|
| 의 이름을 따서 명명됨 | 일라이어스 제임스 코리 이츠노 신이치 |
| 반응형 | 유기 산화 환원 반응 |
| 식별자 | |
| 유기화학 포털 | 코리박시시바타 환원 |
CBS(Corey-Bakshi-Shibata) 환원이라고도 하는 코리-이츠노 환원(Corey-Itsuno reducation)은 아키랄 케톤이 에난티오 선택적 환원되어 해당 키랄 비-레이스 알코올을 생성하는 화학 반응이다.케톤의 에난티오선택적 환원을 매개하는 옥사자보리딘 시약은 이쓰노 연구소에 의해 이전에 개발되었으므로 이 변환은 이쓰노-코리 옥사자보리딘 [1]환원이라고 더 적절하게 불릴 수 있다.
역사
1981년 이쓰노와 동료들은 아히랄 케톤을 항안티오 선택적 및 높은 [1]수율로 키랄 알코올로 환원하기 위해 키랄 알콕시-아민-보란 복합체를 사용하는 것을 처음으로 보고했습니다.몇 년 후 1987년 E. J. Corey와 동료들은 키랄 아미노알코올과 보란(BH)3 사이의 반응을 개발하여 옥사자보리딘 제품을 생산했으며, 옥사자보리딘은 BH•[2][3]THF가 존재하는3 상태에서 아킬라 케톤의 항안티오 선택적 감소를 빠르게 촉매하는 것으로 나타났다.
그 후 CBS 환원은 유기 화학자들에 의해 아히랄 케톤의 비대칭 환원을 위한 신뢰할 수 있는 방법으로 사용되어 왔다.특히, 많은 천연물의 합성 뿐만이 아니라, 산업 분야에서도 대규모로 활용되고 있다(아래의 범위 참조).몇 가지 리뷰가 [4][5][6]발표되었습니다.
메커니즘
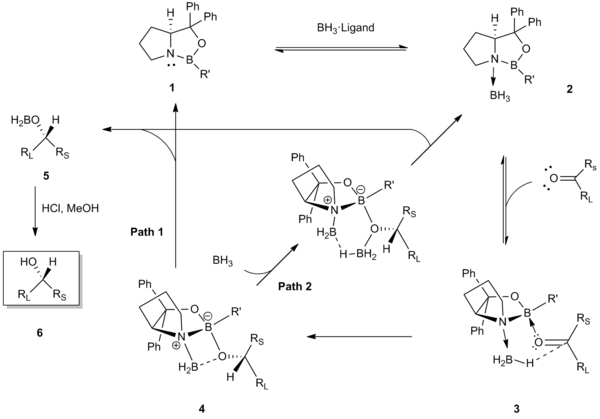
Corey와 동료들은 원래 촉매 [2][3]감소에서 얻은 선택성을 설명하기 위해 다음과 같은 반응 메커니즘을 제안했습니다.
이 메커니즘의 첫 번째 단계는 옥사자보리딘 CBS 촉매 1의 질소 원자에 대한 BH의 배위를3 포함한다.이 배위는 수소화물 공여체로 BH를3 활성화하고 촉매의 내환붕소의 [5]Lewis 산도를 높이는 역할을 합니다.배위 촉매-보란 복합체 2의 X선 결정 구조와 B NMR 분광 분석은 이 초기 [5][7]단계를 뒷받침했다.이어서 촉매의 내환상 붕소는 입체적으로 접근하기 쉬운 전자 론쌍(즉, 작은 치환기 Rs에 가까운 론쌍)의 케톤에 배위한다.3의 이 우선 결합은 케톤(큰L R 치환기)과 촉매의 R'군 사이의 입체 상호작용을 최소화하기 위해 작용하며, 카르보닐과 배위 보란은 6원소 전이 상태 [8][9]4를 통해 바람직한 얼굴 선택성 수소화물 전이를 위해 정렬된다.수소화물 전이는 키랄 알콕시보란 5를 생성하고, 산성 작업 시 키랄알코올 6을 생성한다.촉매를 재생하는 마지막 단계는 두 가지 다른 경로(패스 1 또는 2)[10][11][12]로 이루어질 수 있습니다.
이러한 얼굴 선택적이고 분자 내 수소화물 전달의 주요 원동력은 루이스 염기성 질소에 대한 배위에 의한 보란 시약의 동시 활성화와 케톤에 [5]대한 배열을 위한 내환형 붕소 원자의 루이스 산도의 강화이다.
범위 및 제한
스테레오 및 화학 선택성
CBS 감소는 입체선택적 및 화학선택적 방식으로 다양한 유형의 케톤을 감소시키는 효과적이고 강력한 방법임이 입증되었다.기질은 헤테로아톰을 [5][13]함유하는 케톤뿐만 아니라 아릴지방족, 디지방족, 디아릴, α, β불포화 에논 및 ynone계도 다수 포함한다.CBS 촉매와 보란 환원제의 다른 유도체의 조합은 에난티오선택성을 최적화하기 위해 사용되었습니다.
이 기판 선택에서 주목할 만한 몇 가지 흥미로운 사례가 있습니다.우선 다이어릴계 9의 경우 케톤 치환기의 이성질에도 불구하고 비교적 높은 입체선택성을 얻을 수 있어 스테로이드 외에 전자제품이 CBS [5]환원 입체선택성에 관여할 수 있음을 시사한다.이논 11, 12의 알킨 부분 치환의 차이는 알킨이 보다 입체적으로 부피가 큰 치환기로 기능하는 선택성의 변화를 가져온다.α, β 불포화계 10~12는 C-C 불포화결합의 수소화붕괴의 부작용 가능성에도 불구하고 케톤을 효율적으로 환원할 수 있다.CBS의 감소는 또한 보란과 배위할 수 있는 케톤 13에서와 같이 헤테로아톰의 존재를 용인하는 것으로 나타났다.
실험적인 고려사항 및 제한사항
반응 혼합물의 수분 존재는 항산화물질 과잉에 상당한 영향을 미치는 것으로 나타났으며, 따라서 CBS 환원은 반드시 무수 [14]조건에서 수행되어야 한다.온도는 또한 관찰된 입체 선택성에 중요한 역할을 한다.일반적으로 저온에서는 에난티오머 과잉(ee's)을 얻을 수 있다.단, 온도가 상승하면 사용되는 [15]촉매구조 및 보란환원제에 따라 ee 값이 최대치에 도달한다.보란 시약 카테콜보란을 사용하면 -126°C의 낮은 온도에서 현저한 에난티오선택성으로 CBS 감소에 참여하는 것으로 나타나 저온에서 [16][17]얻을 수 있는 감소된 ee 값을 개선할 수 있는 잠재적 해결책을 제공합니다.
BH를 CBS 저감의 환원제로 사용하는3 것과 관련된 에난티오선택성 문제가 보고되었다.시판되고3 있는 BH• 솔루션Nettles 등에 의해 평가된 THF에는 미량의 붕소수물이 포함되어 있으며, 이는 에난티오선택성 감소를 [18]초래하는 비선택적 감소에 관여한다.붕화수소 촉매 환원 경로는 CBS 촉매 환원 경로보다 훨씬 느리지만, 측면 반응은 여전히 입체 선택성을 최적화하기 위한 잠재적 과제를 제시한다.
2012년 마할 외 연구진은 현장에서 조제된 N, N-디에틸아닐린 보란 및 N-디에틸아닐린 염산나트륨 및 (S)-α, 알파-디페닐프로필리놀리놀리닌 촉매를 사용하여 케톤의 비대칭 감소를 위한 안전하고 저렴한 방법을 개발했다.
바리에이션
Corey에 의해 개발된 CBS 촉매 1은 CBS 환원 반응에 일반적으로 사용되고 있지만, 촉매의 다른 유도체는 성공적으로 개발되어 활용되고 있습니다.CBS 촉매의 R' 그룹은 감소의 반선택성에 중요한 역할을 하며, 위의 Scope 섹션에서 설명한 바와 같이 선택성을 [5][13]최적화하기 위해 CBS R' 그룹의 몇 가지 변형이 사용되었습니다.
적용들
지난 몇 십 년 동안, CBS의 감소는 락톤, 테르페노이드, 알칼로이드, 스테로이드, 그리고 [5][6][20]비오틴을 포함한 상당한 수의 천연물의 합성에 있어 상당한 합성 효용성을 얻었다.선택적인 축소는 산업에서도 대규모로 채용되고 있다.존스 등CBS 저감을 이용하여 안압을 [14]낮추기 위해 치료적으로 사용된 수용성 탄산 무수분해효소 억제제인 MK-0417의 총합성을 이용하였다.Me를 포함한 CBS 옥사자보리딘 촉매를 R'기로 하여 주요 이환 술폰 중간체의 비대칭 환원을 달성하였다.
1,1,1-트리클로로-2-케토 화합물의 비대칭 환원은 자연 또는 비자연 입체 화학 및 다양한 측쇄 중 하나를 선택하여 아미노산과 관련 구조의 합성을 위한 Corey-Link 반응의 첫 번째 단계이다.
7-(벤질록시) 헵트-1-en-3-One의 비대칭적 감소는 (S)-7-(벤질록시) 헵트-1-en-3-ol로 이어지며, 이는 현재 암세포의 잠재적인 억제 에놀에테르를 포함하는 에나미드로 연구되고 있다.키랄 생성물의 선택적 형성은 (R)-CBS 촉매에 의해 89%의 수율과 91%의 에난티오머 초과로 [21]달성됩니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Hirao, A.; Itsuno, S.; Nakahama, S.; Yamazaki, N. (1981), "Asymmetric reduction of aromatic ketones with chiral alkoxy-amineborane complexes", Journal of the Chemical Society, Chemical Communications, 7 (7): 315, doi:10.1039/C39810000315
- ^ a b Corey, E. J.; Bakshi, R. K.; Shibata, S. (1987), "Highly enantioselective borane reduction of ketones catalyzed by chiral oxazaborolidines. Mechanism and synthetic implications", Journal of the American Chemical Society, 109 (18): 5551–5553, doi:10.1021/ja00252a056
- ^ a b Corey, E. J.; Bakshi, R. K.; Shibata, S.; Chen, C. P.; Singh, V. K. (1987), "A stable and easily prepared catalyst for the enantioselective reduction of ketones. Applications to multistep syntheses", Journal of the American Chemical Society, 109 (25): 7925–7926, doi:10.1021/ja00259a075
- ^ Deloux, L.; Srebnik, M. (1993), "Asymmetric boron-catalyzed reactions", Chemical Reviews, 93 (2): 763–784, doi:10.1021/cr00018a007
- ^ a b c d e f g h Corey, E. J.; Helal, C. J. (1998), "Reduction of Carbonyl Compounds with Chiral Oxazaborolidine Catalysts: A New Paradigm for Enantioselective Catalysis and a Powerful New Synthetic Method", Angewandte Chemie International Edition, 37 (15): 1986–2012, doi:10.1002/(sici)1521-3773(19980817)37:15<1986::aid-anie1986>3.0.co;2-z, PMID 29711061
- ^ a b Cho, B. T. (2006), "Recent advances in the synthetic applications of the oxazaborolidine-mediated asymmetric reduction", Tetrahedron, 62 (33): 7621–7643, doi:10.1016/j.tet.2006.05.036
- ^ Corey, E. J.; Azimioara, M.; Sarshar, S. (1992), "X-Ray crystal structure of a chiral oxazaborolidine catalyst for enantioselective carbonyl reduction", Tetrahedron Letters, 33 (24): 3429–3430, doi:10.1016/s0040-4039(00)92654-6
- ^ Evans, D. (1988), "Stereoselective organic reactions: catalysts for carbonyl addition processes", Science, 240 (4851): 420–6, Bibcode:1988Sci...240..420E, doi:10.1126/science.3358127, PMID 3358127
- ^ Jones, D. K.; Liotta, D. C.; Shinkai, I.; Mathre, D. J. (1993), "Origins of the enantioselectivity observed in oxazaborolidine-catalyzed reductions of ketones", The Journal of Organic Chemistry, 58 (4): 799–801, doi:10.1021/jo00056a001
- ^ Corey, E. J. (1990), "New enantioselective routes to biologically interesting compounds", Journal of the American Chemical Society, 62 (7): 1209–1216, doi:10.1351/pac199062071209, S2CID 97731491
- ^ Nevalainen, V. (1994), "Quantum chemical modeling of chiral catalysis. Part 15. On the role of hydride-bridged borane - alkoxyborane complexes in the catalytic enantioselective reduction of ketones promoted by chiral oxazaborolidines", Tetrahedron: Asymmetry, 5 (2): 289–296, doi:10.1016/s0957-4166(00)86186-8
- ^ Quallich, G. J.; Blake, J. F.; Woodall, T. M. (1994), "A combined synthetic and ab initio study of chiral oxazaborolidines structure and enantioselectivity relationships", Journal of the American Chemical Society, 116 (19): 8516–8525, doi:10.1021/ja00098a012
- ^ a b Quallich, G. J.; Woodall, T. M. (1993), "Enantioselective oxazaborolidine reduction of ketones containing heteroatoms", Tetrahedron Letters, 34 (5): 785–788, doi:10.1016/0040-4039(93)89012-f
- ^ a b Jones, T. K.; Mohan, J. J.; Xavier, L. C.; Blacklock, T. J.; Mathre, D. J.; Sohar, P.; Jones, E. T. T.; Reamer, R. A.; Roberts, F. E.; Grabowski, E. J. J. (1991), "An asymmetric synthesis of MK-0417. Observations on oxazaborolidine-catalyzed reductions", The Journal of Organic Chemistry, 56 (2): 763–769, doi:10.1021/jo00002a050
- ^ Bulliard, Michael (1999). "Chapter 11.1: Asymmetric Reduction of Prochiral Ketones Catalyzed by Oxazaborolidines". In Ager, David (ed.). Handbook of Chiral Chemicals. Marcel Decker. pp. 211–225. ISBN 0824710584.
- ^ Corey, E. J.; Link, J. O. (1989), "A new chiral catalyst for the enantioselective synthesis of secondary alcohols and deuterated primary alcohols by carbonyl reduction", Tetrahedron Letters, 30 (46): 6275–6278, doi:10.1016/s0040-4039(01)93871-7
- ^ Corey, E. J.; Bakshi, R. K. (1990), "A new system for catalytic enantioselective reduction of achiral ketones to chiral alcohols. Synthesis of chiral α-hydroxy acids", Tetrahedron Letters, 31 (5): 611–614, doi:10.1016/s0040-4039(00)94581-7
- ^ Nettles, S. M.; Matos, K.; Burkhardt, E. R.; Rouda, D. R.; Corella, J. A. (2002), "Role of NaBH 4 Stabilizer in the Oxazaborolidine-Catalyzed Asymmetric Reduction of Ketones with BH 3 - THF", The Journal of Organic Chemistry, 67 (9): 2970–2976, doi:10.1021/jo016257c, PMID 11975554
- ^ Mahale, Rajendra D.; Chaskar, Sudhir P.; Patil, Kiran E.; Maikap, Golak C.; Gurjar, Mukund K. (2012). "Corey–Itsuno Reduction of Ketones: A Development of Safe and Inexpensive Process for Synthesis of Some API Intermediates". Organic Process Research & Development. 16 (4): 710–713. doi:10.1021/op300034u.
- ^ Stemmler, R. T. (2007), "CBS Oxazaborolidines - Versatile Catalysts for Asymmetric Synthesis", Synlett, 2007 (6): 0997–0998, doi:10.1055/s-2007-973876
- ^ Prabhakar Reddy, D.; Zhang, Ning; Yu, Zhimei; Wang, Zhen; He, Yun (2017-10-02). "Total Synthesis of Kanamienamide". The Journal of Organic Chemistry. 82 (20): 11262–11268. doi:10.1021/acs.joc.7b01984. ISSN 0022-3263. PMID 28944669.